基于CT征象构建肾透明细胞癌WHO/ISUP分级积分评价系统
2022-02-01赵才勇陈超陈文严志强康书朝崔凤
赵才勇 陈超 陈文 严志强 康书朝 崔凤
肾透明细胞癌(clear cell renal cell carcinoma,ccRCC)是肾细胞癌最常见的病理亚型,占70%~80%,其侵袭性强,肿瘤相关致死率高[1]。2016版WHO/国际泌尿病理学会(International Society of Urological Pathology,ISUP)分级系统[2]根据肿瘤细胞核仁明显程度将ccRCC分为4个等级,其中Ⅰ级和Ⅱ级为低级别肿瘤,Ⅲ级和Ⅳ级为高级别肿瘤。术前准确的肿瘤分级有助于临床治疗方案的制订和预测预后[3-4]。CT多期增强扫描是ccRCC早期诊断、肿瘤分期等术前评估常用的影像学检查方法。笔者通过对ccRCC患者CT征象筛选有效特征因子,构建术前无创预测ccRCC WHO/ISUP分级的积分评价系统,旨在为临床治疗方案的选择和预后判断提供客观依据。
1 对象和方法
1.1 对象 收集2017年1月至2022年9月杭州市中医院(87例)和浙江大学医学院附属邵逸夫医院(53例)收治且经病理检查证实的ccRCC患者共140例,男98例,女42例,年龄28~86岁。纳入标准:(1)经手术病理检查证实且能明确病理分级的ccRCC;(2)术前行含平扫及增强皮髓质期、肾实质期和延迟期的肾脏CT扫描。排除标准:(1)CT图像质量欠佳不能满足图像分析;(2)术前经放化疗、介入等干预治疗。根据WHO/ISUP分级,低级别组98例(Ⅰ级13例,Ⅱ级85例),高级别组42例(Ⅲ级34例,Ⅳ级8例)。采用分层抽样法将患者以8∶2的比例随机分为训练集(112例,ccRCC低级别78例,高级别34例)和验证集(28例,ccRCC低级别20例,高级别8例)。本研究经杭州市中医院医学伦理委员会批准(2022LL010)。
1.2 CT检查方法 采用Siemens Sensation 16排、Somatom Force 192排或Philips Brilliance 128排螺旋CT扫描仪。扫描参数:管电压120 kVp,管电流自动毫安秒设置;层厚5 mm,层间距5 mm。增强扫描采用高压注射器经肘静脉以2.5~3.0 ml/s注射碘海醇(300 mgI/ml),剂量1.5 ml/kg,分别于35、90、180 s行皮髓质期、肾实质期和延迟期扫描。
1.3 CT图像分析 由2位经验丰富的放射科高年资主治医师在不知病理分级的情况下独立观察分析图像。根据肾细胞癌CT图像征象评价标准(参照既往文献有关肾肿瘤图像征象评价标准修订[5-7])进行定性、定量评价,主要包括:(1)肿瘤大小、数目、位置;(2)肿瘤形状与边界(类圆型:肿瘤呈类圆形、边界清楚;分叶型:肿瘤呈分叶状、边界清楚;浸润型:肿瘤浸润生长、边界欠清)、囊变(肿瘤边界清楚且形态规则无强化低密度区,以其占肿瘤比例1/3为临界值,分为无或少量囊变和大量囊变)、坏死(边界模糊或形态不规则无强化低密度区,以其占肿瘤比例1/3为临界值,分为无或少量坏死和大量坏死)、钙化、假包膜、肿瘤血管;(3)皮髓质期强化程度:肿瘤实质强化程度高于或接近肾皮质定义为明显强化,反之即为轻中度强化。
1.4 统计学处理 采用SPSS 26.0和Medcalc 19.0统计软件。非正态分布的计量资料以M(P25,P75)表示,组间比较采用Mann-WhitneyU检验;计数资料组间比较采用χ2检验。将差异有统计学意义的变量采用向前逐步选择法进行多因素logistic回归分析。根据回归模型构建积分模型,采用Ben等[8]计算公式(b/bmin×2,b为各变量的回归系数;bmin为最小回归系数)四舍五入计算每个独立因素的权重得分,各独立因素得分相加为模型总积分。绘制ROC曲线评价模型的诊断效能,采用Hosmer-Lemeshow检验评价模型的校准度。采用DeLong法比较logistic回归模型和积分模型的AUC。为方便临床应用,将积分模型分为3个积分区间。P<0.05为差异有统计学意义。
2 结果
2.1 训练集低级别组与高级别组ccRCC患者CT征象的比较 训练集中,低级别组与高级别组患者的肿瘤大小、位置、形状与边界、坏死、钙化、肿瘤血管和皮髓质期强化程度比较差异均有统计学意义(均P<0.05),但两组患者数目、囊变、假包膜比较差异均无统计学意义(均P>0.05),见表1,典型病例见图1、2。
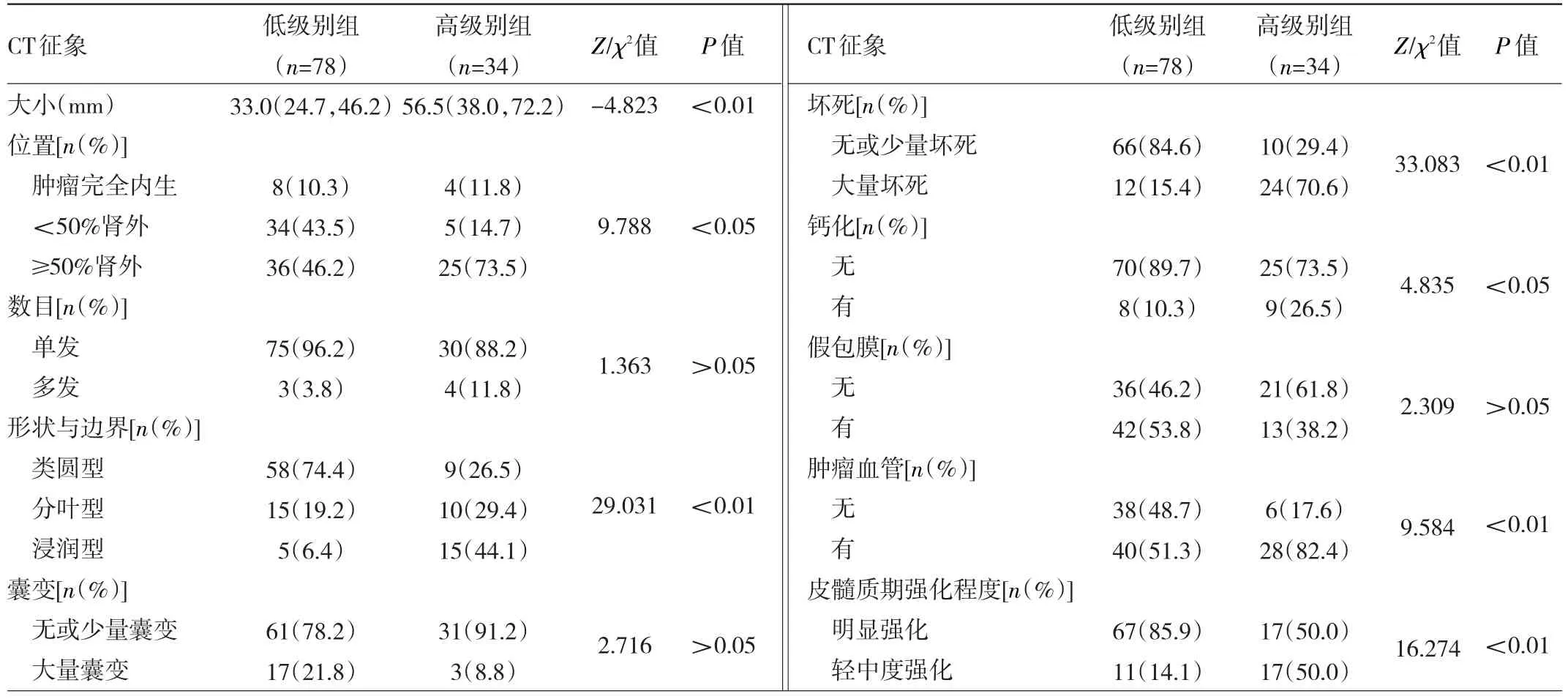
表1 训练集低级别组与高级别组ccRCC患者CT征象的比较

图1 71岁女性右肾低级别ccRCC患者(WHO/ISUPⅡ级)CT检查图[a:CT平扫病灶呈不均匀等低密度;b:CT增强皮髓质期,病灶呈类圆形,边界清楚(0分),实质部分明显强化,强化程度高于肾皮质(0分);c:CT增强肾实质期,实质强化减退,内见少许坏死区(0分)]

图2 70岁男性右肾高级别ccRCC患者(WHO/ISUPⅢ级)CT检查图[a:CT平扫病灶呈不均匀等低密度;b:CT增强皮髓质期,病灶形态欠规则,边界不清(3分),实质部分轻中度不均匀强化,强化程度低于肾皮质(2分);c:CT增强肾实质期,实质强化减退,内见大片坏死区(3分)]
2.2 logistic回归模型构建和效能评价 两组间单因素分析差异有统计学意义的7个变量方差膨胀因子均<10(容许度均>0.1),表明各变量之间不存在多重共线性。多因素logistic回归分析结果显示,形状与边界、坏死和皮髓质期强化程度对鉴别低级别和高级别的ccRCC患者差异均有统计学意义(均P<0.05),其中分叶型或浸润型、大量坏死及皮髓质期轻中度强化是预测高级别ccRCC的独立危险因素,见表2。Hosmer-Lemeshow检验表明该模型有较好的校准能力(P>0.05),该模型的 AUC 为 0.851(95%CI:0.762~0.941,P<0.01),其诊断ccRCC分级的灵敏度为0.794,特异度为0.846,见图3。
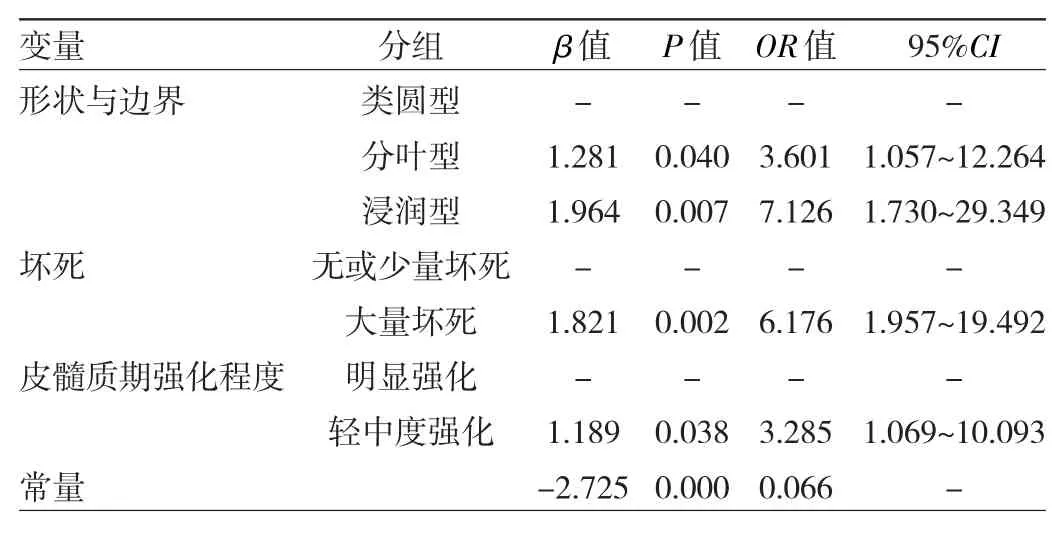
表2 ccRCC分级的多因素logistic回归分析模型

图3 鉴别低级别组和高级别组ccRCC logistic回归模型和积分模型的ROC曲线
2.3 积分模型构建和效能评价 基于多因素logistic回归模型各变量的回归系数b值构建ccRCC分级的积分模型,包括形状与边界(分叶型2分或浸润型3分)、大量坏死(3分)及皮髓质期轻中度强化(2分),总积分为8分。Hosmer-Lemeshow检验表明该模型的校准度好(P>0.05),该模型的AUC为0.850(95%CI:0.760~0.940,P<0.01),应用Youden指数确定最佳阈值(3.5),灵敏度为0.765,特异度为0.859,见图3。logistic回归模型和积分模型之间ROC曲线的AUC差异无统计学意义(Z=0.616,P>0.05),表明两模型高度吻合。
2.4 积分模型的验证 为方便临床评估与应用,进一步将积分模型分为3个积分区间:0~3分、4~6分、7~8分,见表3。随着积分增加,各积分区间高级别ccRCC的发生率逐渐增高;验证集进一步检测积分评价系统,各积分区间高级别ccRCC的发生率分别为10.0%(2/20)、60.0%(3/5)、100.0%(3/3),见表3。

表3 高级别ccRCC在各积分区间的发生率
3 讨论
ccRCC WHO/ISUP分级系统是判断肿瘤恶性程度、预测侵袭性和潜在转移能力的有效参数,直接影响临床治疗方案的选择和预后判断,是ccRCC患者5年生存率的预后决定因素之一[3-4]。由于肿瘤异质性的限制,经皮肾脏穿刺活检有时无法准确判断ccRCC组织分级,且其为有创检查,有可能出现术后出血、感染等并发症[9]。CT多期增强扫描是临床诊断ccRCC及术前评估常用的影像学方法。本研究基于ccRCC患者CT征象成功筛选出预测WHO/ISUP分级的3个独立危险因素:形状与边界、坏死、皮髓质期强化程度,进一步构建的积分评价系统有助于术前无创预测ccRCC组织学分级,方便临床推广应用。
多项研究发现基于CT平扫、增强图像的纹理分析、机器学习等方法可用于术前预测ccRCC的WHO/ISUP高低分级,其AUC为0.81~0.94[10-12]。本研究术前预测ccRCC WHO/ISUP高低分级的logistic回归模型和积分模型的 AUC 分别为 0.851(95%CI:0.762~0.941)、0.850(95%CI:0.760~0.940),诊断效能类似与文献报道的组学模型,而且其操作简单,便于日常临床工作中应用。笔者进一步研究发现,在积分评价系统第一积分区间(0~3分),训练集和验证集高级别ccRCC的发生率仅为9.3%、10.0%,少于2个独立危险因素,诊断更倾向于低级别ccRCC;在第三积分区间(7~8分),训练集和验证集均无低级别ccRCC发生,表明3个独立危险因素均阳性表达,诊断更倾向于高级别ccRCC。随着积分增加,高级别ccRCC的发生率逐步增高,低级别ccRCC的可能性降低。
有研究表明,肿瘤的形状与边界是预测ccRCC病理分级的独立因素[5,7]。本积分系统中分叶型和浸润型是预测高级别ccRCC的独立危险因素,对应的OR值分别为3.601、7.126。李琼等[7]研究发现70.7%高级别ccRCC表现为分叶状或边界不清,而73.0%低级别ccRCC表现为类圆形且边界清楚。由于高级别肿瘤分化程度低、生长快,当局部受包膜束缚时,肿瘤形态不规则、分叶状改变;浸润性生长,与周围正常组织分界不清,反应了肿瘤侵袭性及恶性程度高。本研究中73.5%高级别ccRCC呈分叶型或浸润型,而74.4%低级别ccRCC呈类圆型,与李琼等研究报道的结论相符。
本研究显示肿瘤内大量坏死是预测高级别ccRCC的独立危险因素,OR值为6.176,其中70.6%(24/34)的高级别ccRCC伴有明显坏死,而低级别ccRCC大片坏死发生率仅为15.4%(12/78)。肿瘤性坏死与肾细胞癌的侵袭性相关,是其预后不良的独立预测因素[13]。由于高级别肿瘤侵袭性强、生长速度过快,新生血管不能满足其代谢需求,容易导致瘤体内部大面积坏死。因此,当肿瘤出现边界不清无强化的大片坏死区时,相比低级别ccRCC,诊断高级别ccRCC的可能性更大。高级别组ccRCC实质部分皮髓质期强化程度低于低级别组,Coy等[14]研究亦支持本研究结论,进一步多因素logistic回归表明皮髓质期强化程度是预测ccRCC高低分级的独立预测因素,OR值为3.285。可能原因为由于高级别组ccRCC微小血管密度低于低级别组[15],肿瘤早期强化程度与其自身微小血管密度呈正相关,从而导致其皮髓质期强化程度弱于低级别组。
本研究局限性在于:(1)本研究为回顾性研究,可能存在选择偏倚;(2)样本量较少,尤其是Ⅰ级和Ⅳ级ccRCC患者较少,有待于进一步加大样本量并作前瞻性研究。
综上所述,形状与边界、坏死程度和皮髓质期强化程度是预测ccRCC WHO/ISUP分级系统的独立危险因素,基于以上CT征象构建的积分评价系统方便日常临床应用,为治疗方案的选择和预后判断提供重要的参考依据。
