杜仲叶提取物对SHR大鼠血管内皮损伤的保护作用
2022-02-01李辉李攀峰杨婷张文杰李钦
李辉李攀峰杨婷张文杰李钦
河南大学 药学院,河南 开封475004
高血压作为一种危害人类健康的全球性慢性疾病,可引起心、脑、眼、肾等多种靶器官损伤[1-2]。高血压与血管结构变化密切相关,长期压力超载使血管壁张力持续升高,血管活性因子受损引起血管内皮功能受损,若不能得到及时有效的阻止和逆转,极易导致脑卒中、动脉粥样硬化、心肌梗塞等心血管疾病,加剧高血压患者伤残率[3-4]。
中医理论认为“病位在肝,根源在肾”是高血压的主要病机[5]。杜仲叶性微辛、温;具有补肝肾,强筋骨的功效[6]。杜仲叶含有环烯醚萜类、木脂素类、黄酮类、苯丙素类以及生物碱、氨基酸等多种化合物,有研究发现杜仲叶中绿原酸和总黄酮有降压作用[7-8],但杜仲叶提取物对血管内皮功能的保护机制尚不清楚。本实验通过检测给药期间SHR 大鼠尾动脉收缩压和舒张压,血清中NO、e NOs、AngII、TNF-、IL-6 含量和主动脉血管HE染色、Masson染色和Rho A 和ROCK1蛋白及mRNA 表达水平考察其对血管内皮功能的保护机制,为杜仲叶进一步开发利用提供科学依据。
1 材料与方法
1.1 仪器、试剂与动物
无创尾套法血压仪(上海艾尔科特生物科技有限公司);Multiskan MK3酶标仪(美国Thermo公司);Nikon Eclipse E100正置光学显微镜(日本尼康);JHBE-100A 闪式提取器(智晶生物);旋转蒸发仪(郑州长城科工贸仪器有限公司);DYY-6C 垂直电泳仪(北京六一仪器厂)。
杜仲叶由国家林业局原阳杜仲种植基地提供,经河南大学李钦教授鉴定为杜仲科植物杜仲Eucommia ulmoidesOliv.的干燥叶。一氧化氮(NO)试剂盒(Servicebio),内皮型一氧化氮(eNOs)ELISA 试剂盒(上海江莱生物科技有限公司),血管紧张素Ⅱ(AngⅡ)试剂盒、白介素-6(IL-6)试剂盒、肿瘤坏死因子(TNF-α)试剂盒(均购自Boster Biological Technology 公司),BCA蛋白浓度试剂盒,ECL化学发光试剂盒均购自Servicebio,抗体:RhoA、ROCK1、β-actin(abcam),其余所用试剂均为分析纯。
SPF级雄性Wistar Kyoto大鼠和原发性高血压(SHR)大鼠,由北京维通利华实验动物技术有限公司提供,许可证编号:SCXK(京)2016-0006。
1.2 实验方法
1.2.1 试验药物制备
杜仲叶提取物采用实验室优化工艺制备[9],将20 L 70%乙醇和2 kg杜仲叶粉浸泡8 h后,闪式提取3次(每次5 min),滤液合并后减压浓缩至2 L,得到杜仲叶提取物(出膏率28.67%)。
1.2.2 动物分组及给药
雄性WKY 大鼠8只作为正常(CK)组(0.5%CMC-Na)。雄性SHR 大鼠40只,随机分为5组(n=8):杜仲叶提取物高剂量(HEU)组(8.24 g·kg-1)、中剂量(MEU)组(4.12 g·kg-1)、低剂量(LEU)组(2.06 g·kg-1)、模型(DM)组(0.5%CMC-Na)、阳性药(P)组(0.4 mg·kg-1培哚普利),以10 ml·kg-1·d-1体积灌胃8周。
1.2.3 大鼠收缩压和舒张压
采用无创尾套法测量大鼠安静清醒状态下尾动脉收缩压(SBP)和舒张压(DBP),入组前和给药8周后测量大鼠的收缩压(SBP)和舒张压(DBP)变化,每只大鼠连续测量3次取均值。
1.2.4 大鼠血清活性因子
给药结束后禁食12 h,腹腔注射10%水合氯醛麻醉,腹主动脉采血,4 ℃3 000 r·min-1离心15 min,取血清。按照试剂盒说明书测定血清中NO、eNOs、AngII、TNF-、IL-6的含量。
1.2.5 大鼠主动脉组织病理学检查
腹主动脉采血结束后打开大鼠胸腔,打开胸腔分离并剪下主动脉,去除周围过多的结缔组织,一半固定于4%多聚甲醛,一半保存在电镜固定液中。HE 染色观察血管形态变化,Masson 胶原染色观察血管胶原沉积情况,电镜观察主动脉超微结构变化。
1.2.6 大鼠主动脉Rho A、ROCK1 蛋白的表达
取大鼠主动脉组织用预冷的PBS缓冲液漂洗,PIPA 裂解液与PMSF 以4∶1 的比例配制裂解液提取蛋白,4 ℃12 000 r/min离心20 min后取上清液,BCA 蛋白定量试剂盒测定蛋白含量,然后加入上样缓冲液沸水浴进行蛋白变性,-80 ℃分装保存。取蛋白30 g,行十二烷基磺酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳,0.45-μmPVDF膜转膜2 h,5%脱脂奶粉封闭1 h,一抗4 ℃孵育过夜,TBST洗膜3次,8 min/次,二抗室温孵育1 h,TBST 洗膜3次,8 min/次。用ECL化学发光技术对印迹曝光摄图并进行灰度值分析。
1.2.7 大鼠主动脉RhoA、Rock1 m RNA 的表达
取主动脉组织100 mg,用Trizol一步法提取总RNA,使用Nanodrop 2000得到RNA 的浓度,浓度过高的则进行稀释,使其终浓度为200 ng/μL左右。取一个PCR 试管,加入RNA2μg。加入oligo(d T)181μL,用无核糖核酸酶的去离子水补充至12μL。取PCR,配制反应体系,每个反转录产物均配制3管,试剂及使用量为:2×PCR Mix(12.5μL)、7.54 M 基因引物(2.0μL)、反转录产物(2.5μL)、dd H2O(8.0μL)。95 ℃条件下,预变性10 min;60 ℃条件下,60s循环40次,60 ℃至95 ℃条件下,每30s温度增加1℃进行PCR 的扩增。计算表达水平比率:表达量的比值=2-ΔΔCT,实验重复三次。引物序列如下:GAPDH 引物:上游:5'-CTGGAGAAACCTGCCAAGTATG-3',下游:5'-GGTGGAAGAATGGGAGTTGCT-3';Rho A 引物:上游:5'-TGTGGCAGATATTGAAGTGGACG-3',下游:5'-CGCCTTGTGTGCTCATCATTC-3';ROCK1 引物:上游:5'-CCCGATCATCCCCTAGAACC-3',下游:5'-TTGGAGCAAGCTGTCGACTG-3'。
1.2.8 数据统计分析
实验数据采用SPSS 22.0进行分析处理,计量资料均用表示,多组间比较采用单因素方差分析,2组间比较采用t检验,用P<0.05表示显著统计学差异。
2 结果与分析
2.1 杜仲叶提取物对大鼠收缩压和舒张压的影响
给药前,DM 组和各给药组收缩压(SBP)和舒张压(DBP)无统计学差异(P>0.05),且SBP 和DBP值均显著高于CK 组(P<0.05)。给药8 周后,与DM 组相比,各给药组大鼠的SBP和DBP均明显降低(P<0.05),HEU 和MEU 组降血压效果最好。结果见表1。
表1 杜仲叶提取物对SHR大鼠血压的影响(,mmHg)

表1 杜仲叶提取物对SHR大鼠血压的影响(,mmHg)
a与CK 组比较,P<0.05;b与DM 组比较,P<0.05。
2.2 杜仲叶提取物对大鼠血清活性因子的影响
给药8周后,与CK 组相比,DM 组大鼠血清中TNF-α、IL-6、Ang Ⅱ含量显著升高(P<0.05),NO、eNOs含量显著降低(P<0.05),与DM 组比较,LEU、MEU、HEU、P组血清中NO、e NOs含量升高(P<0.05),TNF-α、IL-6、Ang Ⅱ含量降低(P<0.05)。结果见表2。
表2 杜仲叶提取物对SHR大鼠血管活性因子的影响()

表2 杜仲叶提取物对SHR大鼠血管活性因子的影响()
a与CK 组比较,P<0.05;b与DM 组比较,P<0.05。
2.3 杜仲叶提取物对大鼠主动脉的影响
HE 染色:CK 组大鼠主动脉形态结构完整、层次清晰,排列整齐,管壁无增厚,内皮细胞无损伤;与CK组相比,DM 组主动脉内膜呈不规则增厚,细胞外基质增多,内皮细胞排列紊乱,边缘粗糙、断裂。给药8周后,LEU、MEU、HEU 组和P组可不同程度地改善内皮损伤的病理状态,主动脉内膜增厚不明显,内皮细胞排列整齐,无明显断裂。结果见图1。
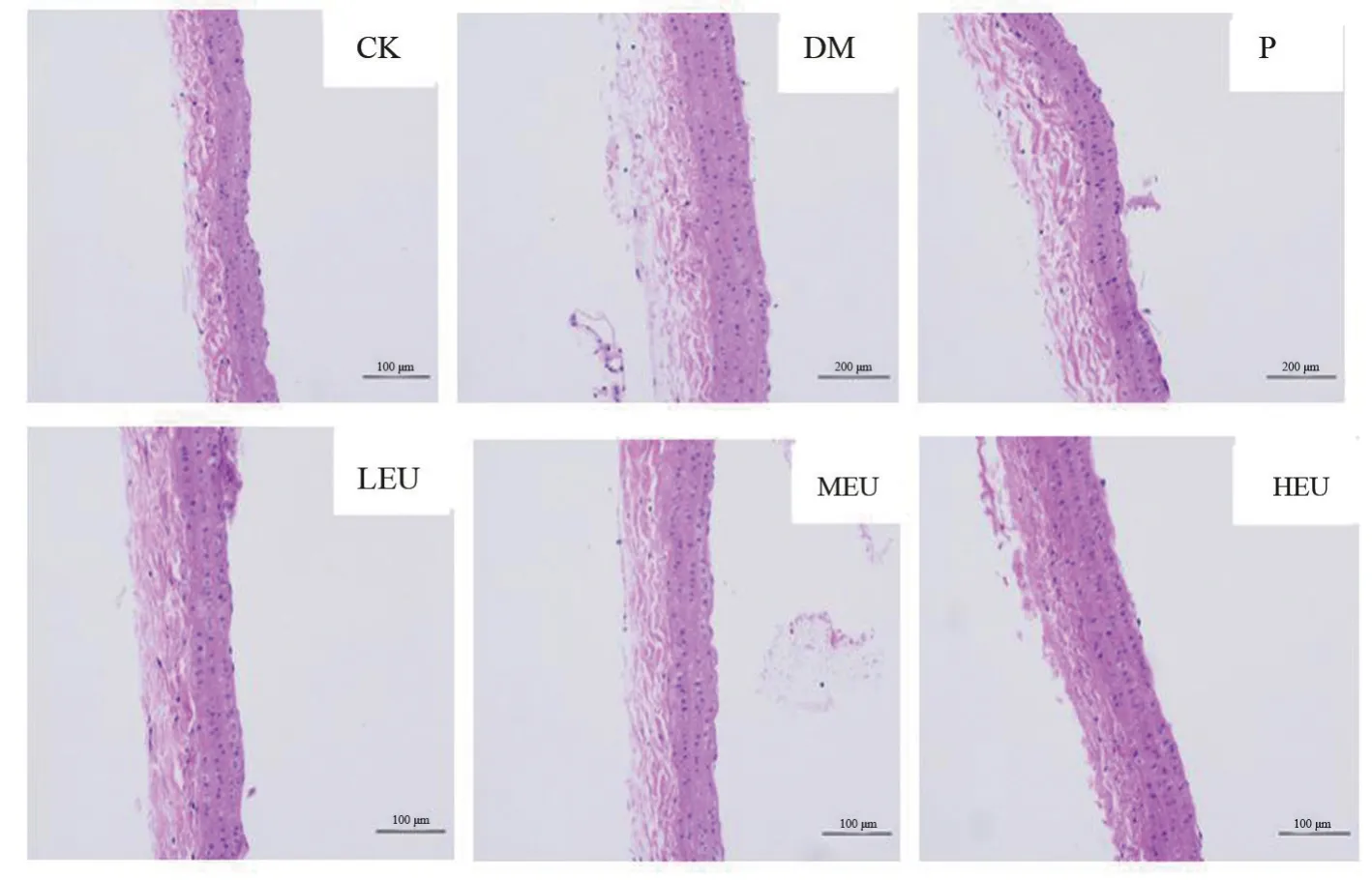
图1 杜仲叶提取物对SHR大鼠主动脉形态变化影响(HE,200×)
Masson 染色:血管中膜平滑肌细胞浆和肌纤维被染成红色,细胞核呈黑蓝色,胶原纤维被染成蓝色。与CK 组相比,DM 组主动脉血管中膜平滑肌胶原纤维明显增多,且细胞排列紊乱;LEU、MEU、HEU 组和P组可不同程度地改善血管平滑肌胶原纤维异常增殖情况。见图2。
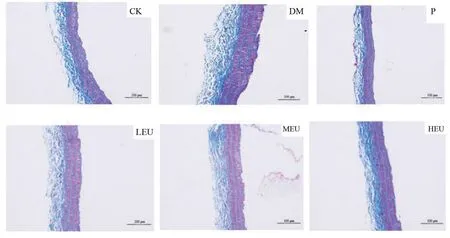
图2 杜仲叶提取物对SHR大鼠主动脉胶原沉积情况的影响(Masson,200×)
电镜观察:CK 组细胞质均匀,细胞内空泡少,核染色质均匀分布;DM 组可见线粒体嵴形态肿胀变形,管壁增厚,有泡沫细胞产生,MEU、HEU 组和P组可不同程度地减轻泡沫细胞聚集,细胞器肿胀变形的情况。见图3。
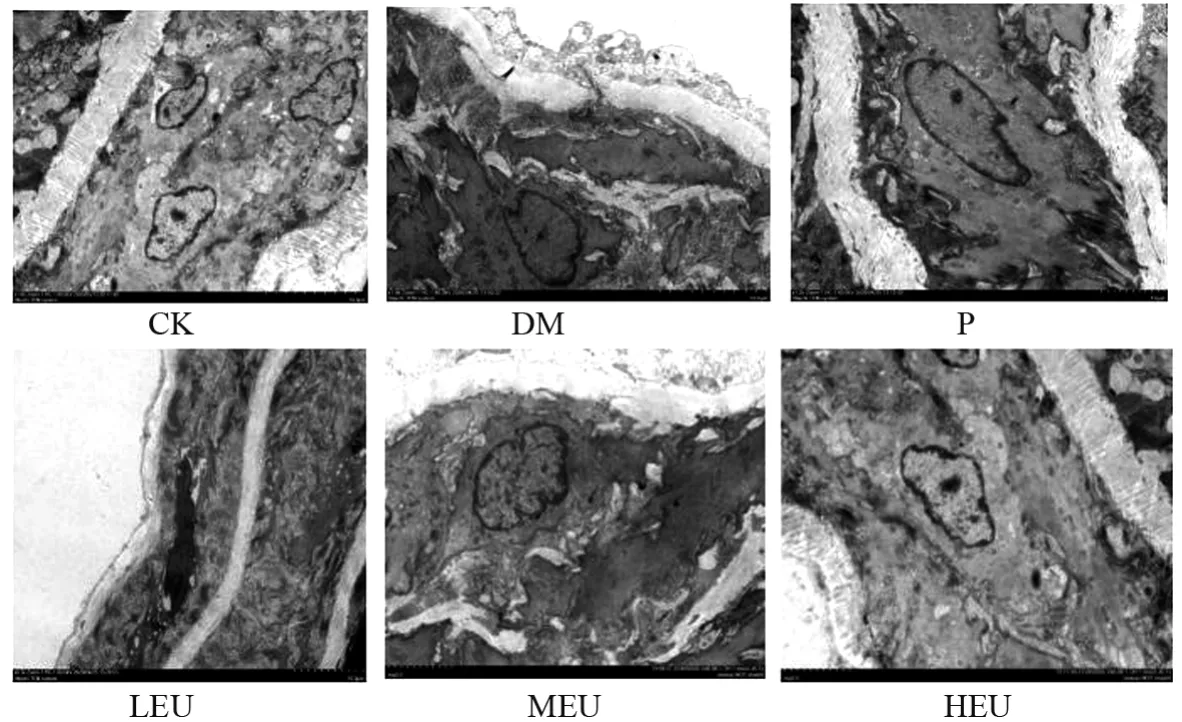
图3 杜仲叶提取物对SHR大鼠主动脉超微结构的影响(电镜,1200×)
2.4 杜仲叶提取物对大鼠主动脉RhoA、ROCK 1蛋白表达的影响
与CK 组比较,DM 组Rho A、ROCK 1 蛋白表达均显著升高(P<0.01),表明高血压引起大鼠主动脉血管内皮功能损伤;与DM 组比较,P 组与HEU、MEU 组均显著降低Rho A 蛋白表达(P<0.05),P组与HEU、MEU、LEU 组均显著降低ROCK 1 蛋白表达(P<0.05)。提示HEU、MEU可显著改善SHR 大鼠血管内皮功能受损。见图4。
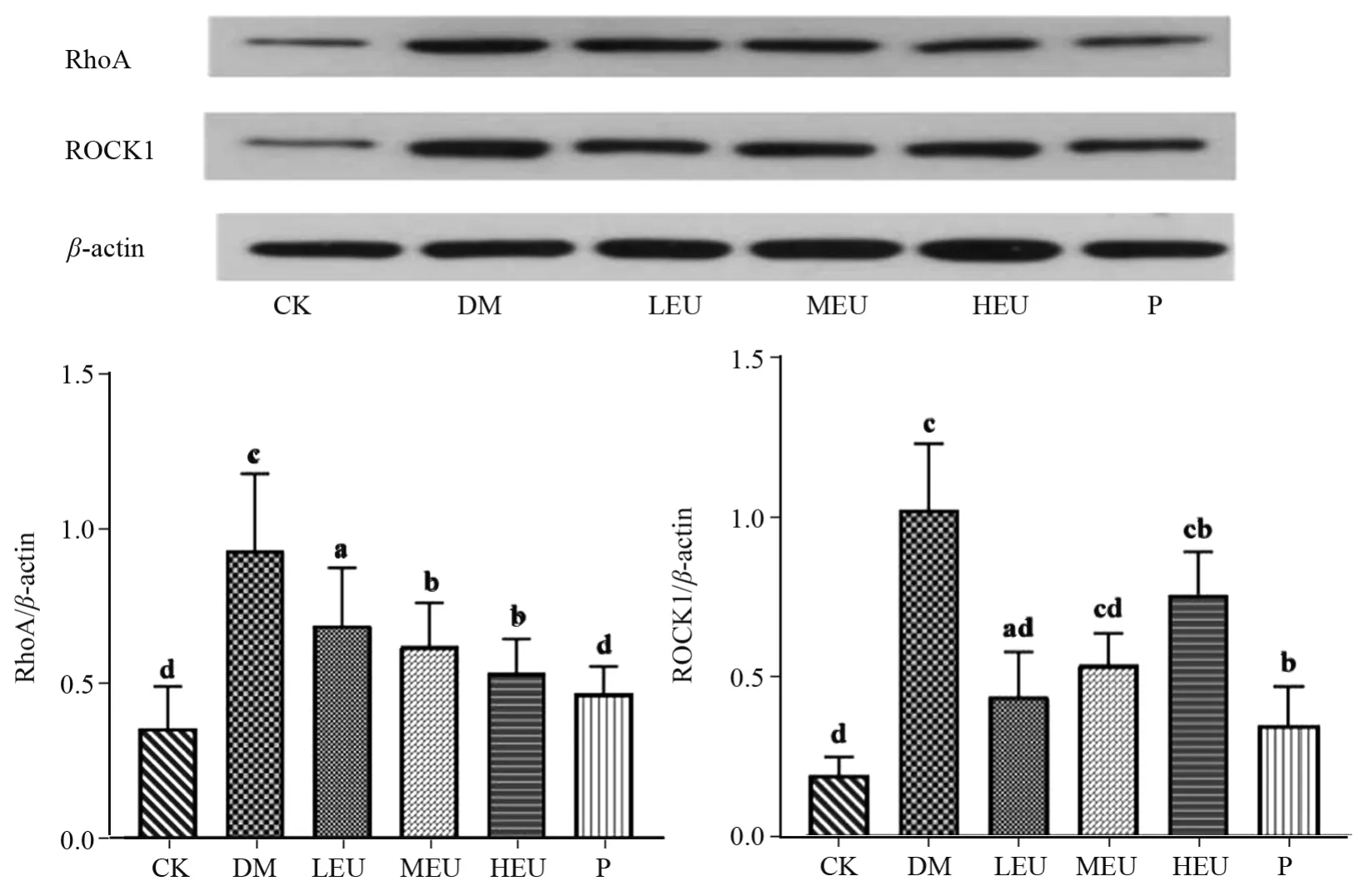
图4 杜仲叶提取物对SHR大鼠主动脉RhoA、ROCK 1 蛋白表达的影响
2.5 PCR法检测SHR大鼠胸主动脉Rho A、Rock 1 mRNA含量表达
荧光定量PCR 结果显示,与CK 组比较,DM组RhoA、Rock1 m RNA 的表达显著上调,与DM组比较,P 组与HEU、MEU、LEU 组胸主动脉RhoA mRNA表达(P<0.01)、胸主动 脉Rock1 m RNA 表达(P<0.05)均显著下调,HEU、MEU、LEU 组均能不同程度的抑制胸主动脉RhoA、Rock1 m RNA 的表达,其中,HEU、MEU 组效果较好。见图5。

图5 各组大鼠胸主动脉Rho A、Rock 1 mRNA的表达
3 讨论
高血压导致eNOS/NO 信号通路受损,eNOS水平降低时,血管内皮NO 释放减少进而导致血管收缩功能障碍,启动粥样斑块的形成及发展,引起血管内皮功能损伤[10]。Ang II在RAAS(肾素-血管紧张素-醛固酮系统)中发挥重要作用[11]。高血压患者由于异常增高的动脉压力,使得机体难以维持炎症反应稳态,造成血管内皮细胞的功能障碍及代谢损伤[5]。TNF-α升高可激活NF-κB 信号通路和NADPH 氧化酶,加剧机体氧化应激反应并促进内皮素ET 表达,引起血管外周阻力增大,血压持续升高。IL-6通过激活NO-cGMP 信号通路促进超氧化物生成。炎症因子TNF-、IL-6 分泌的增加加剧血管内皮细胞的凋亡[12]。本研究中杜仲叶提取物显著升高NO、eNOs含量,显著降低AngⅡ、TNF-、IL-6含量,保护血管内皮功能,改善原发性高血压大鼠血管内皮慢性炎症状态。
Rho/ROCK 信号通路是近年来神经血管类疾病研究热点,研究表明Ras同族体基因家族成员A(RhoA)/Rho激酶(ROCK1)与血管平滑肌收缩、应力纤维形成及血压调节等过程有关[13]。Rho A 介导应力纤维的形成,Rock1为Rho激酶是RhoA 的下游靶基因,具有调节血管内皮细胞迁移收缩的功能。高血压导致血管内皮功能受损,Rho A/ROCK信号通路激活诱导机体对钙离子的敏感性增加,抑制血管舒张,增加血管内皮通透性,加剧血管内皮功能受损[14]。本实验结果发现,杜仲叶提取物中、高剂量组可明显抑制Rho A、ROCK1 蛋白和m RNA表达,改善SHR 大鼠主动脉内皮损伤。
综上所述,杜仲叶提取物可能通过调控血管活性因子NO、eNOs、Ang Ⅱ,抑制炎症因子TNF-、IL-6含量,下调血管中Rho A、ROCK1蛋白和m RNA 表达改善原发性高血压大鼠血管内皮损伤。
