泰州农村老年人群代谢物与骨密度的关联性
2022-02-01吕雪玮徐珂琳陈兴栋
吕雪玮 徐珂琳 陈兴栋 ✉
1 复旦大学 生命科学学院/人类学教育部重点实验室,上海 200438;2复旦大学 泰州健康科学研究院,江苏 泰州2 253002;3 复旦大学 公共卫生学院生物统计学系/公共卫生安全教育部重点实验室,上海200032
中老年人是骨质疏松症的主要患病人群,尤其是绝经后女性,该病是目前亟待解决的公共卫生问题之一。随着人口老龄化进程的不断发展,骨质疏松的发病率和死亡率也在不断地增加[1]。虽然骨质疏松症在女性中比男性更常见,但在男性人群中,该病的发病率也在不断升高[2]。在世界范围内的老龄人口中,髋部和脊椎骨折的致残率、死亡率很高,因此预防骨质疏松症亟待引起人们的重视[3]。
研究表明,骨密度与多种脂质存在相关性[4-5],骨密度与脂蛋白水平存在关联性[6-7]。在绝经后骨质疏松症动物模型中进行的研究表明,与对照组动物相比,其代谢组学特征存在着显著差异[8]。脂类物质广泛分布于人体各处,在多种代谢途径中发挥着重要作用[9]。人体内的脂质种类很多,我们熟悉的脂质有甘油三酯、胆固醇、类固醇激素等[9]。由于其疏水性,脂质在循环中通过脂蛋白携带到外周组织[9]。
脂蛋白的中心包含有胆固醇酯和甘油三酯,周围环绕着游离胆固醇、磷脂和载脂蛋白[10]。内源性的脂蛋白代谢途径始于肝脏中极低密度脂蛋白(VLDL)的形成。VLDL 在肌肉和脂肪组织中代谢,释放游离脂肪酸,形成中间密度脂蛋白。中间密度脂蛋白进一步代谢为低密度脂蛋白,低密度脂蛋白在许多组织中被低密度脂蛋白受体吸收[10]。胆固醇的逆向转运始于肝脏和肠道内新生的高密度脂蛋白(HDL)的形成,它可结合从细胞中排出的胆固醇和磷脂,从而形成成熟的高密度脂蛋白[11]。HDL是脂蛋白颗粒的混合物,密度在1.063~1.21 g/m L的范围内。根据它们的脂质组成,这些颗粒可能呈盘状或球形几何形状。成熟的球形HDL 颗粒包含45%~55%的载脂蛋白,26%~32%的磷脂,15%~20%的酯化胆固醇,3%~5%的游离胆固醇和约5%的甘油三酸酯[12]。HDL 的主要蛋白质成分是载脂蛋白A1,它在HDL的生物发生和功能中起关键作用[13]。多项研究显示,HDL 和VLDL 与骨密度存在关联性[7,14]。
已有研究证实,骨质疏松受年龄、性别、腰臀比、饮食等影响[15-19]。既往研究表明,向心性肥胖是骨质疏松症的危险因素,腰臀比与骨密度呈负相关[18]。美国饮食协会和营养和营养学学会都认为,适当的摄入蔬菜、水果等素食对人类健康有好处[20]。蔬菜和水果是镁和钾的主要食物来源,还富含维生素C、类胡萝卜素等有抗氧化功能的营养物质,有助于维持人体酸碱平衡[21]。研究显示,每增加摄入一份水果或蔬菜,男性和女性的骨密度随之增加约1%[22]。还有研究指出,蛋白质、维生素B12、锌和脂肪酸等主要存在于动物产品中的营养物质,可能也对骨骼健康有积极意义[23]。
在既往研究中,由于研究对象的生活方式、种族等背景差异很大,且存在研究对象局限、未考虑饮食因素影响等,使得代谢物与骨密度的关联性研究得出的结果大相径庭[15]。因此,本研究基于泰州脑影像队列基线人群,收集了代谢组学数据、调查问卷数据等,将研究对象按照T-score划分为3个不同的骨密度组——骨量正常组、低骨量组、骨质疏松组,以期发现代谢物与骨密度的关联性的线索,为骨质疏松症的预防提供策略。
1 对象与方法
1.1 对象
本研究共纳入797位研究对象,均来自泰州脑影像队列[24]。泰州脑影像队列中共有904个人被纳入基线研究,其纳入和排除标准见文献[25]。所有完成基线调查的研究对象都完成了流行病学调查问卷(包括人口统计学、生活方式、疾病史和饮食频率)和体格检查。从泰州脑影像队列基线904名研究对象中,排除43名骨密度测量数据不完整、34名代谢组数据缺失、16名有骨折史、14名有甲状腺疾病史的研究对象。
1.2 方法
1.2.1 骨密度测量
双能X 射线吸收仪(Lunar DPX NT- 400157;GE Healthcare,Madison,WI,USA)密度计用于测量腰椎(L1-L4)、全髋和左侧股骨颈的骨密度值[24]。3个测量位置的最小T值被用作阈值来定义骨密度的3个组。797名参与者被分为T≥-1的骨量正常组、-1>T>-2.5的低骨量组和T≤-2.5的骨质疏松组[24]。
1.2.2 代谢组学样本采集和质控
使用核磁共振平台进行非靶向基线血清代谢组学分析。每一个代谢组学样品,都获得了3个一维光谱,包括NOESYPR1D 序列、Carr-Purcell-Meibom-Gill序列和扩散编辑光谱。此外,从合并的样本中收集了一系列二维光谱用于光谱分配。高通量核磁共振代谢组学平台可以生成光谱,其中大约350个代谢特征和比率参数将同时量化为每个特征的绝对浓度或计算为比率,包括脂质、脂蛋白、氨基酸和其他代谢物。但在本研究中,仅使用绝对定量指标进行分析。在代谢组学分析之前,所有分析的血清均未经过第二次冻融循环[25]。在分析之前,去除了缺失大于20%的代谢物[26]。对于小分子代谢物,缺失值替换为最低检测限的一半[26]。未检测到体积不足和严重乳糜血症的数据被删除。通过逆正态变换标准化为Z分数后,共有136种代谢物的代谢物水平呈正态分布[27-28]。
1.2.3 协变量评估
详细的问卷调查和临床检查提供了有关协变量的信息。通过采访者管理的问卷获得人口统计状况(年龄、性别),其中饮食频率问卷用于收集饮食信息,包括食物类型、频率和过去一年中每次食用某种食物的平均量。食物类型包括茶叶、新鲜蔬菜、甜点、乳制品、新鲜水产、新鲜肉类、主食、新鲜水果、腌制食品、鸡蛋和豆制品。本研究使用食物摄入量的五分位数作为自变量进行偏相关分析。根据先前的研究,女性和年龄增长是低骨量的预测因素[29]。通过体检收集参与者的腰围和臀围,并计算腰臀比。
1.2.4 统计分析
使用R 3.6.1 软件进行一般描述性分析、Spearman偏相关分析、多项逻辑回归。检验水准为双侧检验α=0.05。
2 结果
2.1 研究对象的基本特征
表1显示了正常骨密度组、低骨量组和骨质疏松组的研究对象的特征。其中骨质疏松组的女性比例明显高于正常骨密度组、低骨量组(87.80% vs 62.80%vs 33.60%,P<0.001)。三组在腰臀比、糖尿病(12.50%vs 9.00%vs 6.80%,P<0.001)方面存在显著差异。

表1 研究对象的一般情况
2.2 组间差异代谢物
本研究中包括的代谢物是脂质、脂蛋白、氨基酸和其他代谢物。通过方差分析探索三个骨密度组之间的差异代谢物,19种代谢物(包括VLDL 亚组分和HDL亚组分)在组间显著(FDR 调整P<0.05)。表2展示了这19种差异代谢物的名称、均值、标准误和P值等信息。这19种差异代谢物分别为H.CH(HDL胆固醇)、H0PL(HDL 中的磷脂)、H1CE(HDL-1 中的胆固醇酯)、H1PL(HDL-1 中的磷脂)、H1CH(HDL-1 中的胆固醇)、H2PL(HDL-2中的磷脂)、H2A1(HDL-2 中的载脂蛋白A1)、H2CH(HDL-2 中的胆固醇酯)、H2CE(HDL-3 中的胆固醇酯)、H3CE(HDL-3 中的胆固醇酯)、H3PL(HDL-3中的磷脂),H3FC(HDL-3中的游离胆固醇)、V1PL(VLDL-1 中的磷脂)、V1CE(VLDL-1中的胆固醇酯)、V1TG(VLDL-1中的甘油三酯)、V1FC(VLDL-1中的游离胆固醇)、V1CH(VLDL-1中的胆固醇)和V1LP(VLDL-1中的总脂质)。

表2 三组间显著差异的代谢物

续表2
2.3 食物种类与骨密度的偏相关分析
表3显示了食物与骨密度的偏相关分析结果,其中食物作为自变量,骨密度组作为因变量(1=正常骨密度组,2=低骨量组,3=骨质疏松组)。偏相关分析中调整了年龄、性别、腰臀比和糖尿病,结果显示:新鲜水产(β=-0.093)、新鲜肉类(β=-0.074)新鲜水果(β=-0.095)和新鲜蔬菜(β=-0.078)与骨密度组有显著的负相关将上述4个食物种类作为调整变量纳入后续逻辑回归分析中。
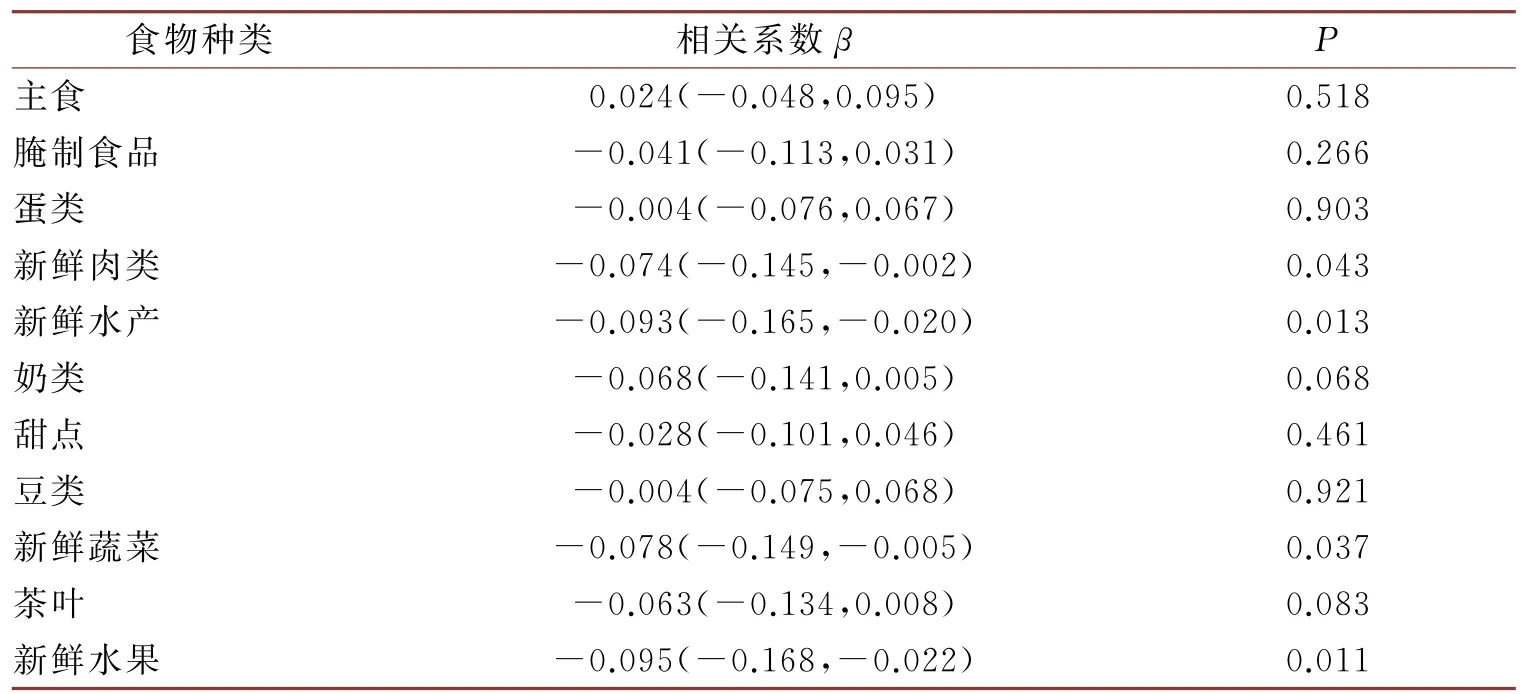
表3 食物与骨密度的偏相关分析
2.4 代谢物与骨质疏松发病风险的关联性分析
考虑到混杂因素的干扰,我们进一步研究了代谢物与不同骨密度组之间的关联。分别将低骨量组和骨质疏松组与正常骨密度组进行比较,表4显示了多元逻辑回归分析的显著结果。在调整年龄、性别、腰臀比、新鲜水产、新鲜水果、新鲜蔬菜和新鲜肉类后,随着H1CE(OR=1.28,95%CI=1.08~1.52)和H2A1(OR=1.20,95%CI=1.01~1.43)的水平增加,人群中骨量丢失的风险升高。而随着V1LP(OR=0.71,95%CI=0.56~0.89),V1TG(OR=0.71,95%CI=0.56~0.89),V1PL(OR=0.72,95%CI=0.57~0.92)的水平增加,人群中骨量丢失的风险降低。

表4 代谢物与骨质疏松发病风险的关联性分析
模型1针对年龄、性别、腰臀比和糖尿病进行了调整模型2针对年龄、性别、腰臀比、糖尿病、新鲜水产、新鲜水果、新鲜蔬菜和新鲜肉类进行了调整。
3 讨论
在本研究中,我们分析在调整年龄、性别、腰臀比、饮食种类等混杂因素后,代谢物与骨密度的关联性。在调整了年龄、性别、腰臀比和糖尿病之后,偏相关分析结果显示新鲜水产(β=-0.093)、新鲜肉类(β=-0.074)、新鲜水果(β=-0.095)和新鲜蔬菜(β=-0.078)与骨密度组有显著的负相关。即低骨量组和骨质疏松组的新鲜水产、新鲜肉类、新鲜水果、新鲜蔬菜摄入量比正常骨密度组低。发现:随着H1CE和H2A1水平升高,人群中发生骨量丢失的风险增加;随 着 V1LP、V1TG、V1PL、V1FC、V1CH、V1CE水平的升高,人群中发生骨量丢失的风险降低。
多项研究已指出代谢物与骨量丢失之间的关联性[30-31],其中高水平的HDL-C 通过影响体内的性激素水平进而来影响骨密度[32-33]。根据相关研究,口服雌激素/孕激素会降低HDL-C 水平,但可增加绝经后妇女的骨密度[34]。既往研究发现VLDL 与骨密度存在相关关系[13],VLDL可能与动脉粥样硬化的发生发展有关,而动脉粥样硬化又与骨量流失呈正相关[30-32],并且有研究认为VLDL 反映骨丢失与血管钙化之间的联系[13]。在这项研究中,我们发现H1CE 和H2A1 与骨量流失呈正相关;V1LP、V1TG、V1PL、V1FC、V1CH 和V1CE 与骨量流失呈负相关。
在弗莱明翰骨质疏松症队列中,在对于男性的为期4 a的随访中,水果和蔬菜的摄入每增加一次,将会约0.8%的骨量流失[21-22]。据报道,水果和蔬菜对骨密度有保护作用[35]。水果和蔬菜中富含镁、钾,有助于人体维持较低的膳食酸负荷[36],而人体内低酸负荷可以增强成骨细胞的功能,抑制破骨细胞的活性,增加骨形成,减少骨吸收[37]。此外,水果和蔬菜中富含维生素K 和维生素C,它们参与了骨基质的合成[38]。蛋白质、维生素B12、镁和脂肪酸等营养物质,主要存在于肉类、水产品等动物食品中,可能有益于骨骼健康[21]。在弗莱明翰骨质疏松症队列中,蛋白质摄入量越低的研究对象,其骨量流失越严重[39]。动物食品中富含的蛋白质会增加胰岛素样生长因子1的循环水平,而胰岛素样生长因子1是骨骼生长的关键介质[40]。而肉类、水产品等食品中富含的镁还会对骨骼质量有直接影响,如降低羟基磷灰石晶体尺寸,从而防止形成可能会导致骨骼脆性的过大的矿物晶体[41]。研究显示,新鲜水果、新鲜蔬菜、新鲜水产、新鲜肉类与骨密度组成负相关,即低骨量组和骨质疏松组的新鲜水产、新鲜肉类、新鲜水果、新鲜蔬菜摄入量比正常骨密度组低,这与既往研究结果相一致。在多项逻辑回归模型中将这四个食物作为混杂因素进行了校正,以防混杂因素对研究结果产生太大的影响。
本研究在分析代谢物与骨密度之间的关联时考虑了饮食习惯这一生活方式的影响,并将其作为混杂因素在回归模型中进行调整。本研究也存在一些局限性。这项研究无法避免选择偏倚,主要是因为它从农村人口中选择了研究对象,这可能会对研究结果产生一定的影响。此外,这是一个横断面的研究,目前还不能通过代谢物来预测骨质疏松症。然而,泰州脑影像队列是一项基于社区的前瞻性队列研究,可以利用代谢物、基因、人口统计学和生活方式等数据进行骨密度研究,这将提供更多关于代谢物在骨质疏松症中的治疗和预防潜力的信息。
