LncRNA TBX5-AS1靶向miR-92a-3p调控结直肠癌HCT116细胞增殖、迁移及侵袭的机制研究
2022-01-28周庆全刘浩燕王宗站
周庆全, 徐 飞, 刘浩燕, 王宗站
(山东省青岛市中心医院, 1. 结直肠肛门外科, 2. 放疗一科, 山东 青岛, 266000)
结直肠癌是中国常见的恶性肿瘤,其发病率与病死率逐年增高,结直肠癌细胞增殖及转移是造成患者预后不良的重要原因。长链非编码RNA(LncRNA)在结直肠癌发生及发展过程中发挥重要的调控作用,可通过调控微小RNA(miRNA)发挥作用[1-4]。LncRNA T-box转录因子5反义RNA 1(TBX5-AS1)在非小细胞肺癌组织与细胞系中表达下调,上调其表达可抑制细胞增殖、迁移及侵袭,并可促进细胞凋亡[5]。但TBX5-AS1在结直肠癌中的表达及其作用机制尚未可知。LncBase Predicted v. 2预测软件显示TBX5-AS1与miR-92a-3p存在结合位点,研究[6]表明miR-92a在结直肠癌细胞中表达上调,并可促进细胞增殖及转移。但TBX5-AS1与miR-92a-3p在结直肠癌发生及发展过程中的作用机制尚未阐明。本研究探讨TBX5-AS1是否可通过调控miR-92a-3p而调节结直肠癌细胞生物学行为,现报告如下。
1 材料与方法
1.1 材料与试剂
收集2019年1月—2020年8月在本院接受手术治疗的37例结直肠癌患者的结直肠癌组织及相应癌旁组织,其中男20例,女17例,年龄52~71岁,平均(63.26±7.44)岁。本研究经本院伦理委员会批准,所有患者知情且签署同意书。材料与试剂包括: 人结直肠癌细胞HCT116购自上海弘顺生物; DMEM培养基、胎牛血清、Lipofectamine2000、Trizol试剂购自美国Thermo Fisher; 逆转录试剂与SYBR Green qPCR MasterMix试剂购自北京天根生化科技公司; miR-NC、miR-92a-3p mimics、anti-miR-NC、anti-miR-92a-3p、pcDNA、pcDNA-TBX5-AS1购自上海吉玛; MTT、Transwell小室、Matrigel基质胶购自北京索莱宝; Dual-Luciferase Reporter Assay Kit试剂购自美国Promega; 兔抗人E-cadherin、N-cadherin、基质金属蛋白酶-2(MMP-2)、基质金属蛋白酶-9(MMP-9)抗体与二抗购自美国Abcam。StepOnePlus实时荧光定量PCR仪购自美国ABI; 酶标仪、电泳仪与凝胶成像系统购自美国Thermo Fisher; 离心机与电泳槽购自北京六一生物。
1.2 方法
1.2.1 实验分组: 取HCT116细胞(1×105个/mL)接种于6孔板(200 μL/孔),采用Lipofectamine2000转染试剂分别将pcDNA、pcDNA-TBX5-AS1、anti-miR-NC、anti-miR-92a-3p、miR-NC、miR-92a-3p mmics、pcDNA-TBX5-AS1与miR-92a-3p mmics转染至HCT116细胞,分别记为pcDNA组、pcDNA-TBX5-AS1组、anti-miR-NC组、anti-miR-92a-3p组、miR-NC组、miR-92a-3p组、pcDNA-TBX5-AS1+miR-92a-3p组。
1.2.2 实时荧光定量聚合酶链反应(qRT-PCR)检测TBX5-AS1、miR-92a-3p的表达水平: 采用Trizol试剂分别提取结直肠癌组织、癌旁组织和各组HCT116细胞总RNA, 逆转录合成cDNA,按照SYBR Green qPCR MasterMix试剂说明书对TBX5-AS1、miR-92a-3p的表达量进行检测, TBX5-AS1以GAPDH为内参,miR-92a-3p以U6为内参。反应体系: SYBR Green Mix 10.0 μL, cDNA 2.0 μL, 上下游引物各0.5 μL, RNase-Free ddH2O补足体系至20.0 μL; 反应条件: 95℃预变性2 min, 95 ℃变性30 s, 59 ℃退火30 s, 72 ℃延伸30 s, 共40次循环,用2-ΔΔCt法计算TBX5-AS1、miR-92a-3p相对表达量。
1.2.3 MTT检测细胞增殖: 取对数生长期HCT116细胞接种于96孔板(5×103个/孔),按照1.2.1方法分组处理后,分别在培养24、48、72 h时向每孔加入20.0 μL MTT溶液,于37 ℃培养箱内继续培养4 h后,弃上清,每孔加入150.0 μL二甲基亚砜(DMSO), 室温避光振荡孵育5 min, 应用酶标仪检测各孔吸光度值。
1.2.4 平板克隆形成实验: 取各组HCT116细胞接种于6孔板,密度为每孔1×104个细胞,每隔2 d更换1次培养液,直至细胞出现肉眼可见的克隆时终止培养,加入4%多聚甲醛固定15 min后进行结晶紫染色5 min, PBS洗涤后晾干,观察克隆形成细胞数。
1.2.5 划痕实验: 实验前采用记号笔在6孔板后面每隔0.5 cm划横线,各组HCT116细胞培养至对数期后按照每孔1×105个接种于6孔板,于37 ℃培养箱内培养24 h, 待细胞铺满后采用20.0 μL移液枪的枪头垂直于横线划痕, PBS洗涤后加入不含胎牛血清的培养基,于200倍镜下拍照记录0 h时划痕位置与宽度,于培养箱内继续培养24 h后于200倍镜下拍照记录,检测细胞迁移距离。
1.2.6 Transwell实验检测细胞侵袭: 取各组HCT116细胞用胰蛋白酶消化后吹打混匀, 1 000 转/min离心3 min后,加入不含胎牛血清的培养基重悬细胞(2×104个/mL), 取200.0 μL细胞悬液接种于平铺Matrigel基质胶的上室,下室加入含有10%胎牛血清的培养基,于37 ℃培养箱内培养24 h后采用PBS洗涤,多聚甲醛固定20 min, 0.1%结晶紫染液染色10 min, 200倍显微镜下观察并计算穿膜细胞数。
1.2.7 双荧光素酶报告基因检测TBX5-AS1和miR-92a-3p的靶向关系: 根据靶基因预测软件预测TBX5-AS1和miR-92a-3p可能的结合位点,体外合成该位点的DNA片段(wt-TBX5-AS1)及包含该位点突变体的DNA片段(mut-TBX5-AS1), 将其克隆至双荧光素酶启动子载体PGL3, 将报告质粒分别与miR-NC或miR-92a-3p mimics共转染至HCT116细胞中,培养48 h后采用试剂盒检测荧光素酶活性。
1.2.8 Western blot检测E-cadherin、N-cadherin、MMP-2、MMP-9蛋白表达: 转染后各组HCT116细胞采用RIPA裂解液提取细胞总蛋白,采用BCA试剂盒检测蛋白浓度,加入10%SDS-PAGE分离蛋白,凝胶电泳时电压80 V, 电流调整至最大,恒压条件下跑胶2.5 h, 采用电转法将蛋白转移至PVDF膜,电流调整至最大,电压80 V转膜1 h, PVDF膜转移至5%脱脂奶粉中封闭1 h, 向其中加入1∶1 000稀释的E-cadherin、N-cadherin、MMP-2、MMP-9、GAPDH, 于4 ℃孵育24 h, TBST洗涤,加入1∶5 000稀释的二抗,室温封闭1 h, 加入ECL化学发光液,采用Image J软件分析各条带灰度值。
1.3 统计学处理
2 结 果
2.1 TBX5-AS1和miR-92a-3p表达的检测
与癌旁组织比较,结直肠癌组织中TBX5-AS1的表达量降低, miR-92a-3p的表达量升高; 与pcDNA组比较, pcDNA-TBX5-AS1组TBX5-AS1的表达量升高, miR-92a-3p的表达量降低; 与anti-miR-NC组比较, anti-miR-92a-3p组miR-92a-3p的表达量降低; 与miR-NC组比较, miR-92a-3p组miR-92a-3p的表达量升高; 与pcDNA-TBX5-AS1组比较, pcDNA-TBX5-AS1+miR-92a-3p组miR-92a-3p的表达量升高; 上述组间差异均有统计学意义(P<0.05),见图1。

A: TBX5-AS1在结直肠癌组织(n=37)中的表达,与癌旁组织比较, ∗P<0.05; B: miR-92a-3p在结直肠癌组织(n=37)中的表达,与癌旁组织比较, ∗P<0.05; C: TBX5-AS1在结直肠癌细胞中的表达,与HIEC-6比较, ∗P<0.05; D: miR-92a-3p在结直肠癌细胞中的表达,与HIEC-6比较, ∗P<0.05; E: 干扰TBX5-AS1处理后TBX5-AS1的表达,与pcDNA比较, ∗P<0.05; F: 各个处理组细胞中miR-92a-3p的表达,与pcDNA比较, ∗P<0.05, 与anti-miR-NC比较, #P<0.05, 与miR-NC比较, △P<0.05, 与pcDNA-TBX5-AS1比较, ▲P<0.05。图1 TBX5-AS1和miR-92a-3p的表达
2.2 MTT法和克隆形成实验检测各个处理组对HCT116增殖的影响
与pcDNA组比较, pcDNA-TBX5-AS1组细胞存活率降低,克隆形成数减少,差异有统计学意义(P<0.05); 与anti-miR-NC组比较, anti-miR-92a-3p组细胞存活率降低,克隆形成数减少; 与miR-NC组比较, miR-92a-3p组细胞存活率升高,克隆形成数增多; 与pcDNA-TBX5-AS1组比较, pcDNA-TBX5-AS1+miR-92a-3p组细胞存活率升高,克隆形成数增多; 上述组间差异均有统计学意义(P<0.05), 见图2、表1。
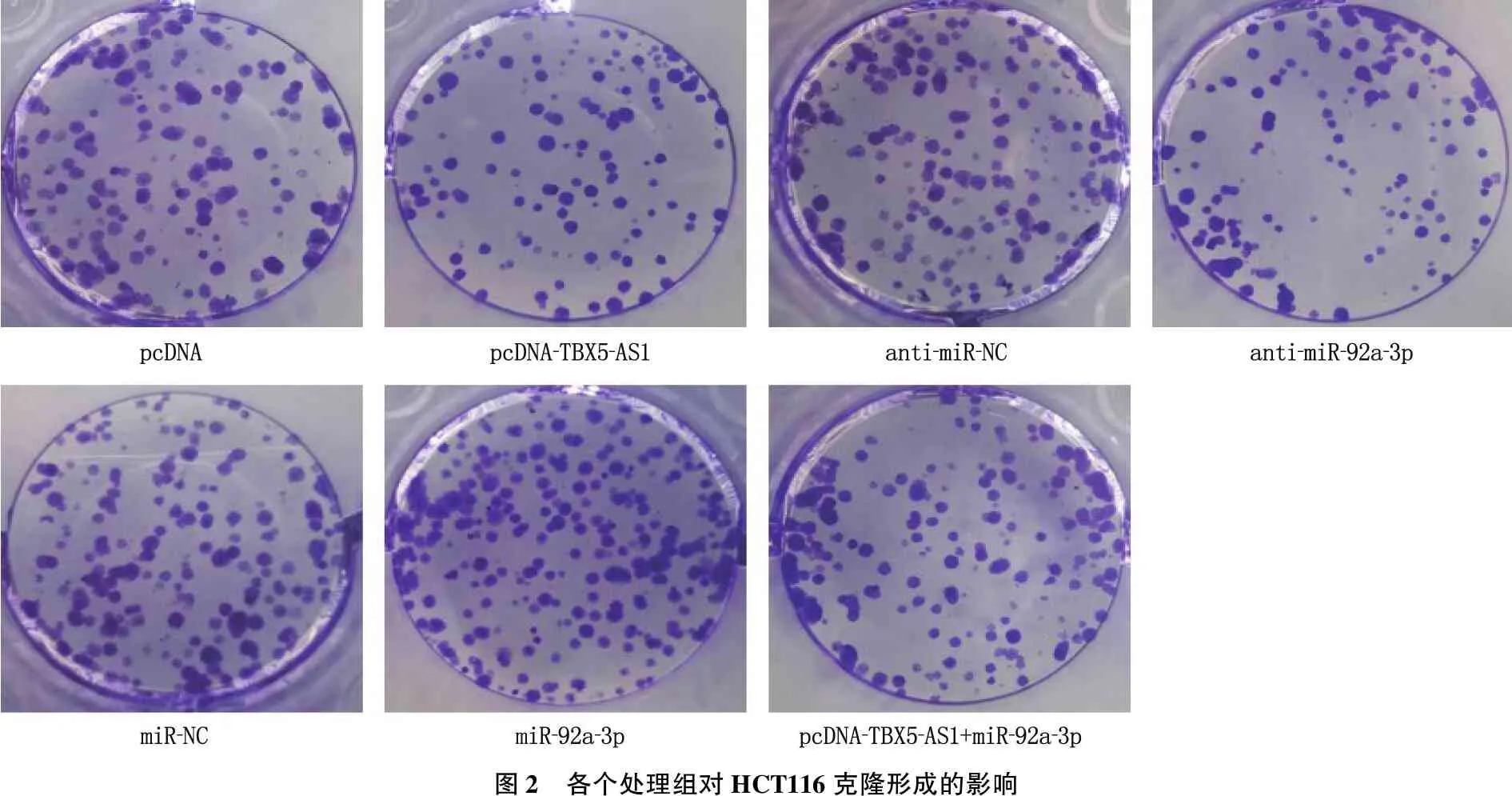
图2 各个处理组对HCT116克隆形成的影响

表1 各个处理组对HCT116克隆形成的检测
2.3 划痕实验和Transwell实验检测各个处理组对HCT116迁移、侵袭的影响
与pcDNA组比较, pcDNA-TBX5-AS1组迁移距离缩短,侵袭细胞数减少; 与anti-miR-NC组比较, anti-miR-92a-3p组迁移距离缩短,侵袭细胞数减少; 与miR-NC组比较, miR-92a-3p组迁移距离增加,侵袭细胞数增多; 与pcDNA-TBX5-AS1组比较, pcDNA-TBX5-AS1+miR-92a-3p组迁移距离增加,侵袭细胞数增多; 上述组间差异均有统计学意义(P<0.05), 见图3、图4及表2。

图3 各个处理组对HCT116迁移的影响
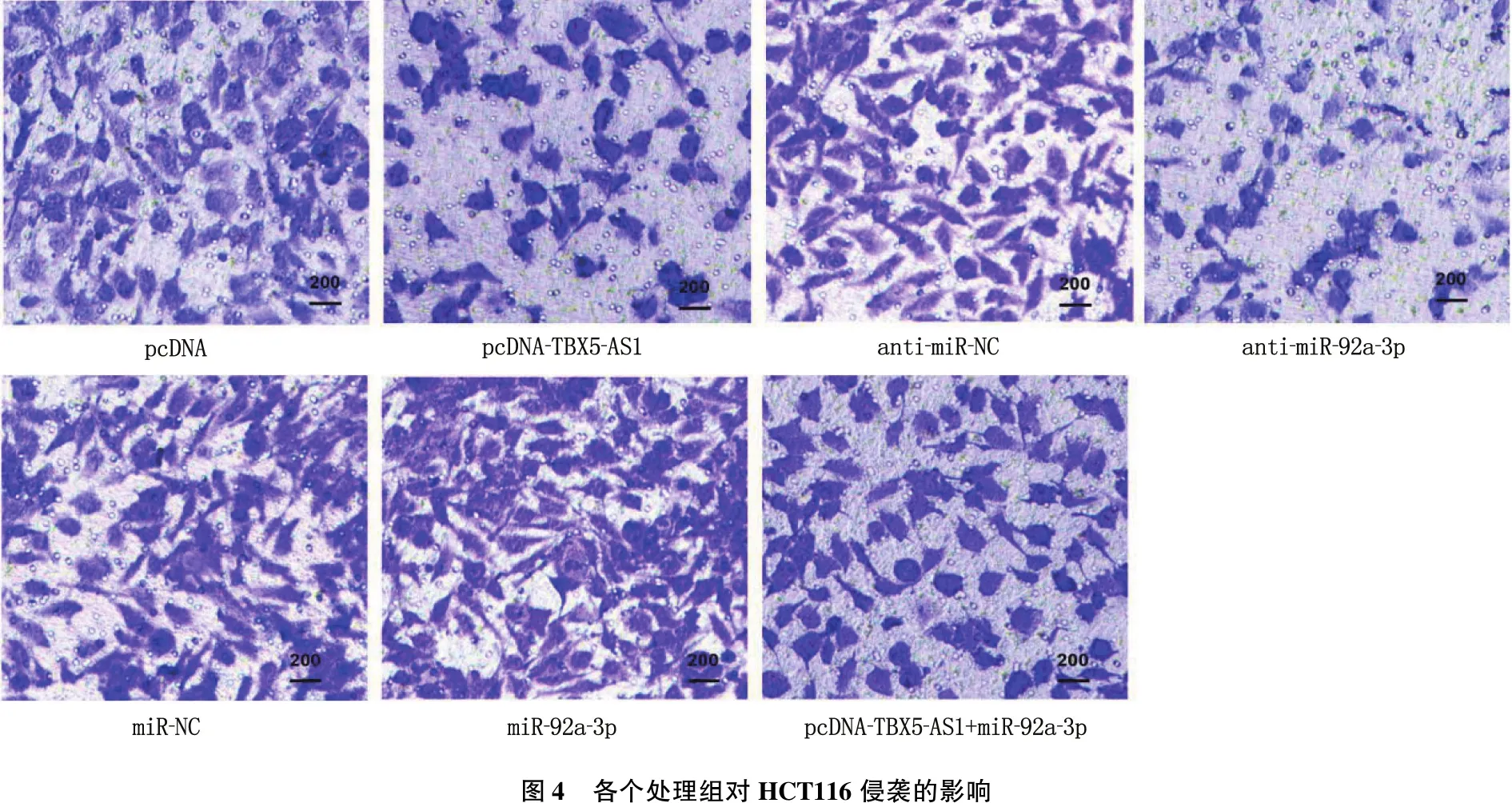
图4 各个处理组对HCT116侵袭的影响

表2 各个处理组对HCT116迁移距离和侵袭细胞数的结果比较
2.4 双荧光素酶报告实验检测TBX5-AS1和miR-92a-3p靶向关系
TBX5-AS1和miR-92a-3p存在结合位点,见图5。共转染wt-TBX5-AS1的细胞实验中,与miR-NC组比较, miR-92a-3p组荧光素酶活性降低,差异有统计学意义(P<0.05); 共转染mut-TBX5-AS1的细胞实验中, miR-92a-3p组与miR-NC组荧光素酶活性比较,差异无统计学意义(P>0.05), 见表3。

图5 TBX5-AS1和miR-92a-3p的互补序列

表3 双荧光素酶报告实验结果
2.5 Western检测各个处理组对HCT116中蛋白的表达
与pcDNA组比较, pcDNA-TBX5-AS1组E-cadherin蛋白表达量升高, N-cadherin、MMP-2、MMP-9蛋白表达量降低; 与anti-miR-NC组比较, anti-miR-92a-3p组E-cadherin蛋白表达量升高, N-cadherin、MMP-2、MMP-9蛋白表达量降低; 与miR-NC组比较, miR-92a-3p组E-cadherin蛋白表达量降低, N-cadherin、MMP-2、MMP-9蛋白表达量升高; 与pcDNA-TBX5-AS1组比较, pcDNA-TBX5-AS1+miR-92a-3p组E-cadherin蛋白表达量降低, N-cadherin、MMP-2、MMP-9蛋白表达量升高; 上述组间差异均有统计学意义(P<0.05), 见图6、表4。

图6 不同处理组E-cadherin、N-cadherin、MMP-2、MMP-9蛋白表达比较

表4 各个处理组对HCT116中E-cadherin和N-cadherin蛋白表达结果比较
3 讨 论
结直肠癌具有发病率高、病死率高等特点, LncRNA包含保守序列,其调控基因表达的方式具有多样性,主要是参与转录调控与转录后调控等过程,进而在肿瘤发生发展过程中发挥重要的调控作用,如LncRNA MAFG-AS1通过充当miR-147b的竞争性内源RNA(ceRNA)而激活NDUFA4, 进而促进结直肠癌的发展[7]。LncRNA-SNHG15通过抑制miR-338-3p而促进结直肠癌细胞增殖[8]。LncRNA BDNF-AS通过抑制GSK-3beta表达而抑制结直肠癌细胞的增殖和迁移[9]。LncRNA NBR2通过下调miR-21而抑制结直肠癌细胞迁移和侵袭[10]。
TBX5-AS1在肺癌、胶质母细胞瘤、肝细胞癌等肿瘤中表达异常,其表达量与患者预后不良有关[11-13]。本研究结果显示,结直肠癌组织中TBX5-AS1的表达量低于癌旁组织, TBX5-AS1过表达可降低结直肠癌细胞活力,减少细胞克隆形成数,提示TBX5-AS1过表达可抑制结直肠癌细胞增殖及克隆形成。E-cadherin与N-cadherin是上皮-间质转化(EMT)相关蛋白,其中E-cadherin表达失调可促进细胞向间质转化,进而促进细胞转移,而N-cadherin表达下调可抑制EMT转化[14-15]。本研究结果显示, TBX5-AS1过表达后结直肠癌细胞迁移距离缩短,侵袭细胞数减少,并可促进E-cadherin表达而抑制N-cadherin表达,提示TBX5-AS1过表达可抑制结直肠癌细胞迁移及侵袭。
本研究证实结直肠癌细胞中TBX5-AS1可靶向结合miR-92a-3p, 并可负向调控miR-92a-3p的表达。研究[16]表明miR-92a-3p通过靶向KLF2促进胃癌细胞增殖和侵袭。miR-92a-3p通过调节PTEN促进食管鳞状细胞癌的增殖、迁移和侵袭[17]。miR-92a-3p通过靶向FBXW7而促进前列腺癌细胞增殖及迁移[18]。本研究结果显示,结直肠癌组织中miR-92a-3p的表达量高于癌旁组织,抑制miR-92a-3p表达能够抑制结直肠癌细胞增殖、克隆形成、迁移及侵袭,而miR-92a-3p过表达可明显促进结直肠癌细胞增殖及增强细胞克隆形成、迁移、侵袭能力,还可进一步逆转TBX5-AS1过表达对结直肠癌细胞生物学行为的作用,提示TBX5-AS1可通过靶向调控miR-92a-3p而调节结直肠癌细胞生物学行为。
综上所述,结直肠癌组织中TBX5-AS1的表达量降低, miR-92a-3p的表达量升高, TBX5-AS1过表达可通过靶向调控miR-92a-3p的表达而抑制结直肠癌细胞增殖、克隆形成、迁移及侵袭, TBX5-AS1或可作为结直肠癌的潜在治疗靶点。
