LncRNA DDX11-AS1靶向miR-627-3p调控氧化低密度脂蛋白诱导的血管内皮细胞增殖和凋亡的机制研究
2022-01-28彭宪星王远波孙启朋
彭宪星, 王远波, 孙启朋
(枣庄矿业集团中心医院 神经内科一病区, 山东 枣庄, 277000)
动脉粥样硬化(AS)是一种常见的高发病率、高死亡率的心血管疾病,是冠心病、心肌梗死和周围血管疾病的主要病因[1]。内皮细胞在维持血管系统的动态平衡中起着重要作用,其损伤和功能障碍是AS的早期标志。在高血压、高血脂等因素刺激下,内皮细胞表达的黏附分子可促进氧化型低密度脂蛋白(ox-LDL)的局部积累,诱导促炎反应、氧化应激和内皮细胞凋亡,最终导致AS斑块形成。因此,阐明ox-LDL介导血管内皮细胞凋亡的分子机制对开发有效的AS治疗方法意义重大。长链非编码RNA(lncRNA)是序列高度保守、长度大于200 nt的RNA转录本,其通过染色质重塑、剪切调控、吸附微小RNA(miRNA)等多种机制参与基因表达调控,在癌症、心血管疾病等病理过程中具有重要作用[2-3]。研究[4-5]显示, lncRNA DDX11反义RNA 1(DDX11-AS1)在肝癌、结肠癌中表达上调,其通过调控细胞增殖和凋亡对癌症进展具有促进作用。miR-627-3p已被证实[6]在骨肉瘤等恶性肿瘤中具有抑癌作用,上调miR-627-3p表达可抑制肿瘤形成。靶基因预测显示miR-627-3p是DDX11-AS1的潜在靶点,但DDX11-AS1是否靶向miR-627-3p调控AS进展并不清楚。本研究分析ox-LDL诱导后,人脐静脉血管内皮细胞(HUVEC)中DDX11-AS1、miR-627-3p表达水平,探讨DDX11-AS1参与HUVEC增殖和凋亡的分子机制,以期为AS防治提供新的途径。
1 材料与方法
1.1 细胞和试剂
HUVEC购自中国科学院典型培养物保藏中心; 杜尔伯格伊戈尔培养基(DMEM)、胎牛血清、青霉素/链霉素、ox-LDL购自美国Sigma公司; 逆转录试剂盒、SYBR Green master mix购自大连宝生物科技公司; 两步法miRNA荧光定量聚合酶链反应检测试剂盒购自北京全式金生物技术有限公司; DDX11-AS1过表达质粒(pcDNA-DDX11-AS1)及其对照(pcDNA-con)、miR-627-3p抑制物(anti-miR-627-3p)及其对照(anti-miR-con)、DDX11-AS1小干扰RNA(si-DDX11-AS1)及其对照(si-con)、miR-627-3p模拟物(miR-627-3p mimics)及其对照(miR-con)、荧光素酶报告载体购自上海凯基生物公司; 细胞计数试剂盒(CCK-8)、TRIzol试剂、膜联蛋白V-异硫氰酸荧光素/碘化丙啶(Annexin-V-FITC/PI)试剂盒、放射免疫沉淀测定(RIPA)裂解缓冲液购自北京索莱宝生物公司; 兔源细胞周期素D1(CyclinD1)、核因кB(NF-кB)、p65亚基(p-p65)、裂解的半胱氨酸蛋白酶(Cleaved-caspase-3)单克隆抗体购自上海艾博抗生物技术公司; 兔源磷酸化的NF-кB抑制蛋白α(p-IкBα)抗体、羊抗兔IgG二抗购自上海赛信通生物技术公司。
1.2 动脉粥样硬化细胞模型构建
HUVEC用添加10%的胎牛血清、1%青霉素/链霉素的DMEM培养基,置于37 ℃、含5% CO2的细胞培养箱中培养。用50 μg/mL的ox-LDL刺激HUVEC 48 h, 构建动脉粥样硬化细胞模型。
1.3 实时荧光定量聚合酶链反应(RT-qPCR)检测LncRNA DDX11-AS1和miR-627-3p的表达
用TRIzol试剂分离HUVEC中总RNA。用逆转录试剂盒、SYBR Green master mix进行反转录和RT-qPCR反应。使用两步法miRNA荧光定量PCR检测试剂盒测定miR-627-3p表达水平。分别以β-actin、U6为内参, 2-ΔΔCt法分析DDX11-AS1、miR-627-3p相对表达水平。DDX11-AS1引物序列: 上游5′-CAGCAACCTTTCTGGGAAGC-3′, 下游5′-ACAAG AGCTGAGCTTGTCTTT-3′。miR-627-3p引物序列: 上游5′-CACTCATCTTTTCTTTG-3′, 下游5′-GAGTCTCTTGAGAGT ACAT-3′。U6引物序列: 上游5′-CTCGCTTCGGCAGCA CA-3′, 下游5′-ACGCTTCACGAATTTGC-3′。β-actin引物序列: 上游5′-TCAC CCACACTGT GCCCATCTACGA-3′, 下游5′-CAGCGGAACCGCTC ATTGCCAATGG-3′。
1.4 细胞转染和实验分组
将对数期HUVEC接种96孔板,用Lipofectamine 2000将pcDNA-con、pcDNA-DDX11-AS1、anti-miR-con、anti-miR-627-3p、pcDNA-DDX11-AS1+miR-con、pcDNA-DDX11-AS1+miR-627-3p mimics分别转染HUVEC细胞, 48 h后用50 μg/mL的ox-LDL刺激HUVEC 48 h, 依次记为ox-LDL+pcDNA-con组、ox-LDL+ pcDNA-DDX11-AS1组、ox-LDL+anti-miR-con组、ox-LDL+ anti-miR-627-3p组、ox-LDL+pcDNA-DDX11-AS1+ miR-con组、ox-LDL+pcDNA-DDX11-AS1+miR-627-3p组。收集各组细胞进行后续实验。
1.5 CCK-8法检测细胞增殖
将转染或未转染的HUVEC(3×103个/孔)接种到96孔板,设置3个重复。采用50 μg/mL的ox-LDL孵育48 h, 按10 μL/孔加入CCK-8溶液,继续培养3 h。酶标仪检测450 nm处光密度(OD)值。细胞存活率=(实验组OD-对照组OD)×100%
1.6 流式细胞术检测细胞凋亡
ox-LDL刺激48 h后,胰蛋白酶消化,结合缓冲液重悬各组HUVEC。分别加入5 μL的Annexin V-FITC、PI, 室温下于黑暗环境中染色15 min, 流式细胞仪检测凋亡细胞。以早期(Annexin V-FITC染色, PI染色阴性)和晚期凋亡率(Annexin V-FITC和PI染色均为阳性)之和表示细胞凋亡率。
1.7 蛋白质印迹(Western blot)检测Cleaved-caspase-3、p-p65、CyclinD1和p-IкBα蛋白表达水平
使用RIPA裂解缓冲液裂解各组HUVEC。聚丙烯酰胺凝胶分离等量的蛋白质,然后进行湿法转膜。5%脱脂牛奶缓冲液25 ℃孵育膜1 h以防止非特异性结合。然后加入一抗溶液4 ℃孵育过夜,二抗溶液室温孵育1 h后,使用增强型化学发光试剂检测膜中的蛋白条带。Image J软件分析目的条带相对灰度值。
1.8 双荧光素酶报告基因实验
LncBase Predicted v.2在线预测miR-627-3p与DDX11-AS1之间存在潜在互补序列。将含有miR-627-3p结合位点的DDX11-AS1序列插入pmirGLO荧光素酶报告载体构建野生型(WT)DDX11-AS1报告载体(DDX11-AS1-WT), 同时通过突变(MUT)miR-627-3p的结合位点得到相应的突变体(DDX11-AS1-MUT)。用DDX11-AS1-WT、DDX11-AS1-MUT分别与miR-con、miR-627-3p共转染HUVEC, 荧光素酶活性分析试剂盒检测转染48 h后荧光素酶活性。为证实DDX11-AS1对miR-627-3p的调控作用,将pcDNA-con、pcDNA-DDX11-AS1、si-con、si-DDX11-AS1分别转染HUVEC, RT-qPCR检测转染48 h后miR-627-3p表达水平。
1.9 统计学分析
2 结 果
2.1 ox-LDL处理的HUVEC中LncRNADDX11-AS1、miR-627-3p的表达情况
ox-LDL处理48 h后, RT-qPCR检测HUVEC中LncRNA DDX11-AS1和miR-627-3p表达, ox-LDL组HUVEC细胞中LncRNA DDX11-AS1表达水平低于对照组, miR-627-3p表达水平高于对照组,差异有统计学意义(P<0.05)。见表1。
表1 ox-LDL处理的HUVEC中LncRNA DDX11-AS1、miR-627-3p的表达情况
2.2 上调DDX11-AS1表达对ox-LDL处理的HUVEC增殖和凋亡的影响
CCK-8、流式细胞术、RT-qPCR、Western blot检测结果显示,与对照组比较, ox-LDL组HUVEC存活率、DDX11-AS1表达水平、CyclinD1蛋白表达降低,差异有统计学意义(P<0.05), 凋亡率和Cleaved-caspase-3蛋白表达升高,差异有统计学意义(P<0.05); 与ox-LDL+pcDNA-con组比较, ox-LDL+pcDNA-DDX11-AS1组HUVEC存活率、DDX11-AS1表达水平、CyclinD1蛋白表达升高,差异有统计学意义(P<0.05), 凋亡率和Cleaved-caspase-3蛋白表达降低,差异有统计学意义(P<0.05)。表明上调DDX11-AS1表达可抑制OX-LDL诱导的HUVEC凋亡,促进细胞增殖。见图1、表2。
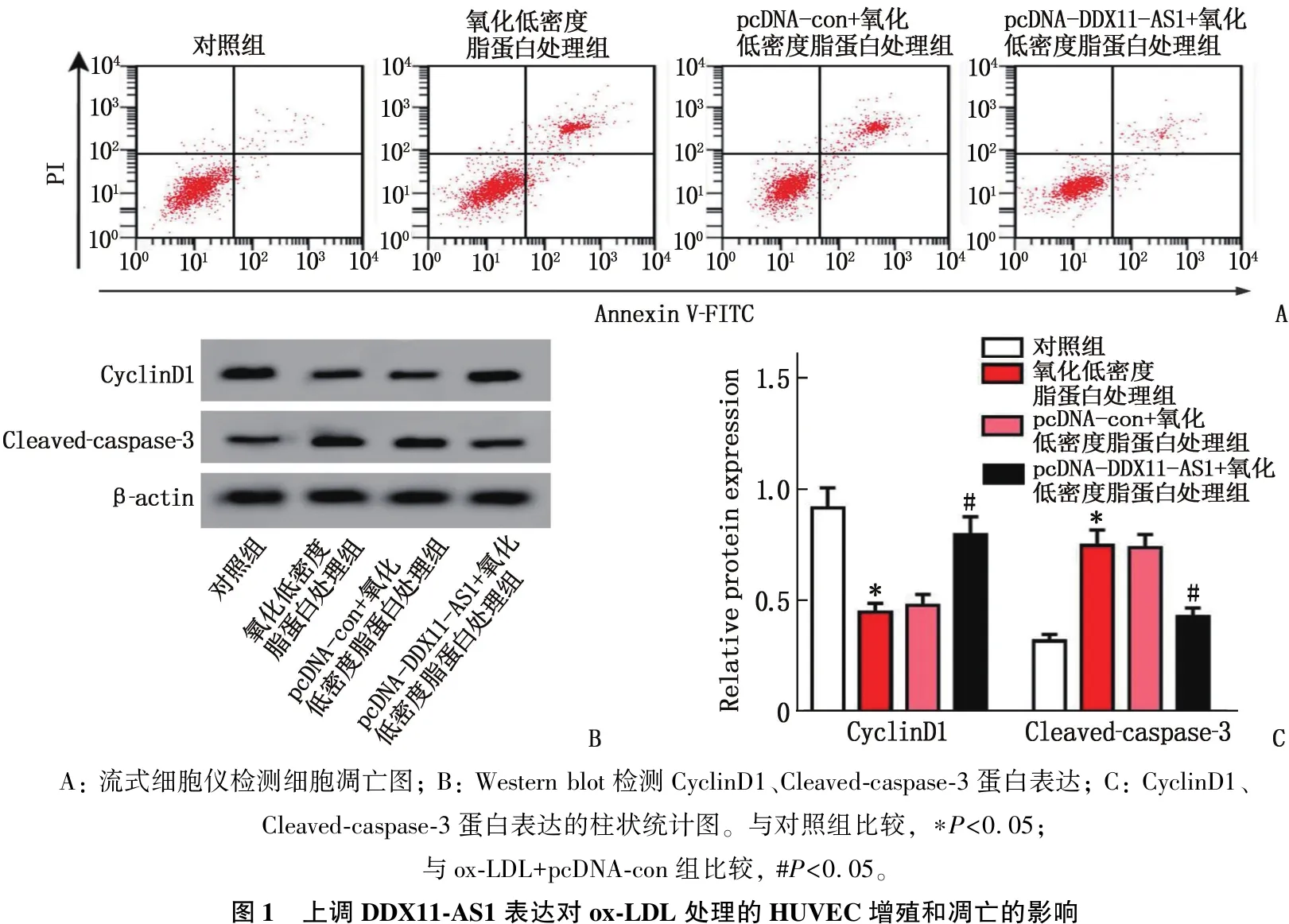
A: 流式细胞仪检测细胞凋亡图; B: Western blot检测CyclinD1、Cleaved-caspase-3蛋白表达; C: CyclinD1、Cleaved-caspase-3蛋白表达的柱状统计图。与对照组比较, ∗P<0.05; 与ox-LDL+pcDNA-con组比较, #P<0.05。图1 上调DDX11-AS1表达对ox-LDL处理的HUVEC增殖和凋亡的影响
表2 上调DDX11-AS1表达对ox-LDL处理的HUVEC增殖和凋亡的影响
2.3 下调miR-627-3p表达对ox-LDL处理的HUVEC增殖和凋亡的影响
CCK-8、流式细胞术、RT-qPCR、Western blot检测结果显示,与ox-LDL+anti-miR-con组比较, ox-LDL+anti-miR-627-3p组HUVEC凋亡率、miR-627-3p表达水平、Cleaved-caspase-3蛋白表达降低,存活率和CyclinD1蛋白表达升高,差异有统计学意义(P<0.05)。表明下调miR-627-3p表达可抑制ox-LDL诱导的HUVEC凋亡,促进细胞增殖。见图2、表3。
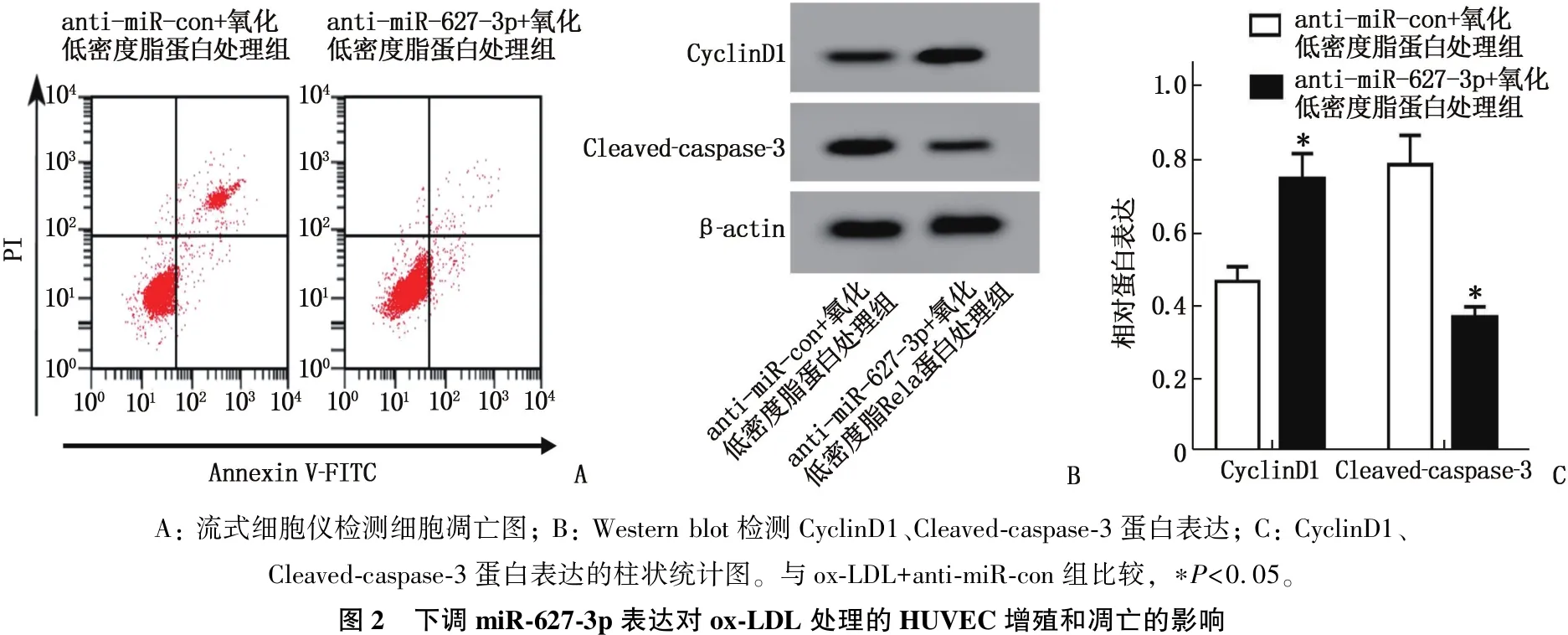
A: 流式细胞仪检测细胞凋亡图; B: Western blot检测CyclinD1、Cleaved-caspase-3蛋白表达; C: CyclinD1、Cleaved-caspase-3蛋白表达的柱状统计图。与ox-LDL+anti-miR-con组比较, ∗P<0.05。图2 下调miR-627-3p表达对ox-LDL处理的HUVEC增殖和凋亡的影响
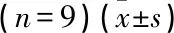
表3 下调miR-627-3p表达对ox-LDL处理的HUVEC增殖和凋亡的影响
2.4 LncRNA DDX11-AS1靶向miR-627-3p
LncBase Predicted v.2预测到miR-627-3p与LncRNA DDX11-AS1存在特异结合位点,见图3。双荧光素酶活性检测显示,与转染miR-con比较,转染miR-627-3p mimics可降低DDX11-AS1-WT的荧光素酶活性,差异有统计学意义(P<0.05),而对DDX11-AS1--MUT的荧光素酶活性无显著影响,见表4。RT-qPCR检测结果显示, pcDNA-DDX11-AS1组HUVEC中miR-627-3p表达水平较pcDNA-con组降低,差异有统计学意义(P<0.05); si-DDX11-AS1组HUVEC中miR-627-3p表达水平较si-con组升高,差异有统计学意义(P<0.05)。见表5。表明DDX11-AS1靶向负性调控miR-627-3p表达。

图3 LncRNA DDX11-AS1靶向miR-627-3p
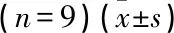
表4 双荧光素酶活性检测
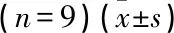
表5 RT-qPCR检测miR-627-3p的表达
2.5 上调miR-627-3p表达可以逆转DDX11-AS1上调对ox-LDL处理的HUVEC增殖和凋亡的影响
CCK-8、流式细胞术、RT-qPCR、Western blot检测结果显示,与ox-LDL+pcDNA-DDX11-AS1+miR-con组比较, ox-LDL+pcDNA-DDX11-AS1+ miR-627-3p组HUVEC凋亡率、miR-627-3p表达水平、Cleaved-caspase-3蛋白表达升高,存活率和CyclinD1蛋白表达降低,差异有统计学意义(P<0.05)。见图4、表6。表明上调miR-627-3p表达可逆转DDX11-AS1上调对ox-LDL处理的HUVEC增殖和凋亡的影响。
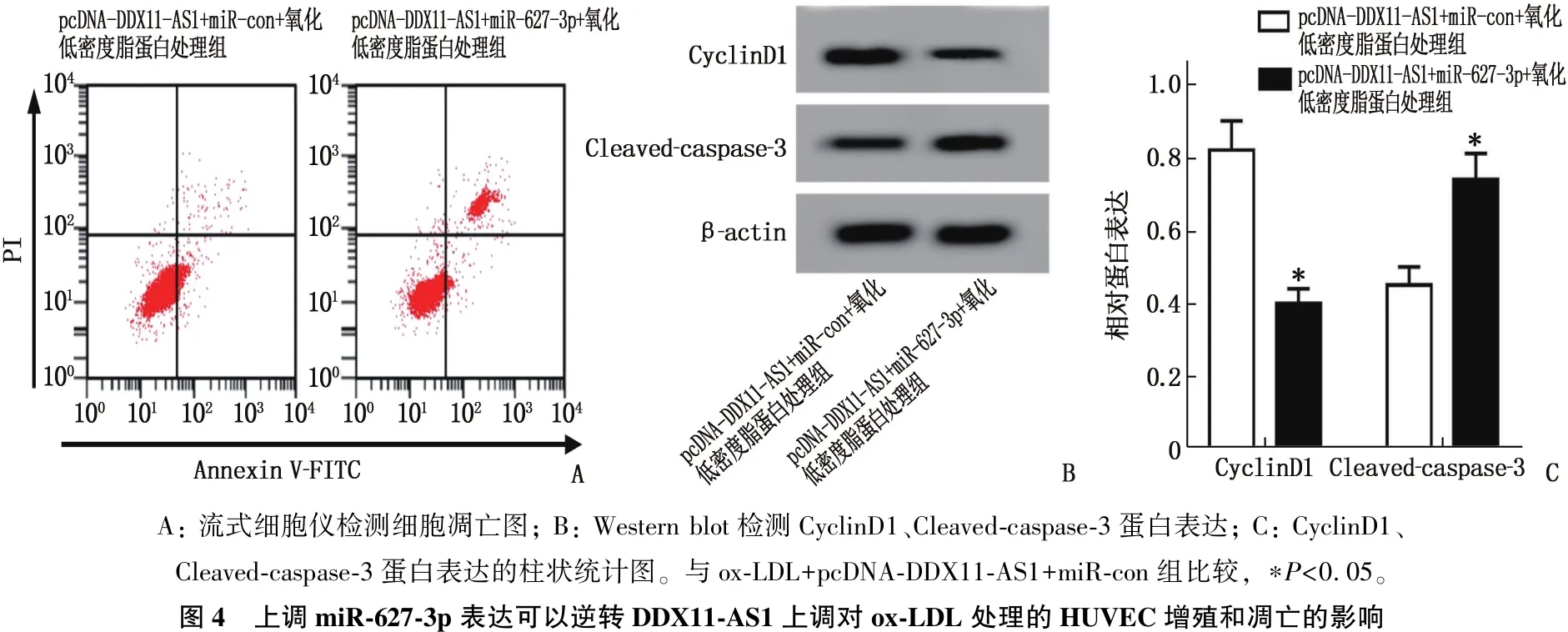
A: 流式细胞仪检测细胞凋亡图; B: Western blot检测CyclinD1、Cleaved-caspase-3蛋白表达; C: CyclinD1、Cleaved-caspase-3蛋白表达的柱状统计图。与ox-LDL+pcDNA-DDX11-AS1+miR-con组比较, ∗P<0.05。图4 上调miR-627-3p表达可以逆转DDX11-AS1上调对ox-LDL处理的HUVEC增殖和凋亡的影响
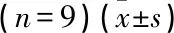
表6 上调miR-627-3p表达可以逆转DDX11-AS1上调对ox-LDL处理的HUVEC增殖和凋亡的影响
2.6 NF-κB信号通路相关蛋白的表达
Western blot检测结果显示,与对照组比较, ox-LDL组HUVEC细胞中p-p65和p-IкBα表达水平升高,差异有统计学意义(P<0.05); 与ox-LDL+pcDNA-con组比较, ox-LDL+ pcDNA-DDX11-AS1组HUVEC细胞中p-p65和p-IкBα表达水平降低,差异有统计学意义(P<0.05); 与ox-LDL+pcDNA-DDX11-AS1+miR-con组比较, ox-LDL+ pcDNA-DDX11-AS1+miR-627-3p组HUVEC细胞中p-p65和p-IкBα表达水平升高,差异有统计学意义(P<0.05)。见图5、表7。表明DDX11-AS1靶向miR-627-3p在AS进展中的作用可能与抑制NF-κB途径有关。
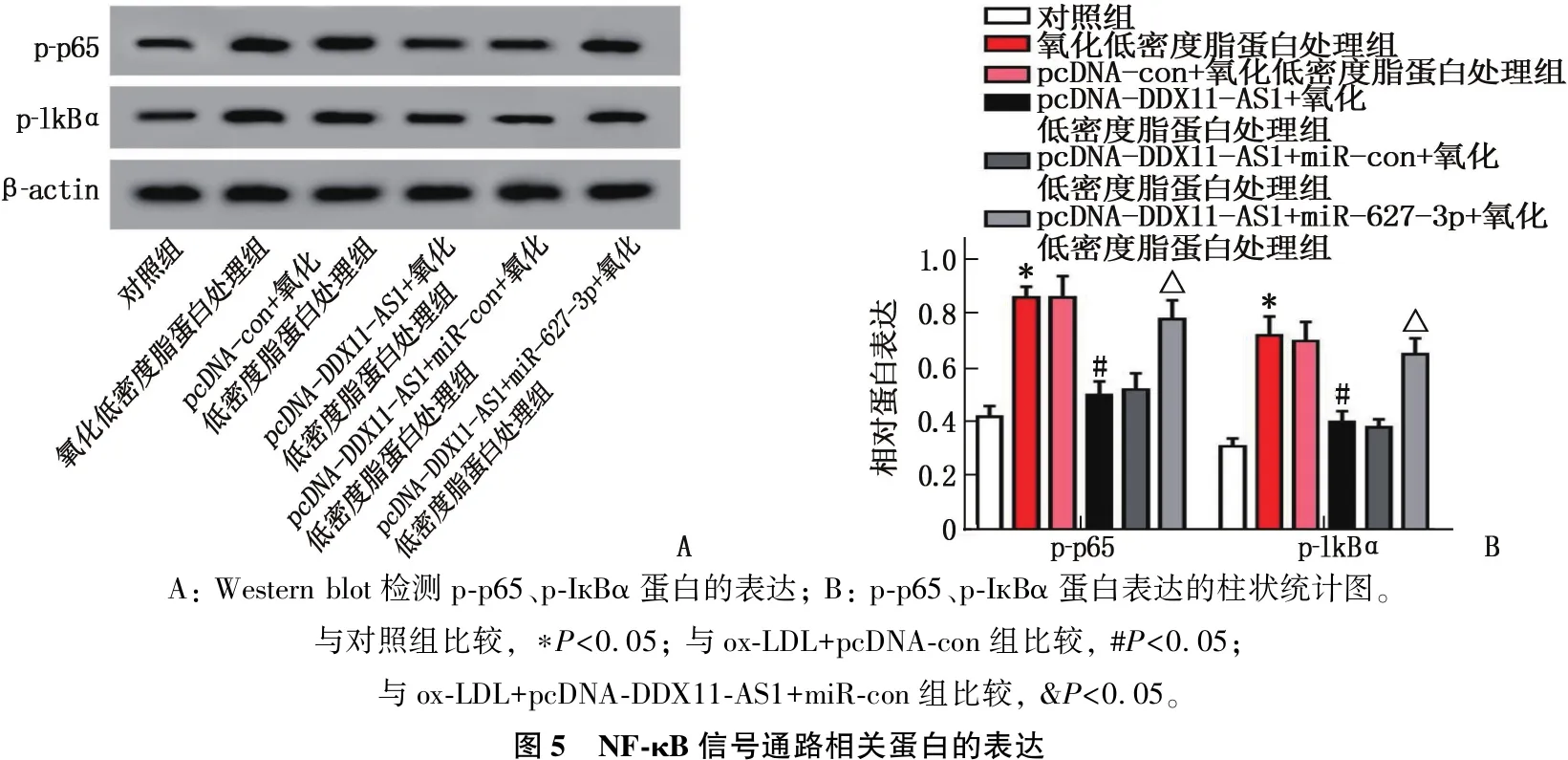
A: Western blot检测p-p65、p-IкBα蛋白的表达; B: p-p65、p-IкBα蛋白表达的柱状统计图。与对照组比较, ∗P<0.05; 与ox-LDL+pcDNA-con组比较, #P<0.05; 与ox-LDL+pcDNA-DDX11-AS1+miR-con组比较, &P<0.05。图5 NF-κB信号通路相关蛋白的表达
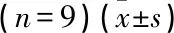
表7 NF-κB信号通路相关蛋白的表达
3 讨 论
研究[7]表明, lncRNA参与包括心血管疾病在内的多种人类疾病的病理生理过程。本研究旨在阐明AS中DDX11-AS1对血管内皮细胞增殖和凋亡的影响及其分子机制。
DDX11-AS1位于染色体12p11.21位点,与胃癌、膀胱癌进展密切相关[8-10]。研究[8]显示, DDX11-AS1在胃癌组织和细胞中表达升高,下调DDX11-AS1表达,显著降低胃癌细胞的增殖和克隆形成能力,诱导细胞周期阻滞和细胞凋亡。DDX11-AS1通过靶向miR-326调节奥沙利铂耐药胃癌细胞的增殖、迁移、侵袭和凋亡[9]。此外, DDX11-AS1通过直接与miR-499b-5p促进肿瘤生长,进而加剧膀胱癌进展[10]。这些研究表明DDX11-AS1在人类疾病中起重要作用。本研究显示, ox-LDL刺激HUVEC存活率显著降低,凋亡率显著升高,这与霍鑫等[11]报道一致。同时,本研究显示ox-LDL刺激降低DDX11-AS1水平,提示DDX11-AS1低表达可能参与ox-LDL诱导的HUVEC损伤。功能分析显示,上调DDX11-AS1可减轻ox-LDL诱导的HUVEC凋亡,下调促凋亡蛋白Cleaved-caspase-3表达,上调CyclinD1蛋白表达,提高细胞存活率。以上结果提示,上调DDX11-AS1表达可抑制ox-LDL诱导的HUVEC损伤,抑制AS发生发展。
研究[12-13]表明, lncRNAs通过与特异性miRNA结合调节下游靶基因表达参与胆固醇代谢、血管内皮细胞凋亡、炎症反应等AS进展的多个生物学过程。miR-627-3p在肺癌中具有抑癌功能,敲除lncRNA RP11-284F21.9, 通过上调miR-627-3p可抑制肺癌肿瘤形成[14]。本研究显示, ox-LDL刺激后HUVEC中miR-627-3p表达显著升高,转染anti-miR-627-3p下调miR-627-3p表达,可抑制ox-LDL诱导的HUVEC存活率下降和细胞凋亡,促进CyclinD1表达,抑制Cleaved-caspase-3表达,与上调DDX11-AS1表达的作用一致。采用双荧光素酶报告基因和RT-qPCR检测进一步验证二者关系发现, DDX11-AS1对miR-627-3p具有靶向负调控作用。此外,上调miR-627-3p表达,还可逆转DDX11-AS1上调对ox-LDL处理的HUVEC增殖、凋亡的影响,这进一步说明DDX11-AS1通过靶向miR-627-3p抑制ox-LDL诱导的HUVEC凋亡,促进细胞增殖,抑制AS进展。
NF-κB是炎症和免疫稳态的重要调节剂,其激活可诱导促炎因子表达、内皮损伤和脂质沉积,从而导致AS的形成和进展[15-16]。本研究显示, ox-LDL刺激可抑制p65和IкBα的磷酸化,上调DDX11-AS1表达,则降低ox-LDL对p65和IкBα磷酸化的影响,而上调miR-627-3p表达,可逆转DDX11-AS1上调的作用。以上研究说明, DDX11-AS1靶向miR-627-3p在AS进展中的作用可能与抑制NF-κB途径有关。
综上所述, LncRNA DDX11-AS1通过靶向miR-627-3p能够抑制ox-LDL诱导HUVEC凋亡,促进细胞增殖,其机制可能与抑制NF-κB途径有关。因此,靶向DDX11-AS1/miR-627-3p有望成为临床防治AS的重要策略。
