缺氧相关长链非编码RNA与乳腺癌患者预后的相关性及其在预测乳腺癌预后的风险中的价值
2022-01-27闫雷杨洋
闫 雷 杨 洋
(安徽医科大学附属宿州医院放化疗科,宿州市 234000,电子邮箱:yanlei0702@163.com)
2020年,女性乳腺癌约有226万新病例,其发病率已超过肺癌,成为全球发病率最高的癌症,占所有新癌症病例的11.7%,同时其也是全球第五大癌症死亡原因[1],这给国家及个人带来极大的经济负担,还给个人带来一定的心理压力。因此,应积极改善乳腺癌患者的预后,以减轻其负担并提高其生活质量。由于血管的有限供氧能力和肿瘤细胞的高耗氧能力之间处于不平衡的状态,大多数实体恶性肿瘤都存在一定程度的缺氧。缺氧导致肿瘤出现缺氧耐受细胞,该细胞能够促进肿瘤的局部侵袭、转移和复发[2]。故靶向缺氧成为治疗癌症的重要策略之一[3]。长链非编码RNA(long non-coding RNA,lncRNA)在不同水平上参与癌症的发生和发展,包括表观、转录和转录后调控[4]。研究表明lncRNA与多种肿瘤的预后密切相关[5]。寻找与乳腺癌缺氧相关的关键lncRNA,对于改善患者的预后具有重要意义。本研究分析癌症基因组图谱数据库(the Cancer Genome Atlas,TCGA)中乳腺癌患者的lncRNA表达,筛选出具有预后预测价值的缺氧相关lncRNA,并构建预测乳腺癌预后的风险评分模型,旨在为临床预测乳腺癌患者的预后提供参考。
1 材料与方法
1.1 数据下载与筛选 从TCGA数据库(https://portal.gdc.ancer.gov/)中获取乳腺癌患者的RNA转录组测序数据和临床数据。纳入标准:(1)病理诊断为乳腺导管癌或乳腺小叶癌的初治女性患者;(2)患者的lncRNA表达水平检测数据和年龄、生存时间等临床数据无缺失。排除标准:(1)随访时间≤30 d或随访时间缺失;(2)男性乳腺癌患者;(3)其余病理类型者。最终获得981例乳腺癌患者的资料。患者年龄(58.19±13.20)岁,生存时间为31d至23.57年(随访起始点不详);肿瘤分级Ⅰ级172例,Ⅱ级589例,Ⅲ级202例,Ⅳ级18例;T1期269例,T2期547例,T3期129例,T4期36例;M0期866例,M1期115例;N0期481例,N1期307例,N2期118例,N3期75例。
1.2 缺氧相关基因共表达的lncRNA的筛选 应用R 4.0.2软件中的limma软件包从乳腺癌患者的RNA测序数据中提取缺氧相关基因的表达信息(缺氧相关基因从https://www.gsea-msigdb.org/gsea/msigdb/网上数据库获得)。应用R 4.0.2软件,采用Spearman检验评估lncRNA与缺氧相关基因表达水平之间的相关性,以r2>0.3、P<0.001为标准筛选缺氧相关基因共表达的lncRNA。
1.3 与乳腺癌预后有关的缺氧相关lncRNA的筛选及其风险评分模型构建 应用R 4.0.2软件进行LASSO回归、单因素和多因素Cox回归分析。首先,以生存情况作为因变量,以获得的缺氧相关基因lncRNA作为自变量,采用批量单因素Cox回归分析筛选与乳腺癌预后有关的缺氧相关lncRNA(以P<0.05为标准)。然后,将获得的lncRNA纳入LASSO回归,经验证,当λ值为-4.96时模型拟合较好,将此条件下筛选出的lncRNA作为自变量,进行多因素Cox回归分析。多因素Cox回归分析时,使用survival包通过PH假设和共线性检验自变量,确定与乳腺癌预后有关的缺氧相关lncRNA及其回归系数;建立基于缺氧相关lncRNA预测乳腺癌患者预后的风险评分模型,即风险评分=lncRNA1回归系数×lncRNA1表达量+lncRNA2回归系数×lncRNA2表达量+......+lncRNAn回归系数×lncRNAn表达量。
1.4 风险评分模型预测乳腺癌患者预后的能力的验证 计算每例乳腺癌患者的风险评分,根据中位值将乳腺癌患者分为高危组和低危组,应用R 4.0.2软件绘制两组的生存曲线(Kaplan-Meier法),并采用log-rank检验进行比较(以P<0.05为差异具有统计学意义)。应用R 4.0.2软件绘制时间依赖性受试者工作特征(receiver operating characteristic,ROC)曲线,采用一致性指数(concordance index,C-index)和曲线下面积(area under the curve,AUC)评估风险评分预测乳腺癌患者预后的效能。
1.5 乳腺癌患者预后的影响因素及Nomogram模型的构建 应用R 4.0.2软件,将风险评分和年龄及肿瘤分级、原发肿瘤-区域淋巴结-远处转移(tumor-node-metastasis,TNM)分期等临床病理特征作为自变量进行单因素和多因素Cox回归分析,进一步分析乳腺癌患者预后的独立影响因素,均以P<0.05为差异具有统计学意义。利用获得的独立影响因素构建Nomogram模型,包括预测乳腺癌患者1年、3年、5年生存情况的风险模型;随后应用ROC曲线评价并比较Nomogram模型与年龄及肿瘤分级、TNM分期等临床病理指标预测乳腺癌患者生存情况的效能。
2 结 果
2.1 与乳腺癌预后有关的缺氧相关lncRNA及风险评分 以r2>0.3、P<0.001为筛选标准,共筛选出1 180个与缺氧相关的lncRNA。采用单因素Cox回归分析初步筛选,得到与乳腺癌预后有关的缺氧相关lncRNA共44个(P<0.05);经LASSO回归分析,发现其中23个缺氧相关lncRNA与乳腺癌预后可能有关,见图1。采用多因素Cox回归进一步分析,结果显示有12个缺氧相关lncRNA与乳腺癌预后相关,见表1。其中9个lncRNA(TNFRSF14-AS1、AL606834.2、LINC01871、AL136368.1、SEMA3B-AS1、AL136531.1、BAIAP2-DT、AC061992.1和AC008105.3)是保护性因素,高表达患者预后较好;而3个lncRNA(Z68871.1、LINC01235和AC090198.1)是危险因素,高表达患者预后不佳。乳腺癌患者的风险评分模型为:风险评分=0.563×Z68871.1-0.325×TNFRSF14-AS1-0.370×AL606834.2+0.010×LINC01235-0.368×LINC01871-0.690×AL136368.1-0.062×SEMA3B-AS1-0.439×AL136531.1-0.043×BAIAP2-DT-0.215×AC061992.1+0.091×AC090198.1-0.535×AC008105.3。

图1 LASSO回归分析结果

表1 多因素Cox回归分析结果
2.2 风险评分的验证结果 根据缺氧相关lncRNA的风险评分(中位值为1.27分),将乳腺癌患者分为低风险组(<1.27分,n=491)和高风险组(≥1.27分,n=490),两组的生存率差异有统计学意义(χ2=38.472,P<0.001),高风险组患者的生存时间较短,见图2。预后标志的C指数为0.798,表明风险评分对乳腺癌具有可靠和准确的诊断作用。同时时间依赖性ROC曲线分析结果显示,基于缺氧相关lncRNA风险评分预测乳腺癌患者1年、3年和5年生存情况的AUC分别为0.699(95%CI:0.601,0.814;P<0.05)、0.755(95%CI:0.683,0.905;P<0.05)和0.729(95%CI:0.637,0.895;P<0.05),见图3。
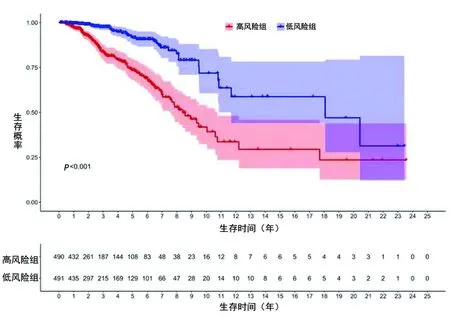
图2 低风险组和高风险组乳腺癌患者的生存曲线比较

图3 基于缺氧相关lncRNA的风险评分预测乳腺癌患者生存情况的时间依赖性ROC曲线
2.3 乳腺癌患者预后的影响因素 以患者年龄(赋值:<60岁=0,≥60岁=1)、肿瘤分级(Ⅰ 期=1,Ⅱ 期=2,Ⅲ期=3,Ⅳ期=4)、T分期(T1期=1,T2期=2,T3期=3,T4期=4)、M分期(M0期=0,M1期=1)、N分期(N0期=0,N1期=1,N2期=2,N3期=3)、风险评分(<1.27分=0,≥1.27分=1)作为自变量,以患者生存时间和生存状态为因变量,进行单因素Cox回归分析,结果显示年龄、肿瘤分级、T分期、M分期、N分期和风险评分均与乳腺癌患者的生存情况相关(均P<0.05),见表2。将以上6个指标纳入多因素Cox回归模型,结果显示年龄和风险评分与乳腺癌患者的生存情况相关(均P<0.05),见表2。将患者年龄及风险评分纳入Nomogram模型,构建预测1年、3年、5年生存情况的风险模型(见图4A)。ROC曲线分析结果显示,Nomogram模型预测乳腺癌患者总体生存情况的AUC值为0.750,略小于年龄(AUC=0.764),大于肿瘤分级(AUC=0.648)、T分期(AUC=0.669)、M分期(AUC=0.581)和N期(AUC=0.583),见图4B。

表2 影响乳腺癌患者生存情况的单因素和多因素Cox回归分析
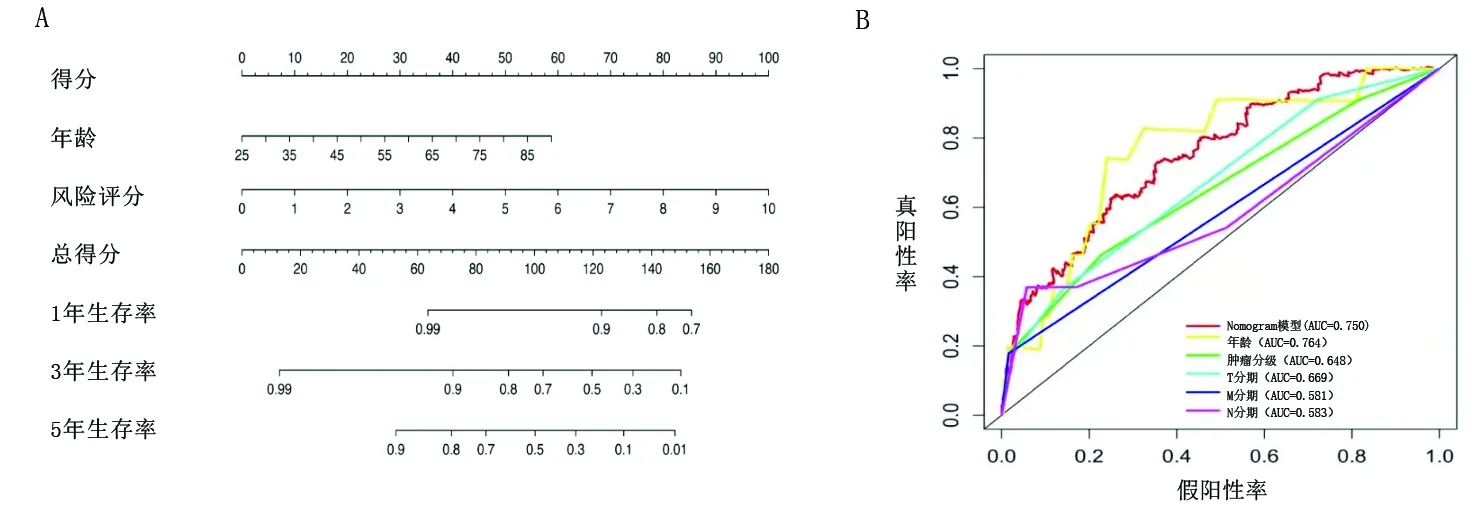
图4 乳腺癌患者Nomogram模型的构建与验证
3 讨 论
肿瘤能够刺激新生血管无序生长,而肿瘤的增殖速度超过血管的生成速度,会导致实体肿瘤缺氧。持续低氧导致肿瘤血管的空间扭曲,这可能引起毛细血管间距增加,从而导致氧扩散受到限制;持续低氧还可能引起闭合的血管重新开放,导致缺氧再灌注损伤、自由基增加、应激反应基因激活和组织损伤,这也使得药物难以扩散到肿瘤部位[3]。肿瘤细胞和缺氧性肿瘤微环境成分之间的相互作用,再加上淋巴管生成和血管生成机制的激活,使肿瘤对特定临床干预措施的反应进一步复杂化。因此,需要确定缺氧性肿瘤微环境,以更好地了解和探讨导致肿瘤细胞耐药的机制[6]。乳腺癌发病隐匿,恶性程度较高,有一半以上的患者的病灶存在缺氧区域,并且与肿瘤侵袭性、化放疗反应不良直接相关[7-8]。因此,探讨乳腺癌患者肿瘤微环境中的分子机制显得尤为重要。
lncRNA在癌症的发展中起着重要作用,已发现部分lncRNA在乳腺癌中有表达[9-11]。例如,HOTAIR是目前研究最多的lncRNA调控因子之一,也是首个作为转移标志物的lncRNA,其表达上调时具有致瘤性,可诱导乳腺癌细胞系迁移和侵袭,并且HOTAIR上调的患者存活率往往较低[12]。lncRNA ARNILA在三阴性乳腺癌局部侵袭和转移中起关键作用[12]。还有研究报告,lncRNA BCRT1在乳腺癌组织中的表达显著上调,且与乳腺癌患者预后不良有关;lncRNA BCRT1可以竞争性地与miRNA-1303结合,阻止其靶基因PTBP3的降解,从而促进乳腺癌的发生和发展;lncRNA BCRT1过表达可促进巨噬细胞M2极化,这种极化由外切体介导,从而进一步加速乳腺癌的进展[13]。在本研究中,共获得12个与乳腺癌患者的预后密切相关的缺氧相关lncRNA,其中TNFRSF14-AS1、AL606834.2、LINC01871、AL136368.1、SEMA3B-AS1、AL136531.1、BAIAP2-DT、AC061992.1和AC008105.3为保护性因素,Z68871.1、LINC01235、AC090198.1为危险因素。目前,尚未见有关上述缺氧相关lncRNA在乳腺癌中的研究,但可见部分lncRNA在其他肿瘤中的研究。例如,SEMA3B和SEMA3B-AS1在食管癌细胞和食管鳞癌组织中表达下调,且两者在食管鳞癌组织中的表达水平与TNM分期和淋巴结转移有关;而过表达SEMA3B和SEMA3B-AS1可抑制食管癌细胞的体外活性和侵袭力[14]。LINC01235可通过上皮间质转化促进胃癌细胞的转移,其在胃癌组织中高表达与预后不良呈正相关,是预后不良的独立标志物[15]。可见,这些lncRNA对其他肿瘤的影响,与本研究中对乳腺癌的影响相似。结合lncRNA的功能,我们推测缺氧相关lncRNA可能通过与微小RNA的相互作用、调控表观遗传基因和参与上皮间质转化从而参与肿瘤的转移和进展。今后,需要更多的研究来阐明缺氧相关lncRNA在乳腺癌发生、发展过程中的功能和关键机制。因此,在后续的研究中,我们将针对以上与乳腺癌患者预后相关的lncRNA进行进一步基础实验和功能研究。
精准基因组医学的重点是从含有临床结果的大型医学数据中找出准确、特异地预测生存预后的因素。因此,我们根据获得的12个缺氧相关lncRNA构建了风险评分模型,并进一步验证了该评分模型评估乳腺癌患者预后的价值。结果显示,高风险评分乳腺癌患者生存时间较短(P<0.05),预后标志的C指数为0.798,表明风险评分对乳腺癌具有可靠和准确的诊断作用。同时时间依赖性ROC曲线分析结果显示,该评分预测乳腺癌患者1年、3年和5年生存情况均具有较好的效能(AUC值均>0.65)。由此可见,基于缺氧相关lncRNA的风险评分有助于评估乳腺癌患者的预后。然而,乳腺癌患者的预后还可能受到其他临床病理特征的影响。因此,我们将风险评分与患者年龄、肿瘤分级、TNM分期作为自变量,采用多因素Cox回归模型进一步筛选乳腺癌患者预后的影响因素,并将所获得的影响因素(患者年龄和风险评分)通过绘制Nomogram图构建了风险模型,ROC曲线分析结果表明该模型对乳腺癌患者的预后也具有较好的预测价值(AUC值为0.750),且预测效能优于肿瘤分级、TNM分期等指标。 因此,除了常规的临床病理特征,在临床上还应该根据相关基因的表达来评估患者的预后,从而更好地制定后续治疗方案和随访措施。但本研究仅仅纳入了部分临床病理特征进行预后分析,未考虑到治疗方案等其他可能影响预后的因素,今后还应纳入更多的因素深入研究,以完善预测模型。
总之,本研究筛选出12个与乳腺癌患者的预后密切相关的缺氧相关lncRNA,由其组成的风险评分模型对乳腺癌患者的预后有较好的预测价值,而结合相关临床指标与风险评分综合评估患者的预后,或可为制定远期的治疗或随访方案提供更多的依据。今后可设计分子实验以验证缺氧相关lncRNA在乳腺癌发生、发展中的确切分子机制。
