白藜芦醇增加甲状腺癌SW579细胞放射敏感性的机制
2022-01-27艾尼沙塔尔张建庆刘思吟苏鹏程波拉提沙依提
艾尼·沙塔尔, 张建庆, 丁 伟, 刘思吟, 苏鹏程, 波拉提·沙依提*
(1.新疆维吾尔自治区人民医院乳腺甲状腺科,新疆 乌鲁木齐 830000;2.新疆维吾尔自治区人民医院放疗科,新疆 乌鲁木齐 830000)
甲状腺癌是人类最主要的内分泌肿瘤,其发病率逐年上升[1],且因甲状腺瘤细胞对放射线具有抗性,从而导致患者放疗效果欠佳[2-3],如何提高甲状腺瘤细胞对射线的敏感性成为了甲状腺癌研究的主要方向。白藜芦醇(resveratrol)[4]是从天然植物提取物中发现的一种具有广泛药理性质的天然抗毒素,具有抗氧化效能[5],且能够阻止低密度脂蛋白的氧化,因而具有潜在的预防心血管疾病、抗病毒、免疫调节以及预防癌症的作用。已经有研究证实白藜芦醇在肿瘤的发生发展中发挥重要功能[6],如白藜芦醇可抑制癌细胞增殖、抑制细胞周期进程、干扰信号转导通路、抑制癌基因表达、诱导细胞凋亡等。近些年来,有研究发现白藜芦醇可提高多种肿瘤细胞对放射治疗的敏感性,如在人咽鳞癌细胞[7]和食管腺癌细胞[8]中具有放射增敏作用,但关于白藜芦醇对甲状腺癌细胞的增敏性研究仍较少。本研究拟检测白藜芦醇对甲状腺癌SW579细胞增殖、凋亡、放射增敏性的影响,并深入探讨其分子机制,为相关研究提供实验基础和理论依据。
1 材料与方法
1.1 药物、试剂及仪器 白藜芦醇(纯度≥98%)购于美国Sigma公司。胎牛血清购于美国Gibco公司;L-15培养基购于武汉博士德生物工程有限公司;MTT、DMSO购于美国Ameserco公司;青霉素-链霉素溶液购于美国赛默飞公司;SDS-PAGE试剂盒和BCA蛋白定量试剂盒均购于上海碧云天生物技术有限公司;蛋白免疫印记实验中所用的一抗和羊抗鼠二抗均购于美国Santa Cruz公司。常用试剂(甲醇、吉姆萨等)均购于广州豪凯生物科技有限公司。细胞培养板和培养瓶购于美国康宁公司;23EX医用直线加速器购于美国Varian公司;ELX800酶标仪购于美国Bio-Tek公司;FACS CantoⅡ流式细胞仪购于美国Bio-Rad公司。
1.2 放射处理条件 室温照射;源皮距(SSD)100 cm;照射视野面积15 cm×15 cm;剂量率3 Gy/min;板底面覆盖1.5 cm厚的等效组织填充物。
1.3 细胞培养 SW579细胞购于上海纪宁生物科技有限公司,将SW579细胞培养于L-15完全培养基中(含10%胎牛血清、100 U/mL青霉素和链霉素),置于37 ℃、5% CO2饱和湿度的细胞培养箱中培养。
1.4 细胞分组 将对数生长的SW579细胞,用胰蛋白酶消化为单细胞悬液,设为对照组、加药组、照射组、联合组。加药组用25 μmol/L白藜芦醇处理,对照组细胞不做任何处理;照射组用2 Gy X射线照射细胞;联合组用25 μmol/L白藜芦醇和2 Gy X射线照射处理。
1.5 MTT实验检测白藜芦醇对SW579细胞的毒性 取对数生长期SW579细胞,胰蛋白酶消化处理,用含有10%胎牛血清的完全培养基终止消化,制备细胞悬液,密度为3×104/mL,以每孔100 μL接种至96孔板中,继续培养,细胞贴壁后,将培养基更换为0、12.5、25、50、100 μmol/L白藜芦醇,细胞培养24、48、72 h后,每孔加入MTT溶液10 μL,然后每孔加入Formanzan溶解液,37 ℃振荡15 min,使结晶紫溶解,在570 nm波长处酶标仪检测各孔吸光度,并计算细胞存活率。对照组、加药组、照射组、联合组细胞按上述方法检测细胞存活率。
1.6 克隆形成实验检测白藜芦醇对SW579细胞辐射增敏作用 取对数生长期的SW579细胞,胰蛋白酶消化处理,用含有10%胎牛血清的完全培养基终止消化,制备细胞悬液,密度为3×104/mL,以每孔100 μL接种至96孔板中,继续培养,细胞贴壁后,将各孔用浓度为0、25 μmol/L白藜芦醇处理细胞,每组设置5个平行孔,24 h后给予0、1、2、4 Gy X射线照射,继续培养1 d后,更换新鲜培养基,置于上述培养环境下继续培养10~14 d,每隔3 d更换1次新鲜培养液,直至生成肉眼可见的细胞克隆为止。弃去培养基,PBS清洗3次,2 mL甲醇室温固定10 min,弃去甲醇,等量吉姆萨染色液染色 30 min,在低倍光学显微镜下计数>50个细胞的集落。克隆形成率(planting efficiency,PE)=(克隆数/接种细胞数)×100%,存活分数(survial fraction,SF)=照射剂量组的集落数/(该组细胞接种数×未照射组PE)。采用单击多靶模型拟合细胞存活曲线,SF=1-[(1-e-D/D0)×N],Dq=D0×lnN。其中D为照射剂量(Gy),D0为平均致死剂量,Dq为准阈剂量(代表存活的宽肩度),N为外推值。放射增敏比(sensitization enhancement ratio,SER)=单纯照射组D0/联合照射组D0。
1.7 蛋白免疫印记实验 将对照组、加药组、照射组、联合组细胞离心,取细胞沉淀置于冰上,加适量细胞裂解液(1 mL RIPA裂解液加10 μL蛋白酶抑制剂,现配现用)冰上裂解30 min,4 ℃离心取上清,用BCA蛋白定量试剂盒进行蛋白浓度测定,取20 μg蛋白进行SDS-PAGE的凝胶电泳,将蛋白转至PVDF膜上,用5%脱脂奶粉于4 ℃条件下过夜封闭,PBST洗涤3次,加入相应的一抗,4 ℃孵育过夜,PBST洗涤3次,37 ℃孵育二抗1 h,PBST洗涤3次,将配置好的ECL显色液加至膜上,在化学发光凝胶成像系统中显影,PVDF膜再利用,用一抗、二抗去除液将PVDF膜上的抗体去除,重新封闭、孵育新的一抗、二抗,检测其他蛋白。
1.8 流式细胞仪检测细胞周期 对照组、加药组、照射组、联合组细胞培养48 h后收集细胞,并制备单细胞悬液,加入3 mL预冷的70%乙醇固定,用缓冲液洗涤后加入核糖核酸酶A(RNase A)于37 ℃水浴30 min,加入碘化啶(PI),避光30 min,上机检测,重复3次。用流式细胞仪和DNA细胞周期分析软件对细胞周期进行检测分析。
1.9 流式细胞术检测细胞凋亡 对照组、加药组、照射组、联合组细胞培养48 h后用预冷的PBS漂洗2次,与500 μL结合缓冲液混匀。先加入10 μL Annexin V-FITC,再加入5 μL PI,混匀后避光孵育10 min。用流式细胞仪检测细胞凋亡率。每组设3个复孔,实验重复3次。

2 结果
2.1 白藜芦醇对SW579细胞的细胞毒性检测 用不同浓度(0、12.5、25、50、100 μmol/L)的白藜芦醇处理SW579细胞,于24、48、72 h时用MTT法检测SW579细胞的存活率,结果见表1。由此可知,25 μmol/L白藜芦醇在72 h内是对SW549细胞没有细胞毒性的最大浓度,因此后续实验均采用该浓度白藜芦醇作为辐射增敏实验的最佳药物浓度。
表1 不同浓度白藜芦醇作用不同时间对SW579细胞存活率的影响
2.2 白藜芦醇对SW579细胞的辐射增敏作用 用不同剂量(0、1、2、4 Gy)的X射线照射及25 μmol/L白藜芦醇处理SW579细胞,采用克隆形成实验研究白藜芦醇对SW549细胞的辐射增敏作用,见图1,发现白藜芦醇处理SW579细胞后,2、4 Gy剂量射线照射后细胞克隆形成数降低(P<0.01);与对照组比较,加药组细胞用0、1、2、4 Gy X射线照射后,2、4 Gy剂量射线照射后细胞存活分数降低(P<0.01),表明白藜芦醇对SW579细胞有明显的辐射增敏作用,见表2。最终,选择2 Gy剂量射线进行后续实验。
注:与0 μmol/L白藜芦醇组比较,**P<0.01。图1 白藜芦醇对SW579细胞克隆形成的影响
表2 不同剂量射线干预后各组细胞存活分数(SF)值
2.3 白藜芦醇对X射线照射后SW579细胞增殖的影响 将细胞分为对照组、加药组(25 μmol/L白藜芦醇)、照射组(2 Gy X射线)、联合组(25 μmol/L白藜芦醇和2 Gy X射线),分别于24、48、72 h用MTT法检测SW579细胞的活力,见图2A。结果显示,与对照组比较,照射组和加药组的细胞活力均降低(P<0.05);与照射组比较,联合组SW579细胞的存活率降低(P<0.01)。Western blot检测48 h后对照组、加药组、照射组和联合组细胞中Ki67蛋白表达,分别为1.00±0.05、0.46±0.03、0.51±0.04、0.13±0.01,与对照组比较,照射组和加药组细胞中Ki67蛋白表达均降低(P<0.01);与照射组比较,联合组SW579细胞中Ki67蛋白表达降低(P<0.01),见图2B。

注:与对照组比较,**P<0.01;与照射组比较,##P<0.01。图2 白藜芦醇对SW579细胞增殖的影响
2.4 白藜芦醇对X射线照射后SW579细胞周期的影响 由表3可见,与对照组比较,加药组和照射组的SW579细胞周期发生变化,G0/G1期细胞减少(P<0.01),S期细胞增加(P<0.01),G2/M期细胞减少(P<0.01);与照射组比较,联合组细胞周期阻滞更显著,G0/G1期细胞减少(P<0.01),S期细胞增加(P<0.01),G2/M期细胞减少(P<0.01),表明白藜芦醇和X射线联合作用抑制细胞周期行进的作用更为显著。
2.5 白藜芦醇对X射线照射后SW579细胞凋亡的影响 由图3可见,流式细胞术检测对照组、加药组、照射组和联合组细胞的细胞凋亡率分别为(8.56±0.72)%、(14.24±1.06)%、(15.37±1.34)%、(20.14±1.85)%,与对照组比较,加药组和照射组细胞凋亡率均增加(P<0.01);与照射组比较,联合组细胞凋亡率增加(P<0.05)。
表3 白藜芦醇联合射线对细胞周期的影响
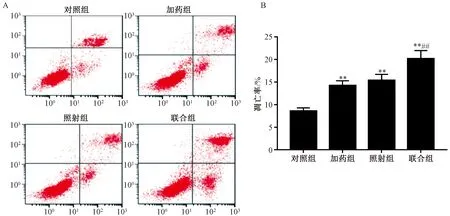
注:与对照组比较,**P<0.01;与照射组比较,##P<0.01。图3 白藜芦醇联合X射线对SW579细胞凋亡的影响
2.6 白藜芦醇对X射线照射后SW579细胞中Survivin、ATM和NBS1表达的影响 Western blot检测48 h对照组、加药组、照射组、联合组细胞中Survivin、ATM和NBS1表达情况,见图4。Survivin蛋白表达量分别为1.00±0.02、0.67±0.04、0.54±0.02、0.39±0.02,ATM蛋白表达量分别为1.00±0.05、0.63±0.03、0.55±0.05、0.41±0.04,NBS1蛋白表达量分别为1.00±0.03、0.58±0.05、0.56±0.03、0.27±0.02。与对照组比较,加药组和照射组中Survivin、ATM、NBS1蛋白表达均降低(P<0.01);与照射组比较,联合组中Survivin、ATM、NBS1蛋白表达降低(P<0.01),表明白藜芦醇联合X射线抑制SW579细胞Survivin、ATM和NBS1的表达。

注:对照组比较,**P<0.01;与照射组比较,##P<0.01。图4 SW579细胞中Survivin、ATM和NBS1表达
3 讨论
甲状腺癌是一种重要的内分泌肿瘤,单纯使用放射治疗方法不仅不能有效杀死癌细胞,还会对正常的组织和细胞造成一定危害。辐射增敏剂[9]可通过增加甲状腺癌细胞的辐射敏感性进而提高放射治疗疗效,从而达到杀死癌细胞的目的。但当前的辐射增敏剂不仅造价高,且对正常组织细胞的毒副作用也较大,因此,研发和找到药效强、造价低的辐射增敏剂对提高甲状腺癌的放射治疗疗效具有重要意义。
白藜芦醇是从葡萄等植物中提取一种小分子化合物,具有防癌和抗癌的作用,可增加化学治疗药物的敏感性以及可增加辐射诱导的细胞凋亡[10-12],因此白藜芦醇可能具有辐射增敏作用,临床研究表明正常使用富含白藜芦醇的食物不仅能发挥其生理活性,而且具有一定安全性[13],这也为白藜芦醇成为潜在的辐射增敏剂提供了科学依据。本研究检测了不同剂量的白藜芦醇对甲状腺癌细胞SW579的细胞毒性作用,结果发现,在72 h内,白藜芦醇对甲状腺癌细胞SW579的无毒性最高剂量为25 μmol/L。为了观察白藜芦醇对射线照射后甲状腺癌细胞SW579增殖的影响,本研究首先用25 μmol/L白藜芦醇及不同剂量的X射线照射处理SW579细胞,克隆形成实验结果显示,与对照组比较,白藜芦醇可降低照射组细胞的克隆形成率和细胞存活分数。接着,采用25 μmol/L白藜芦醇和2 Gy剂量射线处理SW579细胞,将其分为对照组、照射组、加药组和联合组,检测细胞增殖状况,MTT结果显示,与放射组比较,白藜芦醇和X射线联合使用可降低细胞存活率。Ki67[14-15]是与细胞增殖密切相关的蛋白,Western blot检测结果发现,与单纯放射组比较,Ki67在联合组SW579细胞中的表达降低,进一步表明藜芦醇可通过参与调控与细胞增殖相关的分子机制进而抑制SW579细胞的增殖,白藜芦醇对SW579细胞能够发挥明显的辐射增敏作用,具有成为辐射增敏剂的潜力。
放射增敏机制主要是通过影响细胞周期、促进肿瘤细胞凋亡和增加射线对肿瘤细胞的原发性损伤等生物学过程发挥作用的。细胞在接受射线照射后其细胞周期会发生改变,还可影响细胞凋亡[16]。为了研究白藜芦醇的放射增敏机制,用流式细胞术分析SW579细胞的细胞周期和凋亡情况。结果发现,与对照组比较,照射组和加药组SW579细胞周期发生变化,G0/G1期比例降低,S期比例增加,且细胞凋亡率增加;而与照射组比较,联合组中差异更为显著,表明白藜芦醇可加强X射线对SW579细胞周期的调控作用,以及可增加X射线诱导的细胞凋亡,表明白藜芦醇可通过改变细胞周期和促进细胞凋亡增加放射敏感性。Survivin[17]是一种作用极强的凋亡抑制蛋白,可抑制细胞凋亡,参与细胞周期调控[18],NBS1[19]是DNA损伤修复蛋白,ATM[20]是与细胞周期调控和DNA损伤修复密切相关的蛋白,可作为细胞“生存因子”降低细胞对放射线和类射线细胞毒药物的敏感性。为了进一步探讨白藜芦醇促进细胞凋亡和改变细胞周期的机制。在后续研究中,通过Western blot检测Survivin、NBS1和ATM的表达,结果发现,与对照组比较,放射组和加药组细胞中Survivin、NBS1和ATM表达均降低;与照射组比较,联合组中蛋白表达差异更为显著,白藜芦醇加强了X射线对Survivin、NBS1和ATM表达的抑制作用。
综上所述,本研究初步探讨了白藜芦醇作为甲状腺瘤放射增敏剂的潜能,并进一步分析了白藜芦醇放射增敏的分子机制,白藜芦醇可增加SW579细胞对射线的敏感性,为临床上开发白藜芦醇作为甲状腺瘤放射增敏剂提供了科学依据。
