玉泉丸对糖尿病肾病大鼠GSK-3β/Nrf2通路及YKL-40表达的影响
2022-01-27贾崇高唐英骞
陈 烨, 贾崇高, 唐英骞, 王 昱
(贵州医科大学附属医院肾内科,贵州 贵阳 550004)
糖尿病肾病是糖尿病最常见的并发症之一,约50%的患者会被最终确诊[1],它也是导致终末期肾衰竭的主要原因[2]。玉泉丸是由葛根、天花粉、地黄、麦冬、五味子、甘草组成的中成药,具有养阴生津、止渴除烦、益气和中等功效,能降低2型糖尿病患者血清肿瘤坏死因子(TNF-α)和白细胞介素-6(IL-6)水平,减轻炎症反应[3]。
肾小球内皮损伤是引起炎症反应及糖尿病肾病发生和发展的重要特征[4],几丁质酶-3样蛋白-1(chtinase-3-like protein-1,YKL-40)在多种炎症疾病中高表达,被公认为早期诊断糖尿病肾病的潜在生物标志物[5]。细胞核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)是内源性抗氧化反应的主要调节因子[6],锌可通过上调Nrf2及其下游因子蛋白表达和糖原合酶激酶-3β(glycogen synthase kinase-3β,GSK-3β)磷酸化水平延缓糖尿病肾病的发展[7]。目前,玉泉丸对大鼠GSK-3β/Nrf2通路及肾小球内皮损伤标志物YKL-40表达的影响尚无报道,故本研究采用高脂高糖饲料喂养结合一次性腹腔注射链脲佐菌素(streptozotocin,STZ)制备大鼠糖尿病肾病模型,研究该制剂对GSK-3β/Nrf2通路及肾小球内皮损伤标志物YKL-40表达的影响,为其临床相关治疗提供理论依据。
1 材料
1.1 动物 健康SPF级SD大鼠(雄性,体质量200~220 g,6~8周龄)购自贵州医科大学实验动物中心,动物生产许可证号SCXK(黔)2018-0001,符合国家实验室动物伦理保护标准及相关法律规定,按照3R原则给予人道的关怀照顾。实验前于12 h/12 h光暗循环、温度20~25 ℃、相对湿度60%~70%条件下,单笼、普通饲料适应性饲养1周。
1.2 药物 玉泉丸购自成都九芝堂金鼎药业有限公司(0.15 g/丸,国药准字Z51021085,批号20191209),与生理盐水配制成质量浓度为0.4、0.8、1.2 g/mL的混悬液。盐酸二甲双胍片购自中美上海施贵宝制药有限公司(0.5 g/片,国药准字H20023370,批号20200327),与生理盐水配制成质量浓度为5 mg/mL的混悬液。
1.3 试剂和仪器 大鼠YKL-40、内皮素(endothelin,ET)酶联免疫吸附(ELISA)试剂盒购自上海江莱生物科技有限公司,批号分别为2396-40、256353-34;TNF-α、IL-6、超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、丙二醛(malondialdehyde,MDA)ELISA试剂盒均购自上海酶联生物科技有限公司,批号分别为ml821037、ml005039-C、ml510373、ml148201、ml053049-J;苏木素-伊红(HE)染色试剂盒、蛋白提取试剂盒均购自北京索莱宝生物科技有限公司,批号分别为BC4705、BC4913;STZ(纯度>98%)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、β-actin鼠抗均购自美国Sigma公司,批号分别为L2817、L2910、L3015;ECL显色试剂盒和BCA蛋白定量试剂盒均购自北京中杉金桥生物技术有限公司,批号分别为ZA-0211、ZA-0614;磷酸化GSK-3β(p-GSK-3β)、GSK-3β、Nrf2鼠抗和辣根过氧化物酶标记羊抗鼠IgG二抗均购自英国Abcam公司,批号分别为ab50163、ab50227、ab30549、ab1003。CL-7000型全自动生化分析仪购自日本岛津公司;尼康SMZ745型光学显微镜购自于上海普赫生物科技有限公司;Fax-2100型酶标仪购自美国INStat公司;ChemiDoc-MP型凝胶成像分析系统购自山东三瑞科技有限公司;1704150型转膜仪、CHEF Mapper XA型电泳仪均购自美国Bio-Rad公司。
2 方法
2.1 建模、分组与给药 大鼠经适应性喂养1周后,选取健康、状态良好、血糖正常者,采用Zhao等[8]报道的方法制备糖尿病肾病模型,随机分为造模组(54只)和正常组(10只),造模组大鼠高脂高糖饲料喂养8周后,一次性腹腔注射STZ(65 mg/kg,STZ溶于0.1 mol/L、pH 4.5柠檬酸盐缓冲液中),继续使用高脂高糖饲料喂养;正常组大鼠普通饲料喂养8周后,注射等体积柠檬酸盐缓冲液,继续使用普通饲料喂养。连续喂养4周后,检测大鼠尿量及尿蛋白排泄率,糖尿病造模成功标准为腹腔注射STZ 72 h后,静脉血糖高于16.7 mmol/L;糖尿病肾病造模成功标准为尿量>原尿量150%,尿蛋白排泄率>30 mg/24 h[9]。54只造模组大鼠中死亡1只,未造模成功3只,将造模成功的50只再随机分为模型组,玉泉丸低、中、高(4、8、12 g/kg)剂量组[10]和二甲双胍(50 mg/kg)组[11](阳性对照),各组灌胃给予对应剂量药物,正常组和模型组灌胃给予生理盐水,灌胃容量均为10 mL/kg,每天1次,连续21 d。
2.2 大鼠生化指标检测 末次给药结束后收集大鼠24 h尿液,腹腔注射3%戊巴比妥钠(50 mg/kg)深度麻醉以实施安乐死,采集静脉血约10 mL,其中5 mL于3 000 r/min离心5 min后取血清(剩余5 mL置于-80 ℃冰箱中,用于后续ELISA检测),采用免疫透射比浊法,通过全自动生化分析仪检测血糖、甘油三酯、总胆固醇、肌酐、尿素、24 h尿微量白蛋白水平。
2.3 HE染色观察大鼠肾组织病理学变化 大鼠实施安乐死后摘取双肾,迅速将右侧肾组织置于4%多聚甲醛中固定,而左侧肾组织置于-80 ℃冰箱中,用于后续ELISA和蛋白免疫印迹(Western blot)检测,组织脱水,石蜡包埋,切片机切成5 μm薄片,按照HE染色试剂盒说明书进行染色,梯度乙醇脱水、二甲苯透明、中性树胶封片后在光学显微镜下观察肾组织病理学变化。根据发生病变肾小管和肾小球(肾小球萎缩,肾小管出现胞浆脱落及管腔扩张,间质区出现炎性细胞浸润)所占总肾小管和肾小球的比例进行评分[12],未发生病变计为0分,病变面积<25%计为1分,病变面积≥25%但<50%计为2分;病变面积≥50%但<75%计为3分;病变面积≥75%计为4分。
2.4 ELISA检测大鼠血清YKL-40、TNF-α、IL-6、ET水平 取“2.2”项下-80 ℃冰箱保存的大鼠血液,低温融化,4 ℃、13 000 r/min离心15 min,严格按照相关试剂盒说明书操作方法检测YKL-40、TNF-α、IL-6、ET水平,平行6次。
2.5 ELISA检测大鼠肾组织SOD、CAT活性和MDA水平 取“2.3”项下-80 ℃冰箱保存的大鼠肾组织,于冰台上用生理盐水制成组织匀浆,4 ℃、3 500 r/min离心15 min后取组织上清液,严格按照相关试剂盒说明书操作方法,采用酶标仪检测SOD、CAT活性和MDA水平。
2.6 免疫组织化学法检测大鼠肾组织YKL-40表达 将“2.3”项下大鼠肾组织切片,常规脱蜡至水,0.01 mmol/L枸橼酸缓冲液(pH 6.0)高温修复抗原,3%双氧水灭活内源性过氧化物酶,加入YKL-40鼠抗(1∶150),37 ℃孵育30 min后4 ℃过夜,加入辣根过氧化物酶标记的二抗(1∶100),ECL试剂盒显色5~20 min后在光学显微镜下观察,随机选取5个肾小球视野,采用Image-Pro Plus 6.0软件分析棕黄色颗粒部分面积占视野总面积的比值,即为YKL-40阳性表达指数值(positive index,PI)。
2.7 Western blot法检测大鼠肾组织GSK-3β、p-GSK-3β、Nrf2蛋白表达 取“2.3”项下-80 ℃冰箱保存的大鼠肾组织,蛋白提取试剂盒提取总蛋白,BCA蛋白定量试剂盒定量,取50 μg样品进行SDS-聚丙烯酰胺凝胶电泳,转聚偏二氟乙烯膜,抗体封闭,1∶2 000稀释后的GSK-3β、p-GSK-3β、Nrf2、β-actin鼠抗4 ℃过夜孵育,添加含辣根过氧化物酶缀合的二抗(1∶5 000)室温孵育2 h,ECL显色试剂盒显色,凝胶成像分析系统拍照,以β-actin为内参检测蛋白表达,平行3次。
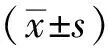
3 结果
3.1 玉泉丸对大鼠生化指标的影响 与正常组比较,模型组大鼠血糖、甘油三酯、总胆固醇、肌酐、尿素、24 h尿微量白蛋白水平升高(P<0.01);与模型组比较,玉泉丸低、中、高剂量组和二甲双胍组大鼠血糖、甘油三酯、总胆固醇、肌酐、尿素、24 h尿微量白蛋白水平降低(P<0.01),见表1。
3.2 玉泉丸对大鼠肾组织病理学变化的影响 与正常组比较,模型组大鼠肾小球直径缩小,系膜区基质增多,肾小管出现不同程度的空泡样变性和胞浆脱落,部分可见肾小管管腔,间质区出现大量炎性细胞浸润,肾组织病理学评分升高(P<0.01);与模型组比较,玉泉丸低、中、高剂量组和二甲双胍组大鼠肾小球直径增大,系膜基质增生减轻,肾小管损伤趋于修复,炎性细胞浸润减少,肾组织病理学评分降低(P<0.01),见图1、表2。

表1 各组大鼠生化指标

注:蓝色箭头表示肾小球萎缩,黑色箭头表示肾小管胞浆脱落及管腔扩张,黄色箭头表示间质炎性细胞浸润。图1 各组大鼠肾组织病理变化(×400)Fig.1 Renal tissue histopathological changes of rats in various groups (×400)
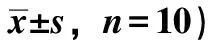
表2 各组大鼠肾组织病理评分(分,
3.3 玉泉丸对大鼠血清YKL-40、TNF-α、IL-6、ET水平的影响 与正常组比较,模型组大鼠血清YKL-40、TNF-α、IL-6、ET水平升高(P<0.01);与模型组比较,玉泉丸低、中、高剂量组和二甲双胍组大鼠血清YKL-40、TNF-α、IL-6、ET水平降低(P<0.01),见表3。
3.4 玉泉丸对大鼠肾组织SOD、CAT活性及MDA水平的影响 与正常组比较,模型组大鼠肾组织SOD、CAT活性降低(P<0.01),MDA水平升高(P<0.01);与模型组比较,玉泉丸低、中、高剂量组和二甲双胍组大鼠肾组织SOD、CAT活性升高(P<0.01),MDA水平降低(P<0.01),见表4。

表3 各组大鼠血清YKL-40、TNF-α、IL-6、ET水平
3.5 玉泉丸对大鼠肾组织YKL-40表达的影响 与正常组比较,模型组大鼠肾组织YKL-40阳性表达指数升高(P<0.01);与模型组比较,玉泉丸低、中、高剂量组和二甲双胍组大鼠肾组织YKL-40阳性表达指数降低(P<0.01),见图2、表5。

表4 各组大鼠肾组织SOD、CAT活性及MDA水平

图2 各组大鼠肾组织YKL-40表达(×400)Fig.2 Renal tissue YKL-40 expressions in rats in various groups (×400)

表5 各组大鼠肾组织YKL-40表达阳性指数
3.6 玉泉丸对大鼠肾组织p-GSK-3β/GSK-3β和Nrf2蛋白表达的影响 与正常组比较,模型组大鼠肾组织p-GSK-3β/GSK-3β和Nrf2蛋白表达降低(P<0.01);与模型组比较,玉泉丸低、中、高剂量组和二甲双胍组大鼠肾组织p-GSK-3β/GSK-3β和Nrf2蛋白表达升高(P<0.01),见图3、表6。

注:A为正常组,B为模型组,C为玉泉丸低剂量组,D为玉泉丸中剂量组,E为玉泉丸高剂量组,F为二甲双胍组。图3 各组大鼠肾组织GSK-3β、Nrf2蛋白表达Fig.3 Renal tissue protein expressions of GSK-3β and Nrf2 in rats in various groups
4 讨论
玉泉丸在临床上适用于治疗因胰岛素功能减退而引起的物质代谢、碳水化合物代谢紊乱,消渴症、肺胃肾阴亏虚、热病后期等病症[13]。本研究发现,玉泉丸降低糖尿病肾病大鼠TNF-α、IL-6、MDA水平,继而减少肾组织间质区炎性细胞浸润,并呈剂量依赖性地降低糖尿病肾病大鼠血糖和血脂水平,提高肾组织SOD和CAT活性,这些变化伴随着糖尿病肾病大鼠24 h尿微量白蛋白的减少、肾功能的改善以及肾组织损伤的缓解,与彭聪等[14]报道在2型糖尿病肾病患者中玉泉丸所发挥的肾脏保护机制一致,表明玉泉丸可通过降低血糖血脂、炎性因子浸润及氧化应激反应,从而减少肾组织损伤,改善肾功能。

表6 各组大鼠肾组织p-GSK-3β/GSK-3β、Nrf2蛋白表达
长期高糖会产生血管病变,进而引起血管损伤,YKL-40在糖尿病肾病中发挥重要作用[15]。在本研究中,糖尿病肾病大鼠模型YKL-40和ET水平升高,伴随着肾小球直径缩小、系膜区基质增多,肾小管出现不同程度的空泡样变性和胞浆脱落,使肾组织病理学评分升高。随着玉泉丸剂量的升高,YKL-40和ET水平依次降低;肾组织损伤逐渐减轻,肾组织病理学评分逐渐降低,推测玉泉丸减少肾组织损伤,改善肾功能可能与糖尿病肾病大鼠肾小球内皮损伤标志物YKL-40水平紧密相关。
糖尿病肾病由多种因素相互作用引起,包括炎症介质、致纤因子、氧化应激和细胞凋亡等[16]。本研究发现,模型组大鼠p-GSK-3β/GSK-3β和Nrf2蛋白表达降低,提示GSK-3β/Nrf2通路在糖尿病肾病大鼠模型中处于抑制状态,与Yu等[17]研究发现高糖诱导的心肌细胞中,p-GSK-3β和Nrf2蛋白表达下调,心肌细胞受损的研究结果具有一致性。激活GSK-3β/Nrf2抗氧化途径可减轻糖尿病肾病引起的肾损伤[18],Nrf2的上调参与非诺贝特对1型糖尿病肾病小鼠的肾脏保护作用[19]。Feng等[20]研究发现右美托咪定可通过激活GSK-3β/Nrf2信号通路抑制炎症和氧化应激,改善脂多糖诱导的大鼠急性肾损伤。本研究发现玉泉丸能提高p-GSK-3β/GSK-3β和Nrf2蛋白表达,且呈剂量依赖性,与上述研究结果一致,因此推测玉泉丸可能通过激活GSK-3β/Nrf2通路,降低肾小球内皮损伤标志物YKL-40水平,减轻氧化应激和炎症反应。
综上所述,在STZ诱导的糖尿病肾病大鼠模型中,玉泉丸可有效降低肾小球内皮损伤标志物YKL-40表达,降低血糖和血脂,减轻氧化应激和炎症反应,改善肾功能,可能与激活GSK-3β/Nrf2通路有关,可为相关临床治疗提供参考。
