以TGase催化交联鱼皮明胶为壁材制备罗伊氏乳杆菌微胶囊工艺
2022-01-27郭帅玲张钰龙廖嘉婧巫小丹付桂明
郭帅玲,张钰龙,廖嘉婧,徐 进,巫小丹,万 茵,付桂明,b*
(南昌大学a.食品科学与技术国家重点实验室,江西 南昌 330047;b.国际食品创新研究院,江西 南昌 330000)
罗伊氏乳杆菌(Lactobacillusreuteri)作为一种内源性乳酸菌,主要存在于脊椎动物和哺乳动物胃肠道内,是应用最广的益生乳酸菌之一[1]。但L.reuteri在热干燥加工及贮藏过程中,菌体活性随时间的延长大幅降低,严重影响其益生作用。喷雾干燥微胶囊包埋技术是对乳酸菌的一种保护技术,可在活菌表面形成一层半透性或密封的囊膜,构成微胶囊,在特定条件下将内部包埋的菌体释放[2],从而增强乳酸菌对环境的抵抗力,显著提升菌体存活率,使其在肠道中定殖,充分发挥乳酸菌益生功能的作用[35]。喷雾干燥法包埋乳酸菌相比于冷冻干燥,包埋率更高,粒径大小更均匀,氧化稳定性更好,故喷雾干燥法是更优的制备微胶囊的干燥技术[6]。鱼皮明胶作为一种新型壁材,因其具有良好的生物相容性、生物降解性和低免疫原性等特性,广泛应用于制备可食性膜和食品表面涂层等方面。
谷氨酰胺转氨酶(Transglutaminase,TGase)可催化蛋白质分子中谷氨酰胺残基和赖氨酸残基,形成ε-(γ-谷氨酸)赖氨酸共价键,在分子内或分子间产生交联,提高凝胶强度和成胶性能。姜燕[12]等研究了TGase分别处理大豆分离蛋白(SPI1和SPI2),酪蛋白酸钠(NaCN1和NaCN2)及明胶(G1和G2)可改善3类蛋白质膜的抗拉强度和表面疏水性。Wang[24]等采用MTGase与酪氨酸酶催化明胶-壳聚糖偶联反应,两种酶共同作用,提高了明胶-壳聚糖双酶改性材料在水介质中的稳定性。
本文通过TGase对鱼皮明胶进行交联改性,使得明胶α-螺旋相对含量增加,并保留更多的分子内氢键,增强了肽链间相互作用力,提高其成膜性能,复配麦芽糊精制备壁材,采用喷雾干燥法进行壁材包埋L.reuteri微胶囊,并进行喷雾干燥单因素和响应面优化实验,确定最优喷雾干燥工艺参数,为生产提供一种低成本,活菌存活率高的L.reuteriNCUF 203.1微胶囊产品提供技术指导。
1 材料与方法
1.1 材料及仪器
主要材料:B型鱼皮明胶购于上海鑫汐生物科技有限公司(中国上海市);TGase购自江苏省一鸣生物有限公司(中国江苏省);L.reuteriNCUF 203.1是实验室保存菌株(MRS斜面培养基,37 ℃静置培养)
主要仪器:B-290小型喷雾干燥机(瑞士步琦有限公司)、MCR302流变仪(上海安东帕商贸有限公司)、ZDX-35BI立式蒸汽灭菌锅(上海申安医疗器械有限公司)、TG16-WS冷冻高速离心机(上海卢湘仪离心机仪器有限公司)
1.2 实验方法
1.2.1 鱼皮明胶TGase催化交联改性制备L.reuteri微胶囊壁材
按照鱼皮明胶与麦芽糊精溶液(混合比例为3:7)混合均匀,调节溶液pH值为7.0,加入TGase(20 U/g鱼皮明胶),在40 ℃催化交联反应90 min,反应结束后100 ℃加热5 min,进行灭酶,不加TGase作为空白对照组。
1.2.2L.reuteri微胶囊壁材溶液性质分析
TGase催化的交联度测定采用Caterina[7]方法测定,用%表示;壁材溶液的乳化性能采用Xin[8]实验方法;壁材溶液的起泡性能采用Cokun Z[9]实验方法。
1.2.3L.reuteri微胶囊的制备
1.2.3.1 浓缩菌液的制备
L.reuteri经过MRS平板37 ℃培养48 h后,挑单菌落于5 mL MRS液体培养基中,并在37 ℃下培养12 h,然后转接到100 mL MRS液体培养基中进一步扩大培养24 h后,将处于对数期后期的菌液,在4 ℃离心后弃上清液,以无菌生理盐水洗涤两次,菌体重新悬浮于生理盐水中得到浓缩菌液(1011 CFU/mL),最后利用平板计数法对该菌液精确计数。
1.2.3.2 喷雾干燥制备微胶囊
将1.2.1所制备的交联溶液与浓缩菌液按照一定比例混合均匀,分别设置进口温度、进料流量和菌壁比不同参数进行喷雾干燥。干燥结束后,立即将制备得到的TG-FSG-M(经TGase交联处理的壁材)包埋的微胶囊收集于无菌密封玻璃瓶中,于4 ℃储存。以FSG-M(不添加TGase的鱼皮明胶溶液)为对照组。
1.2.3.3 不同喷雾干燥条件的单因素实验
分别设置进风温度(100 ℃,110 ℃,120 ℃,130 ℃,140 ℃),进料流量(1.5,3,6,9,12 mL·min-1)和菌壁比(0.02,0.1,0.2,0.5,1)不同参数进行喷雾干燥三个因素分别进行单因素实验,每组重复3次,来优化喷雾干燥工艺。
1.2.4 响应面法优化喷雾干燥微胶囊活菌数
以L.reuteri微胶囊的包埋活菌数为响应值,根据单因素的实验结果,采用Box-Benhnken的中心组合试验设计原理,TG-FSG-M包埋,选择进风温度、进料流量、菌壁比这3个因素进行响应面分析实验,每组实验重复3次,取平均值。
设计的响应面因素水平编码如下表所示。
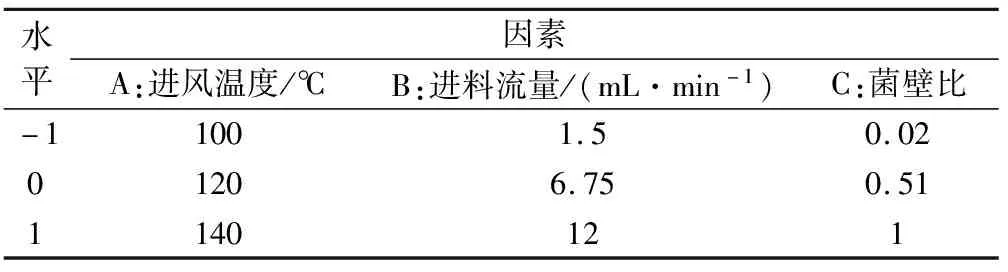
表1 响应面法因素水平编码表
1.2.5 微胶囊活菌数的测定
采用活菌计数法测定[10]。
1.2.6 微胶囊水分含量的测定
采用水分含量测定仪测定,用%表示[11]。
1.3 数据统计与分析
每组实验设定3个平行样本,利用Design Expert 8.0设计以及分析数据,Excel 2016计算平均值及偏差,SPSS 25进行数据显著性分析,Origin 2018作图。
2 结果与分析
2.1 TGase催化鱼皮明胶的溶液性质
由表2可知随着TGase催化鱼皮明胶的交联时间延长,鱼皮明胶的交联度逐渐升高,当交联时间为90 min时,其交联度为15.45%,出现这种现象的原因可能是因为TGase的加入使得鱼皮明胶分子中的赖氨酸和谷氨酰胺发生交联反应后使得鱼皮明胶溶液中的氨基总浓度降低,与试剂反应的化合物减少,吸光度降低导致的,这与姜燕[12]等人的研究结果一致。史莹[13]研究发现,TGase交联两种牛乳酪蛋白后,其交联度分别增加,这与本文所研究的结果一致。TGase因其可以修饰强化蛋白质的结构稳定性,并能改善其控释性能,在微胶囊包埋益生菌领域具有良好的应用[14]。
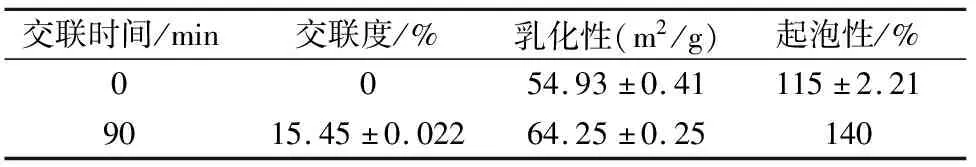
表2 TGase催化鱼皮明胶的交联时间对其交联度的影响
2.2 TGase交联鱼皮明胶对壁材溶液的乳化性能的影响
由表2可知随着TGase交联鱼皮明胶交联度的升高,壁材溶液的乳化性呈现先升高再降低的趋势,且当交联度为15.45%时,乳化性为64.25 m2/g,较未交联的提高了14.5%;乳化性较高可显著降低壁材溶液的油-水界面的张力,减少溶液不稳定和液滴凝聚现象,是壁材有效包裹芯材的前提条件。Petruccelli[15]研究发现TGase将赖氨酸上的氨基和谷氨酰胺上的羟酰胺基结合,减少了自由氨基的量,导致明胶分子的疏水性增加,增强了了疏水基团与油的相互作用,乳化性增加。刘颖[16]在研究TGase改善大豆11S蛋白聚合的条件时发现,经过TGase交联改性后大豆11S蛋白的乳化性从30.27%提高至61.15%;Hu X[17]研究发现采用TGase交联花生分离蛋白时发现TGase处理形成聚合物可改善乳化活性,这与本文研究结果相似。
2.3 TGase交联鱼皮明胶对壁材溶液起泡性的影响
由表2可知经TGase交联鱼皮明胶后,随着其交联度的增加,溶液的起泡性呈现先升高后降低的趋势,且在交联度为15.45%时起泡性最高达到140.00%,较未交联的提高了17.90%;出现这种现象的原因可能是随着TGase交联鱼皮明胶的交联程度增加使得明胶溶液的黏度增大,氨基含量减少引起静电斥力减小,使蛋白质分子之间的相互作用增强,更易于吸附到界面,导致起泡性增加。当交联度超过15.45%时,明胶溶液的黏度过大,严重影响溶液的流动性,使得起泡性降低。张晓琳[18]在研究TGase对大豆分离蛋白的起泡性时发现TGase酶量40 U/g,pH值6.0,交联温度45 ℃,交联时间2 h时起泡性较原料提高了46.66%;这与本文的研究结果相一致。
2.4 TGase交联鱼皮明胶对L.reuteri进行喷雾干燥的单因素实验结果
2.4.1 喷雾干燥包埋L.reuteri过程中不同进风温度的单因素结果
从图1可以看出,随着进风温度的提高,出风温度不断提高,采用FSG-M制备微胶囊时的出风温度显著高于TG-FSG-M;而水分和L.reuteri活菌数随进风温度的提高呈现逐渐降低的趋势,TG-FSG-M制备的微胶囊的含水量和内部的活菌数显著高于FSG-M

注:*代表显著性差异(p<0.05)。
这些结果表明TGase交联改性对提高包埋L.reuteri的活菌数有良好改善效果。出现这种现象的可能的原因是,TGase交联使鱼皮明胶分子内部的网络结构更加致密,与FSG-M微胶囊相比TG-FGS-M对热量的缓冲能力更强,对活菌的热损伤有更好的保护作用。
TG-FSG-M制备微胶囊水分含量略高于FSG-M,可能的原因是TGase交联导致壁材溶液的黏度增加,水分蒸发困难,干燥速率降低,导致水分含量升高。进风温度过低,水分受热蒸发不完全,微胶囊含水量过高,菌粉黏度大,塔内黏壁现象明显,喷雾干燥效果差、微胶囊得率低。随着进风温度的升高,出风温度不断升高,微胶囊颗粒干燥时间减少,使其较迅速地在表面形成完整且致密的微胶囊结构[19]。不同菌种的抗热性能具有一定差别,L.reuteri可在60 ℃~65 ℃的出风温度下存活,相比于其他种类乳酸菌,抗逆性较强。
进风温度为120 ℃时,出风温度为64.5 ℃±0.5 ℃时,对L.reuteri不会产生明显的热损伤,此时微胶囊水分含量为4.17%。含水量是体现微胶囊性能的一个重要指标,适当低的含水量可以保证细胞处于休眠状态,对微胶囊内L.reuteri的活性有着重要的作用。进风温度过高,料液液滴表面水分迅速蒸发,内部的水分来不及迁移到表面来补充,会引起微胶囊产品水分过低,囊壳表面开裂,热量通过裂缝进入微胶囊内部,加剧L.reuteri的活菌损失,使微胶囊化效率和产率均下降,同时,含水量太低在储存和运输过程中容易破裂,影响产品品质[20];含水量太高会引起料液结块、霉变、滋生杂菌、储存期短。因此选择进风温度120 ℃为进行下一步研究。
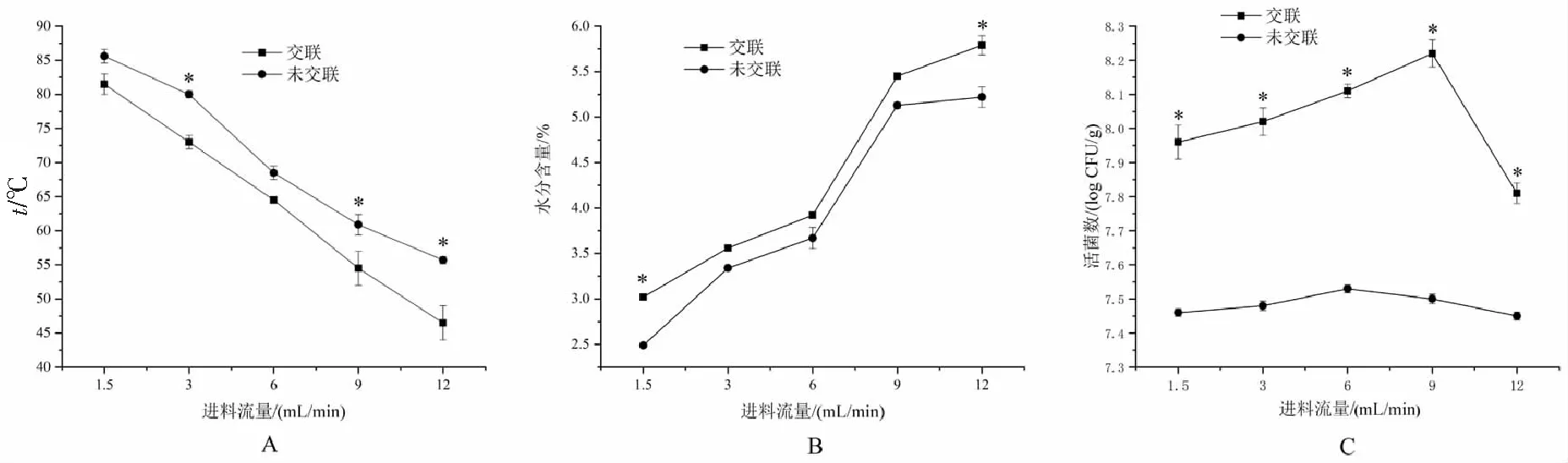
2.4.2 不同进料流量的单因素实验
从图2可以看出,随着进料流量的提高,TG-FSG-M制备微胶囊的出风温度降低,所得微胶囊中L.reuteri活菌数呈现先升高再下降的趋势;其中TG-FSG-M制备的微胶囊内部的活菌数和含水量较FSG-M微胶囊更高,而TG-FSG-M微胶囊的出风温度要显著低于FSG-M微胶囊。
注:*代表显著性差异(p<0.05)。
进料流量从1.5 mL·min-1增加到9 mL·min-1时,TG-FSG-M制备的微胶囊中的L.reuteri活菌数从7.96 log CFU/g上升到8.22 log CFU/g。这可能的原因是在喷雾干燥进风温度不变的情况下,进料流量过低,导致出风温度过高,使得活菌数减少;随着进料流量的提高,水分不断蒸发,由于汽化作用导致出风温度降低,对L.reuteri菌体的热损伤作用减弱,失活菌体数减少。但是进料流量过大,微胶囊中的水分来不及蒸发就被旋风分离器带走,导致产品中水分过高,容易粘到喷雾塔壁造成微胶囊产率下降。
Endo[21]等研究指出,乳酸菌微胶囊产品的含水量对其储存稳定性有影响,益生菌微胶囊产品的水分含量应保持在2.8%~5.0%。当进料流量增加到9 mL·min-1时,TG-FSG-M制备的微胶囊其水分含量高达5.45%,不利于长期保存。进料流量对微胶囊颗粒也有一定影响,但进料流量过大,导致微胶囊干燥效果和产品的流动性不佳,容易相互粘连[22]。因此进料流量选择6 mL·min-1进行下一步研究。
2.4.3 不同菌壁比的单因素实验
由图3可以看出,由于进风温度和进料流量不变,需要蒸发的水分量不变,吸收的汽化潜热不变,故出风温度差别不大,得到微胶囊的温度基本相同,使不同菌壁比对微胶囊水分含量的影响不大,水分含量均在5%以下,符合微生物微胶囊的储存要求。但随着菌壁比的提高,微胶囊中L.reuteri活菌数呈现先升高再下降的趋势,在菌壁比为0.5时活菌数最高为8.18 log CFU/g。采用相同体积壁材溶液喷雾干燥制备微胶囊的过程中,菌壁比较低时,单个微胶囊包埋的菌体数量较少,包埋率及存活率较低。随着菌壁比的增加,L.reuteri被壁材包埋的可能性增加,使微胶囊中L.reuteri活菌数显著增加,同时节约了壁材投料量,降低了成本。但当菌壁比超过0.5时,喷雾干燥得到的单个微胶囊中的菌体数量超出壁材最大包裹能力后,多余部分附着于壁材液滴外部,可能会破坏壁材溶液分散状态,引发乳滴聚集,降低微胶囊包埋率,对于受热易失活的L.reuteri,暴露越多受热变性越严重,故活菌数显著下降[23]。TG-FSG-M制备微胶囊中的L.reuteri为8.18 log CFU/g,比FSG-M微胶囊的活菌数提高0.58 log CFU/g,表明鱼皮明胶经过TGase交联后,壁材溶液的黏度增加,成膜性提高,包裹菌体的能力增强,因此菌壁比选择0.5比较合适。

注:*代表显著性差异(p<0.05)。
2.4.4 响应面法优化喷雾干燥制备L.reuteri微胶囊活菌数
以进风温度、进料流量、菌壁比为自变量,以TG-FSG-M包埋,利用响应面法分析优化喷雾干燥制备L.reuteri微胶囊工艺参数。
以活菌数为响应值,测定结果如下表所示:
根据Design-expert 8.0软件分析,以进风温度、进料流量、菌壁比为自变量,L.reuteri活菌数为因变量,建立的回归方程如下:
活菌数(log CFU/g)=8.48-0.39A+0.56B+0.15C-1.26A2-1.27B2-1.25C2+0.33AB+0.04AC-0.24BC
2.4.5 进风温度和进料流量对L.reuteri微胶囊活菌数的影响
由图4A可知,进风温度一定时,包埋活菌数随着进料流量的增加而增大,但当进料流量增加到一定量时,包埋活菌数随进料流量的增加而减小;进料流量一定时,进风温度变化呈现相似的变化趋势。结果表明进风温度和进料流量对L.reuteri活菌数有影响,适当的进风温度和进料流量可以使包埋活菌数达到最大。
2.4.6 进风温度和菌壁比对L.reuteri微胶囊活菌数的影响
由图4B可知,进风温度和菌壁比对L.reuteri包埋活菌数有影响。在进风温度一定时,包埋活菌数随着菌壁比的增加而增大,但当菌壁比增加到一定量时,包埋活菌数随菌壁比的增加而减小;在菌壁比一定时,进风温度变化呈现相似的趋势。这个结果表明适当的进风温度和菌壁比可以使包埋活菌数达到最大,与单因素实验的结论相吻合。
2.4.7 进料流量和菌壁比对L.reuteri微胶囊包埋活菌数的影响
由图4C可知,进料流量一定时,包埋活菌数随着菌壁比的增加而增大,但当菌壁比增加到一定量时,包埋活菌数随菌壁比的增加而减小;菌壁比一定,进料流量变化出现相似的趋势。这个结果表明进料流量和菌壁比对L.reuteri包埋活菌数有影响,适当的进料流量和菌壁比可以使包埋活菌数达到最大。
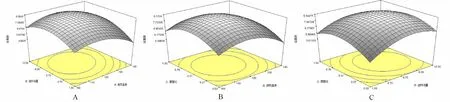
图4 不同因素对L.reuteri微胶囊包埋活菌数的交互作用
2.5 回归方程方差分析
运用Design-expert 8.0软件对17个实验点的响应值进行回归分析,得到L.reuteri微胶囊包埋活菌数的回归方程分析如表3所示。
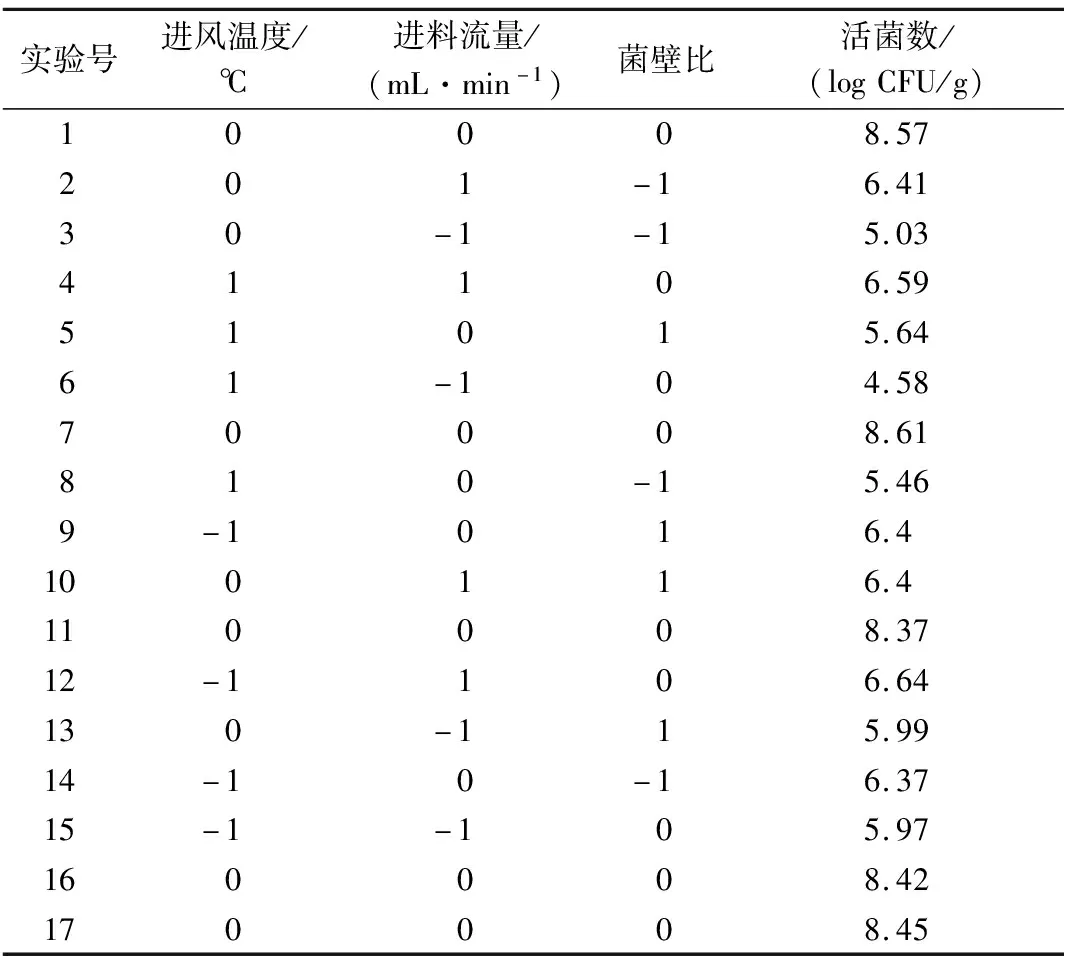
表3 响应面试验结果
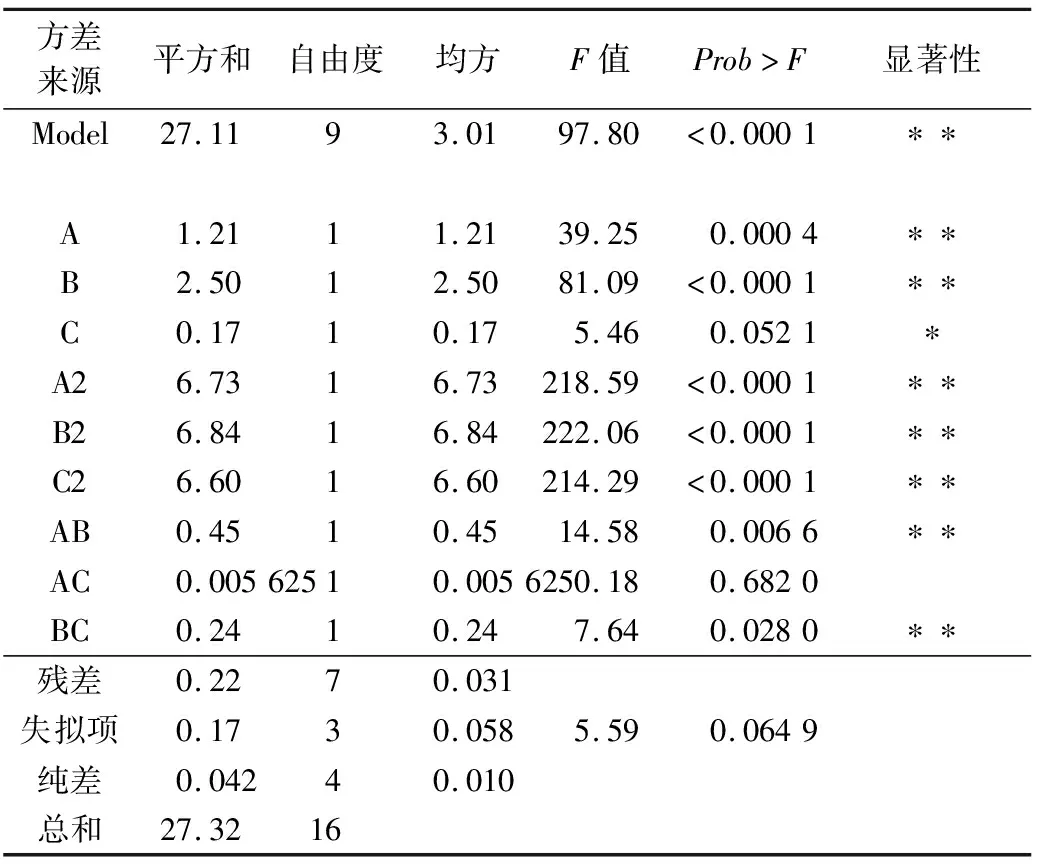
表4 实验设计方差分析
由表可以看出,活菌包埋率总回归模型在α=0.01水平上是极显著的,而失拟项则是不显著的,说明所建立的模型是正确的。由各因素检验可以看出,对活菌数的影响程度为进料流量>进风温度>菌壁比,进风温度、进料流量,进风温度的二次项,进料流量的二次项,菌壁比的二次项,进风温度和进料流量的交互作用、进料流量和菌壁比的交互作用的影响在α=0.01水平上是极显著的,菌壁比的影响在α=0.05水平上是显著的。
2.6 验证实验
根据软件计算得到最优反应条件为:进风温度为117.46 ℃,进料流量为7.79 mL·min-1,菌壁比为0.5,在此条件下,软件预测的活菌数为8.57 log CFU/g。根据喷雾干燥仪的实际操作要求,调整条件为:进风温度为117 ℃,进料流量为7.8 mL·min-1,菌壁比为0.5,喷雾制备L.reuteri微胶囊,此时出风温度在62.5 ℃±2.5 ℃。按此条件所得微胶囊活菌数为8.18±2.50 log CFU/g,与模型预测值差距较小,证明该模型的重现性较好。
3 结论
鱼皮明胶由于其乳化性和成膜性好,可使蛋白质分子形成稳定的空间结构,使得L.reuteri在喷雾干燥包埋过程中迅速形成热可逆凝胶膜,使其免受高温脱水损伤,提高微胶囊在加工和储存期间的稳定性。本文采用TGase对鱼皮明胶进行改性,制备壁材溶液,鱼皮明胶的交联度为15.45%,壁材溶液的乳化性和起泡性分别为为64.25 m2/g,140.00%,通过单因素和响应面优化实验确定了最佳喷雾干燥工艺参数为进风温度117 ℃,进料流量7.8 mL·min-1,菌壁比0.5。在此条件下,L.reuteri微胶囊包埋活菌数为8.18±2.50 log CFU/g,较未交联的活菌数提高了104%,可为食品明胶作为壁材原料进行喷雾干燥制备L.reuteri微胶囊工业化生产提供了良好的理论指导。
