隆突性皮肤纤维肉瘤多学科诊治实施规范
——上海交通大学医学院附属第九人民医院专家共识(2020年版)
2022-01-27上海交通大学医学院附属第九人民医院皮肤梭形细胞肿瘤多学科精准诊疗团队
上海交通大学医学院附属第九人民医院皮肤梭形细胞肿瘤多学科精准诊疗团队
(执笔:陈 骏1*,孙 笛2*,饶娅敏3#,郑海燕3,龚 霞4,徐 慧1#)
1.上海交通大学医学院附属第九人民医院皮肤科,上海 200011;2.上海交通大学医学院附属第九人民医院整复外科,上海 200011;3.上海交通大学医学院附属第九人民医院病理科,上海 200011;4.上海交通大学医学院附属第九人民医院超声科,上海 200011
隆突性皮肤纤维肉瘤 (dermatofibrosarcoma protuberance,DFSP)是一种起源于真皮或皮下组织的低度恶性软组织肉瘤。DFSP 在任何年龄均可发病,以无痛性皮肤斑块或结节为主要特征,皮损表现极易与增生性瘢痕、瘢痕疙瘩等混淆。由于其罕见性以及缺乏特异临床及影像学表现,很多医师对其诊断、治疗方式的认知并不确切,临床易造成漏诊、误诊而延误治疗,误诊率可高达52%~87%;同时其局部的易复发性,导致治疗效果不理想,损害患者身心利益[1]。传统单一学科的诊疗模式已经难以满足患者及社会对疾病治疗的预期。为解决上述诸多问题,上海交通大学医学院附属第九人民医院皮肤梭形细胞肿瘤多学科精准诊疗团队(multidisciplinary team,MDT)经过多次讨论及修订,制定了本共识。
本共识包括了DFSP 的流行病学、临床表现、诊断、治疗、随访建议,以期从临床角度为广大医师提供全面的DFSP 诊疗依据,指导临床医师规范开展对DFSP 的诊治工作,以造福广大患者。
1 流行病学
DFSP 是皮肤肉瘤中最常见的类型之一。随着分子诊断及影像学技术不断提高,被诊断出的DFSP病例呈上升趋势。据统计,DFSP 年发病率从1996 年的0.8/100 万[1]上升至2016 年4.5/100 万[2]。以中国的人口基数计算,每年会有新增患者6 000余例。DFSP好发于25~45岁的中年人群,发病率女性高于男性,非洲裔美国人高于白人[1]。儿童病例约占所有DFSP 患者的6%[3]。由于肿瘤生长缓慢,实际发病年龄会更加年轻[4]。
根据美国国立癌症研究所“监测、流行病学和结果数据库”(Surveillance,Epidemiology,and End Results,SEER)统计,DFSP 可以发生在身体任何部位,最好发于躯干(40%~50%),其次是四肢(30%~40%)、头颈部(10%~15%)、会阴(1%)等[2]。根据显微镜下肿瘤细胞的成分和特点,DFSP 分为包括经典型、纤维肉瘤型(fibrosarcomatous DFSP,DFSP-FS) 等在内的10 种分型[5]。经典型DFSP 占全部DFSP 患者的80%以上,转变成DFSP-FS后会有更高的转移风险[1]。
有报道[6]显示手术、烧伤甚至注射物瘢痕的部位上均可发生DFSP。部分学者认为创伤可能促进了DFSP 的发生,但是目前仍有争论,故临床医师在诊疗过程中应注意详细了解患者病史,以做出准确诊断。
2 DFSP的诊断
2.1 临床表现
DFSP 的临床表现缺乏特异性,多数患者主诉为皮下缓慢生长的无痛质硬结节,病史从数月到数年不等。病灶可呈现为蓝紫色或棕褐色,与周围皮肤分界不清。由于肿瘤大多源于真皮层并向皮下组织浸润[7],故肿块不易推动。肿块大小各异,从几厘米到十几厘米不等,少数长期未治疗的肿块可生长至几十厘米。在疾病早期,多数肿块体积较小并且仅局限在真皮层。随着疾病进展,肿瘤常进入加速生长期,此时瘤体生长速度加快并向深层组织呈伪足样浸润生长,侵犯皮下组织、肌肉甚至骨骼,病灶表面易发生破溃并可产生局部压迫症状。DFSP虽然术后复发率高,但极少发生区域性淋巴结转移和远处转移,预后良好。若肿块生长迅速,应高度怀疑发生肉瘤样改变。应注意萎缩型DFSP临床表现与其他亚型不同,其表现为萎缩样或凹陷性斑块,呈圆形、卵圆形或不规则形状,颜色为棕褐色或红偏黑紫色。由于DFSP 缺乏特异的表现,早期在临床上极易误诊为瘢痕、皮脂腺囊肿、皮肤纤维瘤等疾病,此时则需要根据影像学及病理学检查进行进一步确诊。
2.2 超声学诊断
DFSP 通常位于真皮和皮下软组织内,表现为皮下的卵圆形外生性结节,基部较宽,不同程度地隆起于皮肤表面;病灶质地硬,加压无变形,可为圆形、椭圆形、不规则形或分叶状,呈水平方向生长;多表现为不均匀低回声,边界清或不清,病变多侵犯脂肪组织,可见指突状低回声伸入高回声脂肪内,呈不规则条带状高回声与低回声相间隔。三维超声有助于判断DFSP指突状低回声的范围。
DFSP 侵袭周边组织,尤其是深部组织,侵袭程度不同,可有不同的超声表现,主要分4 种类型。1 型:长椭圆形;此型轻微浸润深部软组织层,未向深部软组织形成指突,深部回声稍增强;约占10%。2 型:向深部软组织形成指突,指突周边无高回声区,仅伴有深部回声增强;约占20%。3型:向深部软组织形成指突,指突周边软组织呈高回声表现,又称“水母征”;最常见,约占53%。4 型:混合回声型;以低回声和高回声混杂为主,无明显指突。
彩色多普勒超声显像(color doppler flow imaging,CDFI)多表现为较丰富的血流。DFSP 可表现为内部弥漫、混杂分布的丰富血流信号,部分也可仅于边缘区域探及血流信号,中心区域则缺乏血供。
在超声造影上,表现为动脉期快速高增强,增强较为均匀;造影后病灶体积增大,边界欠清;造影晚期则缓慢消退,呈高增强。术前行三维超声及超声造影有助于判断DFSP的实际大小,以便完整将其切除,减少或避免出现肿瘤复发和二次手术的概率。
2.3 影像学诊断
X线平片由于重叠效应和低密度分辨率,对软组织肿瘤定性作用不明显、定位较模糊,可见隆起于皮肤表面、无钙化及骨骼受累的软组织肿块。CT 成像具有较高的密度分辨率和空间分辨率,可以显示肿瘤浸润范围。在CT图像上,皮肤DFSP的密度与肌肉密度相当或稍低于肌肉密度,无钙化灶;CT 增强表现为不均匀中等强化,呈多结节征。CT 冠状面、矢状面、多平面重建能够直观显示DFSP 向皮肤隆突性生长,悬吊于皮肤外;其被称为悬吊征,被认为是具有较高特异性的征象[8]。此外,尽管DFSP 极少发生转移,患者胸部CT 检查可显示患者是否经血行转移至肺部。
磁共振成像(magnetic resonance imaging,MRI)软组织分辨率较高,是诊断软组织肿瘤的最佳影像学方法,能够更清楚地显示肿瘤大小、浸润范围及肿瘤与周围组织的关系。MRI上可见肿瘤位于皮肤及皮下脂肪组织内,呈单个或结节状生长,向皮肤外隆起,通常肿瘤边缘不明确。DFSP 在影像学检查中常可见病灶相邻皮肤或病灶相邻筋膜增厚,其被称为皮肤尾征和筋膜尾征[9]。在T1WI 序列上,与肌肉相比,肿瘤呈均匀、等信号或轻度高信号,当肿瘤较大时,可呈高、低、混杂密度的肿块,可有瘤内出血、黏液变和坏死;在T2WI序列上,与脂肪相比,多表现为高信号或等信号,高信号考虑为瘤内黏液变或坏死,稍短T2 信号考虑为纤维组织,低信号高度提示肿瘤为纤维组织来源;在STIR 序列上表现为高信号;DWI 序列呈等信号或高信号;增强扫描多呈不均匀明显强化,瘤内可见斑片状低信号,考虑为肿瘤间质内胶原纤维或致密结缔组织[10-11]。
增强CT三维重建结合增强MRI成像可充分显示肿瘤部位、形态、大小以及肿瘤侵犯周围组织的范围和程度,特别是肿瘤侵犯横纹肌、神经和血管的程度,这对肿瘤诊断与手术规划具有重要参考意义。CT-MRI的三维可视化重建能够帮助医师更加直观、精确地确定肿瘤大小、深度及位置关系,使手术更加精准安全,大大降低患者术后复发概率[12]。此外,CT、MRI增强扫描可明显提高对隐匿性病灶的检出率,对复发病例具有重要意义[13]。对于术后需要接受放射治疗或化学治疗的患者,CT、MRI 可进行预后评价、疗效评价,以便及时调整治疗计划[14]。
正电子发射计算机体层扫描术(positron emission tomography,PET) 与CT/MRI 联用的PET/CT 或PET/MRI 可评估病变是否复发和发生远处转移,对软组织肿瘤的识别灵敏度高、准确度好,可发现无症状患者的微小肿瘤病灶,具有早期发现、早期诊断的价值。有研究[15]描述了DFSP的PET-CT表现,包括躯干和头部皮肤轻度摄取,或在肺、腹膜后或肌肉转移部位更明显的摄取。 研究[16]表明, 采用氟代脱氧葡萄糖(18Ffludeoxyglucose,18F-FDG) 的PET/MRI 可显示DFSP 纤维肉瘤转化, 表现为肿瘤部位标准化摄取值(standardized uptake value,SUV)显著增加。
血管造影可显示肿瘤血供及瘤内出血情况。当肿瘤具有粗大的供血动脉,在增强期明显强化,表明肿瘤富含血管。当肿瘤内在T2WI序列上高信号内的低信号与肿瘤内斑点状无强化相对应时,表明存在瘤内出血[17]。
不同医院影像科的设备条件和医师水平存在明显差异,即使采用同一种检查方法,不同的医院获得的结果也可能有所不同。主诊医师应根据患者的病情、经济状况、医院的设备条件和影像科医师的诊断水平,以及检测方法的灵敏度,综合评估和选择最合适的检查方法。
2.4 病理学及分子诊断
2.4.1 组织病理学 DFSP是发生在真皮浅表部、局部侵袭性纤维母细胞性肿瘤,细胞丰富并呈席纹状排列。肿瘤中1 型胶原a1 链基因(collagen type 1-α 1,COL1A1)与血小板源性生长因子b(platelet-derived growth factor β,PDGFB)形成COL1A1-PDGFB融合基因或相关融合蛋白。其组织学亚型包括较常见的经典型、色素型(又称为Bednar 瘤)、黏液型、萎缩型/斑片型、硬化型、纤维肉瘤样型,以及少见的颗粒细胞型、肌样分化型、巨细胞型、巨细胞纤维母细胞瘤型等[1,5]。
(1)经典型DFSP 该亚型通常表皮不受影响,肿瘤在真皮和皮下组织弥漫性浸润,浸润皮下脂肪形成典型的蜂窝状外观。肿瘤细胞呈单一梭形,细胞核肥胖或呈拉长的波浪状,可排列成席纹状、漩涡状或车轮状。细胞异型性小,有丝分裂活性低,核分裂象少见。肿瘤的表浅部分细胞较少,这对活检标本的鉴别诊断形成相当大的挑战。极少数病例表现为皮下肿块伴深部软组织浸润。罕见病例可能表现为血管显著增生、颗粒细胞改变、核栅栏形成和Verocay小体形成。
(2)色素型DFSP 该亚型表现为肿瘤中出现数量不等的色素型树突状黑素细胞。其鉴别诊断包括纤维组织细胞瘤、神经纤维瘤、黑色素瘤和细胞性蓝痣。
(3)黏液型DFSP 该亚型罕见,肿瘤出现明显的结节状黏液样间质(>50%),伴有多量增生的血管,血管壁可轻微纤维化,肿瘤结构多样,可与其他黏液样间叶肿瘤相似。其鉴别诊断包括梭形细胞脂肪瘤、黏液纤维肉瘤等。
(4)萎缩型DFSP 该亚型罕见,临床表现为扁平、斑块样生长,组织学上除了经典型生长模式外,肿瘤细胞还可排列成平行或水平方向束状结构[18]。其鉴别诊断包括多种皮肤梭形细胞肿瘤,如神经纤维瘤、良性斑块样细胞表面分化抗原34 (cluster of differentiation 34,CD34)阳性真皮纤维瘤、硬化型纤维瘤等。
(5)硬化型DFSP 除了经典的形态学表现,至少50%的肿瘤出现了少细胞或低细胞胶原化区。该病变可误诊为其他良性硬化性病变和间叶性肿瘤,如硬化性上皮样纤维肉瘤、硬化性或促纤维增生性平滑肌肉瘤、黑色素瘤等。
(6)纤维肉瘤型DFSP 该亚型占所有病例的10%~15%,可为原发性,也可为经典型DFSP 局部复发。组织学上肿瘤失去经典型生长模式,常呈结节状、束状、人字形生长。肿瘤细胞异型性和增殖活性增加,生物侵袭性增加,从而获得转移潜能。该亚型可能模仿其他梭形细胞肉瘤,如恶性周围神经鞘瘤、滑膜肉瘤和平滑肌肉瘤等。
2.4.2 免疫组织化学及分子病理学 92%~100%病例肿瘤细胞弥漫表达CD34[19]。但在约半数病例中DFSP-FS表达缺失,少数病例可表达上皮膜抗原(epithelial membrane antigen,EMA)。结蛋白(desmin)、中枢神经特异性蛋白S100、细胞角蛋白(cytokeratin,CK)和细胞表面分化抗原117 (cluster of differentiation 117,CD117)阴性。色素型DFSP树突状细胞表达S100和性别决定区盒基因10 (sex determining region Y-boxes 10,SOX10),具有肌样分化型的结节,肌束中肿瘤细胞平滑肌肌动蛋白(smooth muscles actin,SMA)可弥漫阳性。95%以上的病例出现特征染色体易位t (17;22)(q21;q13),产生COL1A1-PDGFB融合基因,可通过反转录-聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)或荧光原位杂交(fluorescence in situ hybridization,FISH)检测。该融合基因的出现有助于组织学上具有挑战性的病例和完全由纤维肉瘤型组成的肿瘤的诊断。约2%的病例无COL1A1-PDGFB融合,表现为PDGFD等替代融合。
3 分期评估
目前尚未有关于DFSP 的国际通用分期标准。上海交通大学医学院附属第九人民医院皮肤梭形细胞肿瘤MDT采用的是基于欧洲DFSP多学科共识指南改进后的分期标准[1,20-21]。具体如表1所示。
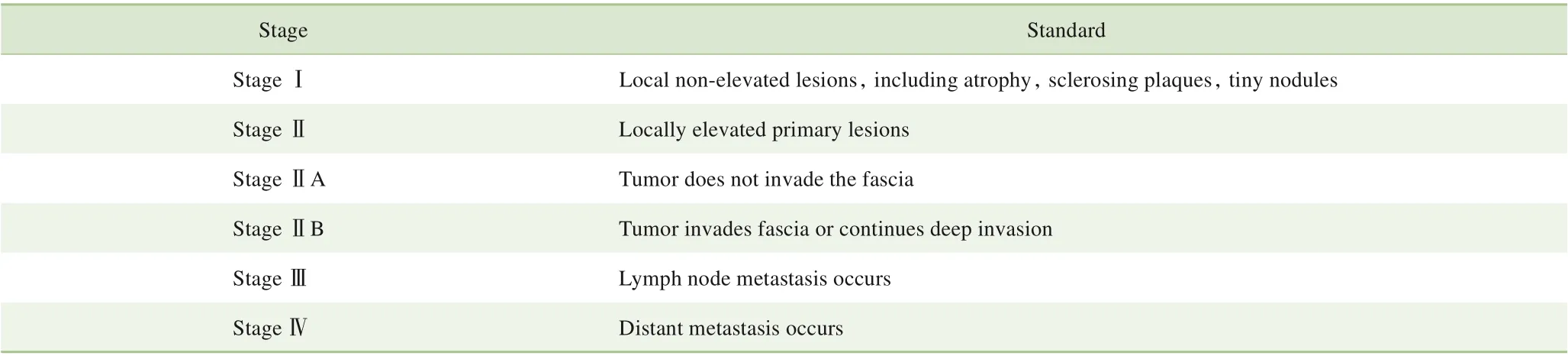
表1 基于欧洲DFSP多学科共识指南改进的分期标准Tab 1 Improved staging standards based on European multi-disciplinary consensus guidelines of DFSP
4 DFSP的治疗
4.1 外科治疗
对于任何分期的DFSP,外科手术都是基础治疗方式。近年来,随着靶向治疗、放射治疗等多种治疗方式的不断发展,对DFSP患者的术前评估应更加全面。建议在术前综合考虑病灶的大小、部位、浸润范围以及是否存在重要器官的转移;同时兼顾患者手术的主观意愿、全身状态以及治疗的反应。
手术方式的选择一直是外科治疗关注的焦点。现阶段外科手术方式主要包括局部扩大切除(wide local excision, WLE) 和 Mohs 显微描记手术 (Mohs micrographic surgery,MMS)。考虑到DFSP 局部浸润的特点,很难在术前精准地确定肿瘤浸润的范围。如果单纯地局部切除,术后难免复发。国内外有学者建议,瘤体周围扩大3~5 cm 切除,也能将肿瘤彻底切除。但这不免损伤过多的正常组织,尤其在头面部,过多地扩大切除范围会累及周围的重要器官,对继发创面的二期修复造成极大的困扰。因此,MMS 的优势突出。该术式能更加彻底地切除瘤体,通过快速石蜡制片病理检查,明确瘤体四周各组织面是否有肿瘤细胞的残留;如有残留,可在相应范围继续切除瘤体,直至各组织面肿瘤Mohs 切缘阴性,这样能最大程度地保留正常组织。有研究[22]报道MMS 的DFSP 复发率仅为3%,而WLE 的切除复发率超过30%。
传统的MMS 不利于观察DFSP 肿瘤细胞,主要由于肿瘤组织较大,冰冻包埋制片会大幅延长手术时间,增加术中风险;肿瘤细胞常浸润脂肪组织,冰冻制片不完整,容易造成假阴性结果。因此我们主张采用改良的慢MMS 进行切除。为了减少住院周期,术前多种影像学手段的检查尤为重要。在B 超、CT、MRI 检查的指导下,判断肿瘤大小和侵袭范围,在肿瘤边缘定位下旁开1 cm进行切除,一期继发创面暂不关闭。待获得DFSP肿瘤组织进行石蜡包埋的Mohs 切缘病理检查结果后,再决定是否进行继发创面的二期修复;如Mohs 切缘仍有DFSP 肿瘤细胞残留,可再进行相应区域的病灶组织切除直至Mohs 切缘阴性。相对于传统MMS 方案,慢MMS 更为精准、安全、有效。
4.2 靶向治疗
甲磺酸伊马替尼(imatnib mesylate,IM)作为一种酪氨酸激酶抑制剂,可以有效阻断血小板源性生长因子(platelet-derived growth factor,PDGF)调控的下游信号通路,达到抑制肿瘤生长的效果。靶向治疗主要适应证包括:①肿瘤过大或浸润过深难以切除。②转移性肿瘤。③肿瘤位于特殊部位,切除对患者生活质量影响大。④用作新辅助治疗。
国外一项多中心研究[23]使用IM 作为新辅助治疗方案,发现57%的患者肿瘤缩小。该研究表明DFSP由于染色体易位t(17;22)(q22;q13)导致血小板源性生长因子受体b (platelet-derived growth factor receptor β,PDGFRB)过度表达;具备该遗传学改变的患者对IM 治疗敏感,而不具备该遗传学改变的患者对IM 不敏感;成人DFSP 患者IM 治疗的推荐剂量是400 mg/d,病情需要时剂量可升至800 mg/d。国际上普遍认为中等剂量IM(400~600 mg/d)与大剂量IM(800 mg/d)效果相当,但患者耐受性更好;400 mg/d 的较低剂量IM 的临床试验有效率同样约为50%[21]。故我们大多使用至少持续6 周的中等剂量IM方案。
IM 治疗第一个月宜每周查一次全血象,第二个月每2 周查血一次,以后则视需要而定(如每2~3 个月一次)。若发生严重中性粒细胞或血小板减少,应调整剂量。应用剂量800 mg/d 过程中,当中性粒细胞<1.0×109/L 和/或血小板<50×109/L 时应停药;在中性粒细胞≥1.5×109/L 和血小板≥75×109/L 时应恢复用药,重新治疗剂量为600 mg/d。如果再次出现危急数值(中性粒细胞<1.0×109/L 和/或血小板<50×109/L),重新治疗剂量应减少至400 mg/d。
约有10%的患者IM治疗效果不佳或产生耐药[24],此时可以尝试使用二线药物舒尼替尼或帕佐帕尼进行治疗[21]。应注意的是,即使IM治疗长期有效的患者,也推荐尽早手术移除病灶,并行组织学检测确认治疗效果,防止复发。
4.3 放射治疗
DFSP 是放射反应性肿瘤,辅助放射治疗能有效控制肿瘤生长,降低术后复发率[1]。目前DFSP放射治疗无统一标准,主要治疗手段还是以外科手术为主,放射治疗只在少数情况下用作辅助治疗。其主要适用于无法切除以及术后发现切缘有残留病灶的患者。
放射治疗范围应包括肿瘤以及肿瘤边缘3~5 cm范围,头颈颌面部按解剖部位及容易侵及方向适当外放,推荐每周进行5次放射治疗,每次2 Gy,总剂量60~70 Gy[20]。由于DFSP 容易复发,手术切缘不足的患者、Mohs 切缘阳性患者或头面部需要外形容貌或功能保留的患者需要术后辅助放射治疗。需要注意的是,Mohs 切缘阴性患者,不应为预防复发而贸然使用放射治疗辅助手段,以减少术后放射治疗引起的不良反应。
4.4 治疗的选择
针对患者DFSP 的不同部位、分期、亚型以及不同需求,可以进行针对性的个体化的复合治疗组合(图1)。

图1 不同DFSP亚型的治疗策略Fig 1 Treatment strategies for different DFSP subtypes
局部原发的Ⅰ期、Ⅱ期DFSP 或者复发的Ⅰ期、ⅡA期DFSP,可以单纯进行外科Mohs 切除,Mohs 切缘阴性可直接进入随访流程;如果某些部位Mohs 切缘阳性,但进一步切除会造成明显的器官缺损,影响功能及生活质量,可在术后1 周内进行放射治疗。如果DFSP 的分型是纤维肉瘤型等高转移风险的亚型,则在术后进行3个月的生物靶向治疗。
局部原发的Ⅲ期、Ⅳ期DFSP 或者复发的ⅡB 期、Ⅲ期、Ⅳ期DFSP,局部Mohs切缘阴性,也需要进行3~9个月的生物靶向治疗;如果Mohs 切缘阳性,则在术后1 周内进行放射治疗,并且进行9个月的生物靶向治疗。
由于患者体质不耐受或者手术后存在生命风险的高危DFSP,可以先进行3~6 个月的生物靶向治疗,缩小肿瘤体积后创造手术条件。
5 随访
考虑到DFSP 的局部极易复发的特点,需要对患者进行长时间的随访。我们参考国外指南,建议随访10 年,前5年至少每半年随访1次,5年后至少每年随访1次[20]。随访应包括对局部瘢痕恢复的评估、肿瘤是否复发和转移的评估等。随访期间可对瘢痕进行注射瘢痕软化针、外用硅酮凝胶、压迫治疗、点阵激光治疗、脉冲染料激光治疗等处理。前5年每年应进行至少1次的局部MRI及前哨淋巴结的超声检查。有条件的单位,可以进行术区声诺维(SonoVue)增强超声检查,以提高早期肿瘤复发与术后瘢痕的鉴别能力。对于DFSP-FS 以及转移、复发性肿瘤,应适度增加随访频率。同时应关注患者心理状态,建立完善的患者健康档案,保证患者生活质量。
