急性呼吸窘迫综合征的右心保护性通气策略
2022-01-27安连朝栗小提瞿海龙
安连朝,栗小提,瞿海龙
对急性呼吸窘迫综合征(ARDS)的治疗,从早期的大潮气量通气到保护性通气,从高频率的自主呼吸保留到神经肌肉阻滞剂的应用、俯卧位通气的实施,以及体外膜肺的肺休息策略,治疗手段不断更新。而ARDS的死亡率并无明显下降,仍高达40%左右[1]。临床对ARDS的更多关注于其所致的呼吸衰竭,往往忽视了其血流动力学的异常。ARDS病人常伴有肺循环功能紊乱,可导致肺血管阻力(pulmonary vascular resistance,PVR)增加,进而引发肺动脉高压、急性肺源性心脏病(ACP)[2]。从20世纪80年代已有学者开始关注ARDS时右心衰竭的发生机制。机械通气作为治疗中度、重度ARDS的常规手段,其可降低右心前负荷,增加右心后负荷,使右心功能进一步恶化[3]。因此,ARDS治疗不仅仅应关注氧合状态的改善,而更需加强右心保护。
1 ARDS右心衰竭病理生理机制
ARDS时有多种机制参与了肺循环的破坏,如缺氧性肺血管收缩、血管收缩介质的释放、血管外肺水的压迫、肺微血栓形成以及肺血管的重构,这些因素均可导致PVR升高、肺动脉高压,使右室后负荷过重,出现右心衰竭[4]。肺动脉高压是ARDS导致血流动力学异常的基本特征,是ACP形成的解剖条件。
除ARDS本身因素以外,不恰当的机械通气不仅可导致呼吸机相关肺损伤,而且可以进一步恶化右心功能。正常呼吸时引起肺肺组织扩张的真正力量为跨肺压(肺内压与胸腔内压之差),又称之为应力。“婴儿肺”和顺应性降低是ARDS的病理生理特点,这类病人实施机械通气时,常规潮气量(8~10 mL/kg)即可引起应力明显升高。过高的肺应力会引起肺泡过度扩张,压迫肺毛细血管,致使PVR增加、右心射血量减少。小潮气量通气可减少肺泡的过度扩张,降低肺血管压迫,是目前推荐的通气策略[5]。应力的计算需预知胸腔内压,食管压作为反映胸腔内压的一个指标,其准确性得到多数学者认可。然而测量食管压需要特定的呼吸机品牌和较高的材料费用,基层医院应用受到限制。临床上通常将平台压作为评估肺应力的方法,其反映的是吸气末时肺泡内压力。将平台压控制在低于27 cmH2O(1 cmH2O=0.098 kPa)是低应力通气策略之一,可明显降低ACP的发生率[6]。然而平台压与应力之间匹配并非完美,因为平台压将胸壁的顺应性纳入其中。对于肥胖的病人也许平台压很高,而真正作用于肺的应力却不高,此时用平台压作为通气指导,可导致肺泡不能被有效复张,出现低氧血症。近年来提出的以驱动压为指导的保护性通气策略正受到关注,其反映通气过程中跨呼吸系统静态压力增加的程度。驱动压等于平台压减去呼气末正压(positive end expiratory pressure,PEEP),即潮气量与呼吸系统顺应性的比值。当驱动压小于18 cmH2O时,病人存活率明显增加,当驱动压明显升高时,病人发生ACP的概率升高,存活率下降[7]。
肺充气后对肺间质血管与肺泡周围血管的作用是不一样的,致使肺容积与PVR之间呈“U”型曲线关系。肺泡膨胀不良与肺泡过度膨胀,都会导致PVR升高,影响右心功能。因此,在ARDS病人实施机械通气时需在肺泡复张和过度充气之间寻找一个平衡点,以实现一个最低的PVR。ARDS病人肺部病变不均一,正常肺组织与病变肺组织交织存在,通气时需评估肺的可复张性,防止不恰当通气导致的右心损害[8]。当应用很高的PEEP实施肺复张时,塌陷区域的肺泡可能会被充盈,而正常区域的肺泡就会过度膨胀;而应用较低的PEEP时,虽然不会出现肺泡过度扩张,但重力依赖区肺泡就会出现膨胀不良,根据“U”型理论,这两种情况均会PVR增加,加重右心功能的损害。
另一引起肺动脉高压的因素为二氧化碳分压升高,其机制为高碳酸血症时由存在酸中毒,会引起肺部血管的收缩。ARDS产生二氧化碳潴留通常有两方面的因素,即小潮气量通气与肺泡死腔的增加。而肺泡死腔量的增加与病人的临床预后是相关的,死腔越大,病人死亡率越高[9]。有研究显示,对ARDS病人实施保护性通气时发生ACP的危险因素与肺炎导致的ARDS、氧合指数(氧分压/吸氧浓度)<150mmHg(1 mmHg=0.133 kPa)、二氧化碳分压≥48 mmHg、驱动压≥18 cmH2O因素相关[10]。
2 ACP的诊断及对ARDS预后的影响
肺动脉漂浮导管是诊断ACP的“金标准”,通过肺动脉压监测、心排血量的测定评估右心功能。随着床旁超声心电图在重症监护室(ICU)的广泛应用,应用超声进行床旁评估简便易行。对于机械通气病人,经食管超声获取的图像要比经胸超声清晰。ACP时由于右室急性扩张,在收缩末期室间隔发生矛盾运动,突向左室,在超声上形成“D”字征(见图1)[11]。如果在舒张末期右室面积明显大于左室,提示ACP已经很严重。
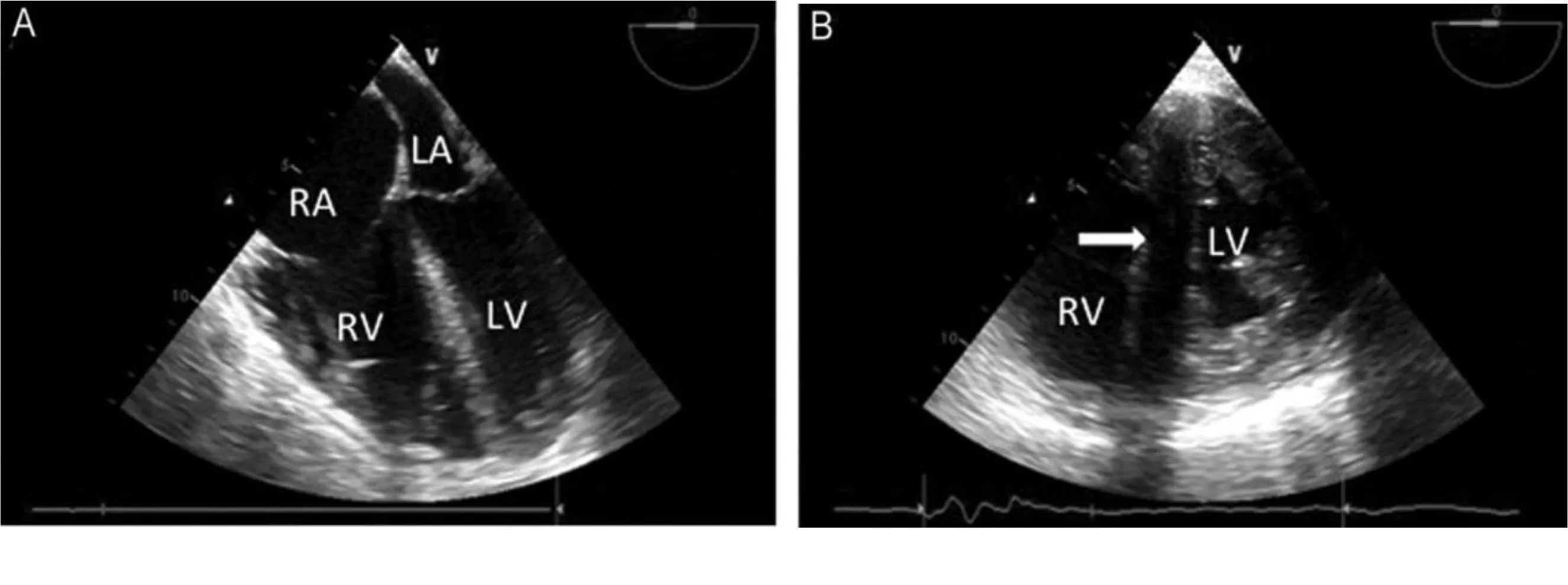
图1 ACP的经食管超声检测结果[A:食管中段四腔心,右心室严重扩张、右心房压力升高致使房间隔突向左心房;B:经胃短轴切面,室间隔矛盾运动(箭头所示),左心室形成“D”字征。RA:右心房;LA:左心房;RV:右心室;LV:左心室]
由于保护性通气策略的实施,ACP在ARDS病人的发生率较前明显下降。通过食管超声监测中度、重度ARDS病人,发现ACP的发生率约为22%,与既往流行病学研究结果[12]相一致。与无ACP病人相比,继发ACP的ARDS病人心脏指数更低、休克发生率更高、血管活性药物的需要量更大[13]。尽管多数学者认为ACP是ARDS病人的独立死亡危险因素,然而有些研究却提出ARDS合并ACP的死亡率并没有增加[14]。Mekontso等[10]的研究虽然总体上来看合并ACP的ARDS病人与未合并ACP病人死亡率比较差异无统计学意义,但进一步亚组分析发现存在严重ACP的病人死亡率明显升高,造成无统计学差异的原因是合并ACP组病人实施了俯卧位通气,同时该研究发现,如果具备ACP 4个危险因素(肺炎导致的ARDS、氧合指数<150 mmHg、二氧化碳分压≥48 mmHg、驱动压≥18 cmH2O)之一,ACP的发生率小于10%,如果4个危险因素均具备,那么ACP的发生率就会高达75%。因此,以4个危险因素对病人进行评分(0~4分),可用于评估病人发生ACP的危险性。对检出的高危病人,需及早实施食管超声监测,进行早期干预,以防止右心衰竭的发生。
3 右心保护性通气策略
机械通气的ARDS病人,实施右心保护性通气策略:通过限制平台压与驱动压降低肺的应力、提高氧合改善缺氧性肺血管收缩、降低二氧化碳分压。当然在临床实施过程中,3个目标之间可能会存在矛盾,此时应用俯卧位通气可能会更加有效。潮气量与PEEP设置时需保障平台压小于27 cmH2O,驱动压小于18 cmH2O。最佳PEEP的设置一直存在争议,但从理论上讲应该满足以下两点:病人可取得最好的氧合状态,同时并不降低呼吸系统的顺应性[15],这样才会在肺复张与过度扩张之间寻找到平衡点,防止右心损伤。
ARDS时允许性高碳酸血症并非治疗目标,而是实施小潮气量通气不可避免的后果。当二氧化碳分压明显升高时就会引起ACP,因此,在通气过程中需将二氧化碳分压控制在小于48 mmHg[16]。为了降低高碳酸血症,采取提高呼吸频率的方法需谨慎,因为高呼吸频率可导致内源性PEEP和肺泡过度充气,不仅不能清除二氧化碳,而且还会损害右心功能[17]。这就是在ARDS病人通气过程中需密切监测PEEP的原因。使用伺服型湿化器、减少呼吸管路的死腔,对于降低高碳酸血症有益。
对ARDS病人实施俯卧位通气不仅可实现肺泡的复张,而且还可起到肺脏和右心的双重保护作用。PROSEVA研究发现对ARDS病人实施俯卧位通气后病死率得到明显下降,而这种死亡率的下降与病人的换气功能改善、氧合指数提高、二氧化碳分压下降并无相关性[18]。同时该研究显示,俯卧位通气可降低病人28 d的猝死率和心力衰竭发生率。根据这些结果分析,这样良好的效果很可能来源于俯卧位通气对血流动力学的正面效应。其机制考虑与以下两方面有关:首先,俯卧位通气能够降低肺部感染发生,减轻全身炎症反应,进而减少炎性介质对心肌的毒害作用[19];其次,俯卧位通气可降低右心的后负荷。俯卧位通气使肺部病变均一,用于肺复张的PEEP水平降低,重力依赖区的驱动压下降,二氧化碳潴留减轻,这些因素均可使右心后负荷下降[20]。
4 右心保护的新观点
严格控制二氧化碳分压是右心保护通气策略之一,然而对于有些病人在实施机械通气时却很难达到,高碳酸血症时有发生。对于这类病人应用体外二氧化碳清除(ECCO2R)技术是一种有效办法。动物实验表明,对存在呼吸性酸中毒的ARDS模型实施静脉-静脉ECCO2R,将二氧化碳分压维持在正常水平,可降低肺动脉压、提高右室功能[21]。在机械通气时希望能够通过呼吸机参数设置,使塌陷的肺泡复张,又不致使正常肺泡过度扩张,这在临床评判中的确很困难。肺部CT是目前可接受的评判标准,然而ARDS病人多病情危重,实施CT检查存在很多风险,床旁超声只能评估肺复张,不能监测到肺泡过度膨胀。近年来提出的依据压力-时间曲线测定的应力指数,能够为呼吸机合理参数的设置提供有益帮助,指导医务人员对病人肺部情况做出正确评估[22]。
ARDS对右心的损害已引起临床广泛关注,心肺紧密相关,在实施机械通气时需心肺兼顾,改善病人预后,降低死亡率。
