硅胶表面霉酚酸分子印迹聚合物的合成及应用
2022-01-27彭侃霖丘镜莉熊仁萍贺利民
彭侃霖,周 豪,刘 戎,孙 坚,丘镜莉,熊仁萍,贺利民
(华南农业大学 兽医学院/国家兽药残留基准实验室,广东 广州 510642)
霉酚酸 (Mycophenolic acid)是青霉菌Penicillium产生的弱酸性次级代谢产物[1],具有一定的抗霉菌、抗细菌和抗病毒活性[2-3],也是霉酚酸酯(Mycophenolate mofetil)在体内的活性代谢产物,可抑制器官移植时的排异反应[4]。全球约25%的农作物受到霉菌毒素的污染[5],青贮饲料作为反刍动物的重要饲料,在加工、储存和运输时,处理不当容易产生霉变。青霉菌是霉变青贮饲料中常见的菌株[6],青贮饲料中霉酚酸平均含量可达256~7 656 μg/kg[7-9]。霉变青贮饲料中毒素成分复杂,逐一检测较为困难,而霉酚酸作为青霉菌污染饲料的标志物,在受污染青贮饲料中具有代表性,可间接反映青贮饲料中霉菌毒素的水平[1]。此外,动物如果长期暴露于含霉酚酸的青贮饲料环境下,免疫力下降,容易受感染性疾病的侵袭[10]。因此建立能准确可靠地测定青贮饲料中霉酚酸含量的方法,从而评价青贮饲料的质量具有实践意义。
基质中霉酚酸检测的报道常见于血浆[11]和尿液[12]中,也以瘤胃液作为基质[13],而霉酚酸分析测定方法大多只是经过简单的前处理[14],缺乏特异性,检测易受干扰,研发新的高选择性净化方法十分必要。分子印迹聚合物(Molecularly imprinted polymer,MIP)对目标物的结合具有特异性,结合固相萃取技术,采用高效液相色谱(High performance liquid chromatography,HPLC)法[15]可检测人血浆中的霉酚酸,采用液相色谱-串联质谱(Liquid chromatography-tandem mass spectrometry,LCMS/MS)法[5]可完成对青贮饲料中霉酚酸的检测;然而采用本体聚合法制备的聚合物存在传质速度慢、识别位点被包裹和模板难以洗脱等缺陷[16-17]。以硅胶作为载体的表面分子印迹聚合技术是一种在硅胶表面发生印迹的方法[18],目标物传质速度快,模板洗脱容易;因此,本研究探究了霉酚酸-硅胶表面分子印迹聚合物的合成,作为固相萃取吸附填料评价其对霉酚酸的吸附保留能力,最后构建分子印迹固相萃取-HPLC法测定青贮饲料中霉酚酸含量,为青贮饲料中霉菌毒素污染水平的监控提供参考。
1 材料与方法
1.1 仪器与试剂
Agilent 1 260 型高效液相色谱仪 (Agilent公司),SHA-B型恒温水浴振荡器(常州国华电器有限公司),KH7200DB型超声波清洗器(昆山禾创超声仪器有限公司),Velocity 18R高速冷冻离心机(Dynamica公司),EVOMA 15扫描式电子显微镜(ZEISS 公司)。
霉酚酸酯原料药(上海源叶生物科技有限公司)、霉酚酸均购自MedChemExpress公司。硅胶购自Silicycle公司,γ-甲基丙烯酰氧基丙基三甲氧基硅烷(γ-MPS)、甲基丙烯酸(MAA)、二甲基丙烯酸乙二醇酯(EGDMA)、偶氮二异丁腈(AIBN)、甲基丙烯酸-2-羟基乙酯(HEMA)均购自Sigma-Aldrich公司,2-乙烯基吡啶(2-VP)和4-乙烯基吡啶(4-VP)购自Alfa Aesar公司,丙烯酰胺(AM)购自上海润捷化学试剂有限公司,衣康酸(IA)购自J&K Scientific公司。丙酮、三氯甲烷购自广州化学试剂厂,甲醇、乙腈均为色谱纯,超纯水由Millipore MilliQ系统制备,青贮饲料由某饲料厂提供。
1.2 方法
1.2.1 SiO2-MPS 的制备 称 5 g 干燥硅胶于 150 mL圆底烧瓶中,加入适量6 mol/L盐酸,混匀后于80 ℃油浴中搅拌10 h,冷却至室温后,离心弃上清液,沉淀物不断用水洗涤至中性,60 ℃真空干燥24 h,得到活化硅胶[19]。
取5 g活化硅胶于三颈圆底烧瓶中,依次加入100 mL 无水甲苯、5 mLγ-MPS 和 1 mL 三乙胺,混匀,在氩气保护下,120 ℃条件下加热回流12 h。将混合物离心弃上清液,沉淀依次用甲醇、超纯水交替洗涤,60 ℃条件下真空干燥,得到SiO2-MPS(改性硅胶)。1.2.2 SiO2-MPS@MIP 的制备 将 1 mmol的霉酚酸酯溶于 80 mL 乙腈中,加入 2 mmol MAA,涡旋、超声混匀,在冰浴下磁力搅拌6 h后,依次加入0.6 g SiO2-MPS、20 mmol EGDMA 和 40 mg AIBN,超声混匀,通入氩气 10 min,密封,60 ℃ 油浴下磁力搅拌24 h。将聚合物依次用甲醇、超纯水和φ为10%的乙酸甲醇溶液洗涤,用超纯水、甲醇去除残留的乙酸,直到检测不到模板分子后,于60 ℃ 条件下真空干燥 24 h,备用。
SiO2-MPS@NIP的制备:不加入霉酚酸酯,将2 mmol MAA 溶于 80 mL 乙腈中,超声混匀、磁力搅拌后加入与制备SiO2-MPS@MIP相同量的SiO2-MPS、EGDMA和 AIBN,混匀后通氮气,密封,60 ℃油浴下磁力搅拌24 h。依次用水和甲醇洗涤SiO2-MPS@NIP后,于 60 ℃ 条件下真空干燥 24 h,备用。
1.2.3 材料的表征 通过扫描电镜观察活化硅胶、SiO2-MPS、SiO2-MPS@MIP和SiO2-MPS@NIP的形貌特征。
1.2.4 吸附试验 称取 20 mg 干燥聚合物粉末于25 mL玻璃锥形瓶中,加入5 mL含有一定浓度霉酚酸的乙腈溶液,25 ℃条件下在恒温振荡水浴锅中振荡 24 h,4 000 r/min 离心 10 min,取上清液并过0.22 μm微孔滤膜,HPLC测定。每个浓度准备3份平行样,取算术平均值。吸附量(Q)按照公式(1)计算,印迹因子 (Impringting factor,IF)按公式 (2)计算。
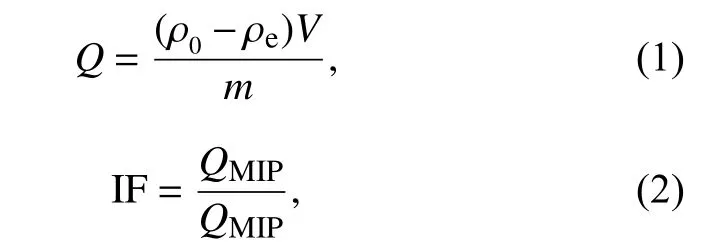
式中,Q为吸附量,mg/g; ρ0和ρe分别是霉酚酸的初始质量浓度和达平衡时上清液中霉酚酸的质量浓度,mg/L;V为溶液体积,mL;m为称取的聚合物质量,mg;QMIP和QNIP分别为 SiO2-MPS@MIP和SiO2-MPS@NIP的吸附量,mg/g。
1.2.5 分子印迹固相萃取柱制备及固相萃取试验
将制备好的干燥聚合物装填于1 mL聚丙烯固相萃取空柱中,两端用配套的滤板封堵,轻轻压实,制备成分子印迹固相萃取(Molecularly imprinted polymer solid phase extraction)小柱。固相萃取柱依次用 1 mL 的甲醇、超纯水活化,1mL 100 mg/L 的霉酚酸溶液上样,1 mL 10%(φ)甲醇溶液淋洗和2%(φ)乙酸甲醇溶液洗脱,洗脱溶液吹干后用1 mL流动相复溶,进行HPLC测定。
1.2.6 样品的前处理过程 称取 5 g 青贮饲料,添加适量霉酚酸标准溶液,涡旋混匀,室温下静置20 min。加入20 mL乙腈,经提取、振荡、离心后取10 mL上清液吹至近干,用2 mL酸性水(pH=6)溶解残留物,过固相萃取小柱,按“1.2.5”处理,上机测定。
1.2.7 HPLC 条件 色谱柱:Aglient Extend-C18 柱(250 mm × 4.6 mm,5 μm);检测波长:250 nm;流动相:A相为乙腈(含体积分数为0.3%的甲酸),B相为体积分数为0.3%的甲酸溶液,流动相比例为VA∶VB= 60∶40;流速:1 mL /min;进样量:20 μL。1.2.8 霉酚酸检测方法的评价 采用色谱纯乙腈稀释霉酚酸标准储备液,配制成 0.5、1、2、5、10、20、50、100 mg/L的标准溶液,HPLC检测。以吸收峰面积(Y)为纵坐标,浓度(X)为横坐标,绘制标准曲线。
向空白青贮饲料中添加适量霉酚酸标准溶液,经前处理后上机检测,以3倍(S/N≥3)和10倍(S/N≥10)信噪比作为检测限和定量限。
向空白青贮饲料中添加霉酚酸标准溶液,配制成低 (200 μg/kg)、中 (2 000 μg/kg)和高 (8 000 μg/kg)3个添加水平,前处理后上机检测。每个浓度做5个平行样,测定3批次,以同一批次和3批次的平均回收率作为日内和日间回收率,以相对标准偏差(Relative standard deviation)表示精密度。
1.2.9 数据统计分析 试验数据采用 SPSS 17.0 软件分析,采用Origin 2019b绘制统计图,采用Duncan’s法进行多重比较,显著性差异水平为P<0.05。
2 结果与分析
2.1 聚合物制备条件的优化
2.1.1 致孔剂的选择 乙腈作为致孔剂时SiO2-MPS@MIP吸附量最高,为3.7 mg/g,印迹因子达到2.1。如表1所示,向乙腈中添加少量三氯甲烷时,SiO2-MPS@MIP吸附量下降,随着三氯甲烷添加比例的升高,吸附量呈现先增大后降低最后稳定的趋势;SiO2-MPS@NIP的吸附量随着三氯甲烷添加比例的升高而增加,最后与SiO2-MPS@MIP的吸附量基本一致;印迹因子呈下降趋势。当致孔剂全为三氯甲烷时,聚合物呈块状,不适合进一步试验。后续试验以乙腈为致孔剂。

表1 乙腈溶液中不同三氯甲烷添加比例对S i O2-MPS@MIP和SiO2-MPS@NIP吸附量的影响Table 1 The influence of different addition proportions of chloroform in acetonitrile on the adsorption capacity of SiO2-MPS@MIP and SiO2-MPS@NIP
2.1.2 模板和单体的优化 选择霉酚酸的结构类似物霉酚酸酯作为虚拟模板,比较了碱性单体(2-VP和4-VP)、中性单体(AM和HEMA)和酸性单体(IA和MAA)对印迹因子的影响,结果如图1A所示,MAA合成时印迹因子显著高于其他组合(P<0.05),2-VP和HEMA参与合成时印迹因子无显著差异(P>0.05),但显著高于单体为AM和IA时的印迹因子 (P<0.05)。

图1 不同单体种类(A)和不同模板单体摩尔比(B)对印迹因子的影响Fig.1 The influence of different monomer types (A) and different mole ratios of template to monomer (B) on impringting factor
考察不同的模板单体摩尔比 (1∶1、1∶2、1∶4、1∶6和1∶8)对印迹因子的影响,结果如图1B所示,模板单体摩尔比为1∶2时,印迹因子显著高于其他组合 (P<0.05),模板单体摩尔比为 1∶1和 1∶4时印迹因子之间无显著差异(P>0.05),但均显著高于模板单体摩尔比为1∶6和1∶8时的印迹因子(P<0.05)。
2.2 聚合物的表征
2.2.1 聚合物表面形貌观察 对活化硅胶、SiO2-MPS、SiO2-MPS@MIP和SiO2-MPS@NIP进行扫描电镜分析,结果如图2所示,活化硅胶和SiO2-MPS表面光滑,而SiO2-MPS@MIP和SiO2-MPS@NIP表面粗糙,均有聚合物包裹在硅球表面,包裹在SiO2-MPS@NIP表面的聚合物更多且致密。
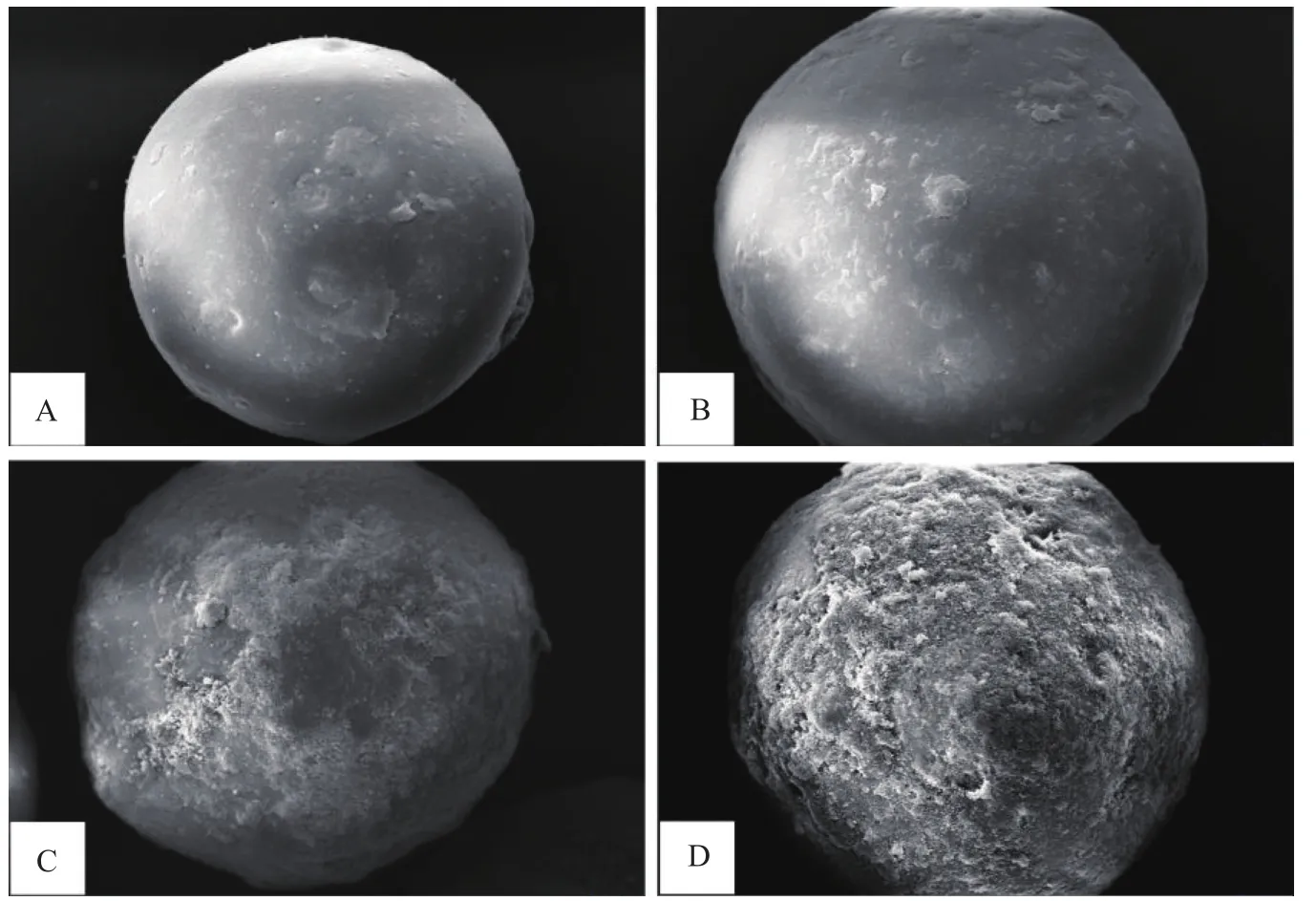
图2 活化硅胶(A)、SiO2-MPS (B)、SiO2-MPS@MIP(C)和SiO2-MPS@NIP(D)的扫描电镜图Fig.2 Scanning electron microscope images of activated silica gel (A),SiO2-MPS (B),SiO2-MPS@MIP (C) and SiO2-MPS@NIP (D)
2.2.2 聚合物吸附性能的研究 静态吸附试验研究了霉酚酸不同初始浓度对聚合物吸附量的影响,结果如图3A所示,在10~250 mg/L范围内,随着霉酚酸质量浓度的增加,SiO2-MPS@NIP和SiO2-MPS@MIP的吸附量增加,SiO2-MPS@MIP在霉酚酸质量浓度为250 mg/L时趋于饱和,饱和吸附量为 4.5 mg/g。
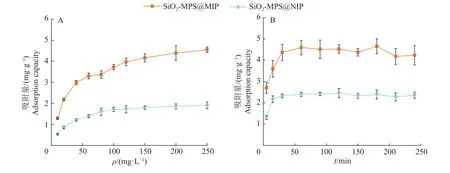
图3 SiO2-MPS@MIP和SiO2-MPS@NIP的静态(A)和动态(B)吸附曲线Fig.3 Static (A) and dynamic (B) adsorption curves of SiO2-MPS@MIP and SiO2-MPS@NIP
动态吸附试验研究了吸附时间对聚合物吸附量的影响,在质量浓度为100 mg/L的霉酚酸溶液下进行动态吸附试验,结果如图3B所示,SiO2-MPS@NIP在30 min内达到吸附平衡,SiO2-MPS@MIP在30 min内吸附速率较快,60 min时达到吸附平衡。
2.3 分子印迹固相萃取条件的优化
2.3.1 上样溶液对霉酚酸回收率的影响 研究甲醇、乙腈、三氯甲烷和超纯水为上样溶液对霉酚酸回收率的影响,如图4A所示,超纯水作上样溶液时分子印迹固相萃取柱对霉酚酸的回收率可达到90%以上,高于非印迹固相萃取柱。在实际样品的考察中,比较不同pH水作为上样溶液过分子印迹固相萃取柱的效果,结果如图4B所示,随着pH的增加,分子印迹固相萃取柱和非印迹固相萃取柱对霉酚酸的回收率先增加后下降,在pH为6的时候分子印迹固相萃取柱的回收率最高,高于非印迹固相萃取柱的。
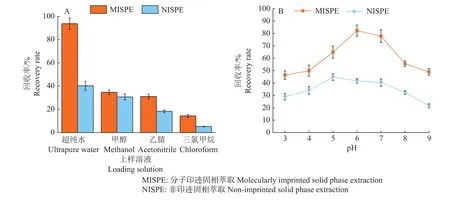
图4 不同上样溶液(A)及不同pH水(B)对霉酚酸回收率的影响Fig.4 The influences of different loading solutions (A) and different pH water (B) on mycophenolic acid recovery rate
2.3.2 淋洗溶液及洗脱溶液对霉酚酸回收率的影响
分别采用不同体积分数的甲醇溶液(1%、5%、10%和20%)和乙腈溶液(10%和20%)淋洗,如图5A所示,分子印迹固相萃取柱对霉酚酸的回收率高于非印迹固相萃取柱。与乙腈溶液相比,采用甲醇溶液淋洗分子印迹固相萃取柱时霉酚酸回收率高,损失小。当甲醇溶液中甲醇体积分数大于10%时,有机相含量增加,回收率下降;当甲醇体积分数在10%以下时,回收率均大于90%。与体积分数为1%和5%甲醇溶液相比,体积分数为10%的甲醇溶液中有机相比例更高,容易除去实际样品中脂溶性杂质,因此选择体积分数为10%的甲醇溶液作为淋洗溶液。
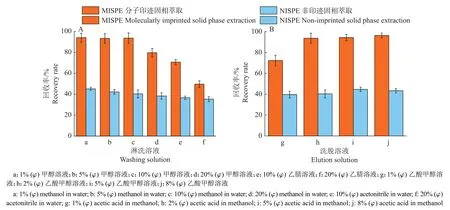
图5 不同淋洗溶液(A)和洗脱溶液(B)对霉酚酸回收率的影响Fig.5 The influences of different washing solutions (A) and elution solutions (B) on mycophenolic acid recovery rate
如图5B所示,分别考察了体积分数为1%、2%、5%和8%的乙酸甲醇溶液洗脱的效果,结果表明,分子印迹固相萃取柱对霉酚酸的回收率高于非印迹固相萃取柱,适当增加乙酸的比例可以有效提高洗脱的效率,但是酸过多时回收率基本保持不变,因此选择体积分数为2%的乙酸甲醇溶液为洗脱溶液即可。
2.4 霉酚酸检测方法的评价
霉酚酸在0.5~100 mg/L范围内线性良好(R2=0.999),检测限和定量限分别为 60 和 200 μg/kg。过分子印迹固相萃取柱前后HPLC色谱图见图6,回收率数据见表2。霉酚酸的回收率为76.0%~81.2%,相对标准偏差为3.3%~6.6%。
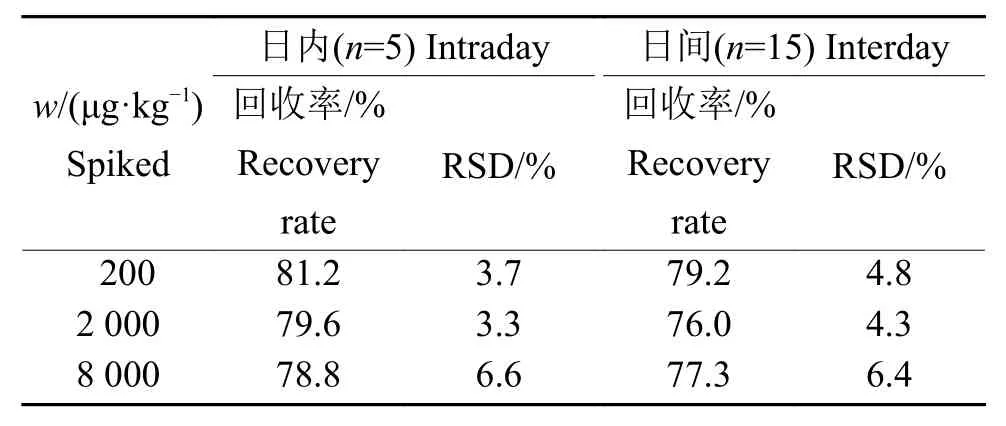
表2 空白样品中霉酚酸的加标回收率及相对标准偏差(RSD)Table 2 Recovery rates of spiked mycophenolic acid and the relative standard deviation (RSD) in the blank sample
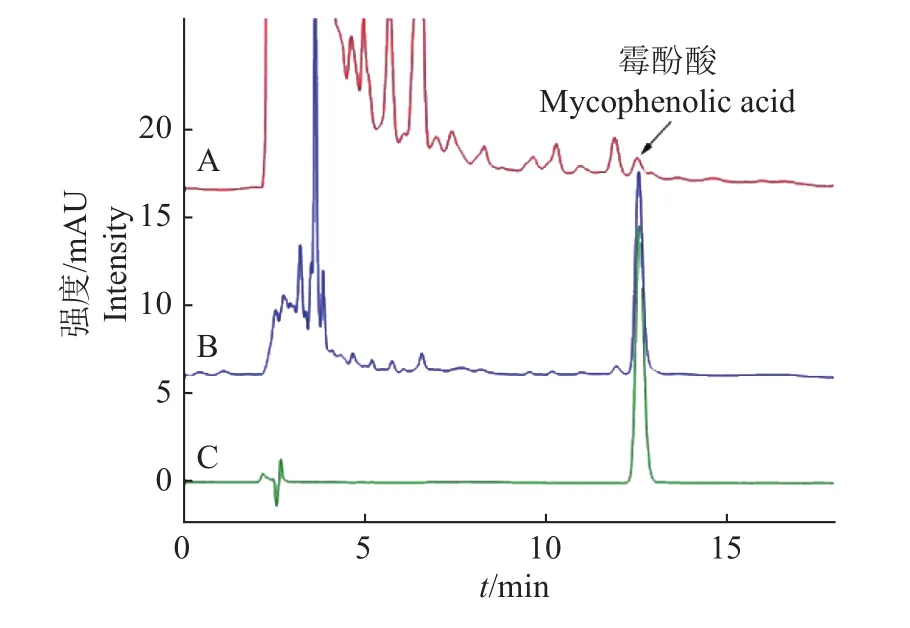
图6 过分子印迹固相萃取柱前(A)和经分子印迹固相萃取柱净化后(B)的加标青贮饲料(2 000 μg/kg)以及相应的标准溶液(C)HPLC-UVD色谱图Fig.6 HPLC-UVD chromatograms of the spiked silage(2 000 μg/kg) before (A) and after (B) purification by the molecularly imprinted polymer solid phase extraction column and the corresponding standard solution (C)
对20份青贮饲料样品进行检测,结果显示,在3份样品中检出霉酚酸,质量分数分别为227、391和1 770 μg/kg,其他样品中未检出霉酚酸。
3 讨论与结论
试验结果显示三氯甲烷降低了SiO2-MPS@MIP的特异性,这是因为三氯甲烷会导致聚合物溶胀、挤压甚至破坏特异性孔穴,从而降低聚合物的特异性[20]。De Smet等[5]采用碱性单体 4-VP 合成,采用LC-MS/MS法检测霉酚酸,而本研究采用酸性单体MAA进行合成,制备的分子印迹固相萃取小柱对霉酚酸净化效果良好,表明霉酚酸酯除了通过氢键与MAA在立体结构上相匹配外,霉酚酸酯中的含氮基团吗啉与MAA存在静电相互作用,增强了预聚物的稳定性,从而提高了SiO2-MPS@MIP特异性识别能力。结合表征结果并分析聚合物动静态吸附曲线发现,由于硅球表面成功覆盖了聚合物层,霉酚酸更容易进入孔穴中,因此与De Smet等[5]采用的本体聚合法相比,表面印迹法制备的印迹聚合物达平衡时间更短,可节约试验时间。考察聚合物装柱后的效果,由于疏水作用参与了目标物与印迹聚合物的识别过程[21],促进了霉酚酸的保留,因此上样溶液为水时更好。进一步研究发现,霉酚酸在过酸或过碱条件下回收率低,因为pH较低时,过多的氢离子会竞争性地结合霉酚酸中的氧原子,阻碍霉酚酸与填料之间氢键的形成,而pH较高时,填料中的羧基基本完全电离,也不利于霉酚酸与填料的结合[22]。
本研究利用表面印迹聚合法成功制备出对霉酚酸具有吸附特异性的硅胶表面接枝分子印迹聚合物,聚合物具有良好吸附能力和传质速度,建立的合成印迹聚合物固相萃取-HPLC法可净化、富集和检测青贮饲料中的霉酚酸,为青贮饲料的质量安全控制提供指导。
