高、低温催青诱导家蚕滞育发生中的蛋白质修饰
2022-01-27宋宇航冯嘉伟尹延萍杨婉莹钟仰进
宋宇航,白 旭,冯嘉伟,尹延萍,肖 阳,杨婉莹,钟仰进
(1 华南农业大学 动物科学学院/广东省农业动物基因组学与分子育种重点实验室,广东 广州 510642;2 广东省农业科学院 蚕业与农产品加工研究所,广东 广州 510640)
昆虫滞育(Diapause)是指昆虫在感受到环境的不良信号后,生长发育进入停滞的状态。滞育不仅能帮助昆虫躲避不良环境,还能使其发育整齐,增加繁殖几率,保证种群繁衍[1]。不同昆虫滞育发生的阶段不同,可分为卵滞育、幼虫滞育、蛹滞育以及成虫滞育[2]。
二化性家蚕Bombyx mori是典型的卵滞育昆虫,由滞育激素 (Diapause hormone,DH)调控。DH 由蛹至成虫发育过程中咽下神经节(Suboesophageal ganglion,SG)的 12 个神经细胞表达合成。成熟的DH 只有 24 个氨基酸,这个小分子多肽由心侧体至咽侧体释放到血淋巴[3-5],继而被血淋巴转运到雌性蚕蛹的卵巢,与卵巢上的 DH 受体(Diapause hormone receptor,DHR)结合,使第二信使鸟苷酸环化酶(cAMP)活性下降[6],导致血淋巴中大量海藻糖被分解成葡萄糖,形成糖原。糖原被分解后合成山梨醇、甘油等有机物。家蚕产卵,并以蚕卵状态进入滞育期[7-9]。
亲代经历的热应激反应可以通过表观遗传效应跨代遗传给下一代[18]。表观遗传是指在基因DNA 序列没有改变的情况下,基因功能发生了可遗传的变化,这种变化在细胞分裂甚至隔代遗传中保持稳定。已知的表观遗传现象有DNA 甲基化、组蛋白修饰、基因组印记、非RNA编码等和母体效应等[19]。家蚕滞育诱导受母体效应机制调控,为了探讨表观遗传修饰在家蚕滞育诱导发生中的作用机制,我们筛选了受温度调控滞育发生的二化性家蚕品种,将蚕卵分别放置在25和15 ℃催青,收集不同积温点的蚕卵,抽提蛋白,进行甲基化、磷酸化、乙酰化等抗体的Western blot检测。研究蛋白质修饰在家蚕滞育诱导中的作用,研究结果将为家蚕的滞育分子机理提供参考。
1 材料与方法
1.1 家蚕饲养
供试家蚕二化性品种:P50由中国科学院蚕业研究所徐安英研究员提供,大造(Dazao)由广东省农业科学院蚕业与农产品加工研究所提供。将其蚕卵分别放在25和15℃催青孵化后,幼虫期置于26~28℃、相对湿度 60%±5%、12 h日夜交替的环境下用新鲜桑叶饲喂至上蔟。出蛾交配6 h后产卵。然后将这些蚕卵置于25℃气候箱,10 d后观察蚕卵滞育状况,统计滞育卵、混合卵和非滞育卵的卵圈数量。
1.2 试剂
甲基化赖氨酸泛抗体、乙酰化赖氨酸泛抗体、磷酸化赖氨酸泛抗体、泛素化泛抗体、丙二酰化赖氨酸泛抗体和琥珀酰化赖氨酸泛抗体购自杭州景杰生物科技有限公司;SDS、BSA、Tris、二乙醇胺、尿素等购自广州翔博生物科技有限公司;BCA法蛋白定量试剂盒购自上海碧云天生物技术有限公司;蛋白酶抑制剂、磷酸酶抑制剂、PR-619、TSA和NAM购自上海蓝木化工有限公司。
1.3 蚕卵的浸酸处理
将二化性家蚕品种P50的蚕卵放在25 ℃气候箱中催青,饲喂1代后产下滞育卵。将滞育卵在产卵 20 h 后进行浸酸处理,在 1.075 g/L (46.1 ℃)的盐酸溶液中浸泡4.5 min,随即放在流动的水中浸泡30 min,冲洗干净后放置在25 ℃晾干。随后将解除滞育的蚕卵分成2组,一组置于25 ℃气候箱中明催青(高温滞育诱导组),另一组置于15 ℃气候箱中暗催青(低温非滞育诱导组)。高温滞育诱导组分别在25 ℃催青后的第4、5、6和8天(点青期)取样;低温非滞育诱导组分别在与滞育诱导组相同积温处取样。将蚕卵样品放于-80 ℃冰箱储存备用。
1.4 蚕卵蛋白质的抽提
将“1.3”中取样的蚕卵样品,各组称取同等质量放至液氮预冷的研钵中,加液氮充分研磨成粉末。各组样品分别加入4倍体积的酚抽提缓冲液[含质量分数为1%的蛋白酶抑制剂和1%的磷酸酶抑制剂、50 μmol/L PR-619、3 μmol/L 曲古柳菌素 (TSA)和 50 mmol/L 烟酰胺 (NAM)],超声裂解。加入等体积的 Tris平衡酚,4 ℃、6 000 r/min离心 10 min,取适量上清液,加入 5 倍体积含 0.1 mol/L乙酸铵的甲醇溶液沉淀过夜。蛋白沉淀分别用甲醇和丙酮进行洗涤,最后沉淀用8 mol/L尿素复溶。
1.5 蛋白质浓度测定
取蚕卵蛋白,使用 BCA 试剂盒测定蛋白质浓度,方法如下:将 0、5、10、15、20 μL 标准品加到酶标条的样品孔中,加样品稀释液补足至 20 μL,各检测 3 个复孔;同时将 5 μL 待测蛋白样品加到酶标条的样品孔中,加样品稀释液补足至 20 μL,各检测 3个复孔;在孔里加入 200 μL BCA 工作液,37 ℃ 条件下静置反应 30 min。用酶标仪测定D570nm。根据标准曲线和使用的样品体积计算出样品的蛋白质质量浓度。
1.6 SDS-PAGE电泳检测
蛋白胶由质量分数为12%的蛋白分离胶和5%的蛋白浓缩胶组成。根据蛋白质浓度测定结果,每个样品取等量蛋白到离心管中,加入5 μL 4×Loading buffer,再加入质量分数为 2% 的 SDS 溶液使终体积为20 μL;依次在蛋白胶胶孔上样1 μL预染蛋白Marker 和20 μL蛋白样品。浓缩胶在15 mA电流下电泳15 min,将蛋白浓缩为1条线。分离胶 35 mA 电流下电泳至 Loading buffer到胶底部。胶取出后放在考马斯亮蓝R-250 染液中室温染色2 h,然后加入脱色液,脱色至背景无色、条带清晰。
1.7 蛋白质修饰的Western blot检测
取 30 μg 蛋白质样品,加入 4×Sample buffer,调至 1×,样品配制质量浓度控制在 2 g/L,95 ℃ 加热10 min。依次在蛋白胶胶孔上样1 μL预染蛋白 Marker 和 20 μg 蛋白样品,进行 SDS-PAGE 电泳检测,先 80 V 恒压 30 min,再 120 V 恒压电泳至溴酚蓝刚跑出分离胶。将胶平铺于经转膜液浸泡的NC膜上,随后将转印夹按正确电极方向放入电转槽。4 ℃、80 V 恒压电转 2 h。再用含 5%(ω)脱脂奶粉的TBST溶液进行封闭,室温封闭1 h。封闭结束,使用TBST溶液漂洗3次,每次10 min。再使用含5%(ω)脱脂奶粉的TBST溶液稀释抗体,加入抗体后置于4 ℃冰箱,温和摇晃孵育过夜。一抗孵育结束后,使用TBST溶液漂洗3次,每次10 min。加入二抗,室温孵育 1 h。二抗孵育结束,用TBST溶液 漂洗3次,每次10 min。加入荧光底物孵育5 min,用自封袋覆盖在膜上,放入暗盒曝光。
(一)加强基层党组织建设。为了充分发挥党组织的核心作用和基层党组织战斗堡垒作用,市农场管理局党组印发了《关于认真抓好“支部主题党日”活动的通知》,明确了“五个坚持”(即坚持领导带头、坚持“全覆盖”、坚持依规管理、坚持问题导向、坚持分类指导),为推动农垦改革,保证和监督各项政策的贯彻落实提供坚强的组织保障。
2 结果与分析
2.1 二化性家蚕滞育性统计
为了筛选稳定的受温度调控的二化性家蚕品种进行滞育研究,我们分别统计了大造和P50蚕卵在25和15 ℃催青孵化后的子代滞育情况,统计结果如图1所示。25 ℃催青孵化的大造产下的滞育卵圈占42.9%,混合卵圈占7.1%,非滞育卵圈占50.0%;15 ℃催青孵化的大造产下的滞育卵圈占32.1%,混合卵圈占7.1%,非滞育卵圈占60.8%,说明大造的滞育不完全受温度调控。25 ℃催青孵化的P50可以产下100.0%滞育卵,15 ℃催青孵化时产下100.0%非滞育卵。后续分别在夏秋季继续养蚕重复该试验,二化性家蚕P50的卵滞育表型可以稳定地受温度调控,因此后续试验选择使用P50进行。滞育的3种类型如图2所示。

图1 不同品种家蚕高、低温催青后代滞育型统计Fig.1 The statistics of diapause type of offspring of different Bombyx mori varieties incubated at high or low temperature

图2 3种家蚕蚕卵类型图片Fig.2 Pictures of three types of Bombyx mori eggs
2.2 蛋白浓度测定结果
Sato等[20]通过温度交换试验确定了二化性家蚕Kosetsu在25 ℃催青的敏感期为第3.5~5.5 天,昆虫的滞育诱导是在敏感期完成的,15 ℃催青的敏感期在第12~20 天。我们在前期饲养过程中发现P50在15 ℃催青时发育比Kosetsu略快,因此选取了25 ℃催青4、5、6和8 d点青期的蚕卵蛋白作为样品进行检测,计算出这4个取样点的积温分别为 66.8、82.0、100.2、133.6 ℃。15 ℃ 催青组分别按相同积温进行取样。抽提蛋白后,取5 μL蛋白样品,通过BCA 试剂盒测定蛋白浓度。根据标准曲线,计算获得每个样品的蛋白质质量浓度和蛋白质质量,结果如表1所示。

表1 高、低温催青家蚕蚕卵的蛋白含量Table 1 Protein content of Bombyx mori eggs incubated at high or low temperature
2.3 蚕卵蛋白的SDS-PAGE电泳检测
通过SDS-PAGE电泳后,进行考马斯亮蓝染色、脱色检测抽提蛋白质量,结果如图3所示。从图中可以看出抽提的蛋白电泳条带清晰、均一,蛋白无降解,组内各泳道平行性好,可以用于后续的蛋白质修饰检测试验。同时电泳结果也显示,在胚胎发育前期,积温分别为66.8和82.0 ℃时,25和15 ℃催青组的蚕卵蛋白电泳条带相似;积温在100.2 ℃时,高、低温处理组出现差异条带。在蚕卵孵化前的点青期,蛋白条带与发育前期明显不同,说明这个时期的胚胎发生了急剧的生理生化改变,蛋白质代谢加速。
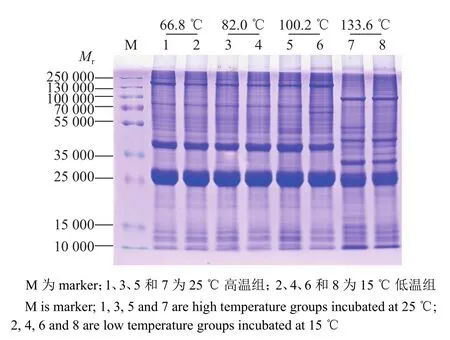
图3 高、低温催青的不同积温蚕卵蛋白的 SDS-PAGE 电泳检测Fig.3 SDS-PAGE detection of protein in Bombyx mori eggs with different accumulated temperature incubated at high or low temperature
2.4 高、低温催青P50蚕卵的蛋白修饰检测
将上述高、低温催青孵化的蚕卵蛋白定量,取20 μg蛋白进行SDS-PAGE电泳,分别用甲基化、乙酰化、磷酸化、泛素化、丙二酰化和琥珀酰化抗体进行Western blot杂交,相同曝光时长下检测高、低温催青蚕卵蛋白质的蛋白修饰差异,同时对各种蛋白质修饰水平进行扫描定量。
家蚕胚胎期蛋白质的甲基化修饰水平在发育前期 4、5、6 d (积温分别为 66.8、82.0、100.2 ℃)时非常低,到8 d点青期(积温为133.6 ℃)时突然增高,对条带进行灰度扫描比较发现,25 ℃高温组的甲基化修饰水平一直高于相同积温下的15 ℃低温组,但只有在点青期时,2组处理之间有显著差异(图4A、5A)。

图4 高、低温催青的不同积温家蚕蚕卵的蛋白修饰检测Fig.4 Detection of protein modification of Bombyx mori eggs with different accumulated temperature incubated at high or low temperature
对蛋白质乙酰化修饰研究最多的是对组蛋白的修饰,我们的检测发现25 ℃催青组蚕卵的乙酰化修饰水平在积温为66.8 ℃时低于15 ℃催青组蚕卵,积温为 82.0、100.2 ℃时稍高于15 ℃催青组,而在点青期(积温为133.6 ℃)又显著低于15 ℃催青组蚕卵,在整个发育时期2组处理之间都存在显著差异 (图 4B、5B)。
泛素化修饰主要参与蛋白质降解,其修饰水平在蚕卵整个催青发育过程中表现稳定,且25 ℃催青组蚕卵蛋白的泛素化修饰水平在积温为66.8和100.2 ℃时极显著低于15 ℃催青的蚕卵,在积温为82.0 ℃时显著低于15 ℃催青的蚕卵,在点青期(积温为133.6 ℃)虽然低于15 ℃催青组,但不存在显著性差异。分析原因可能是为应对15 ℃低温逆境,家蚕胚胎细胞通过降解细胞器和蛋白质以维持基本的生存,因此泛素化修饰水平高,家蚕胚胎生长发育迟缓(图4C、5C)。
从图4D、5D中可以看出磷酸化修饰水平在整个胚胎发育期都非常高,说明磷酸化修饰作为一种基本修饰形式参与到生长发育的生理生化反应中。在25 ℃催青组积温为66.8、82.0和100.2℃时,磷酸化高于15 ℃催青组,在点青期(积温为133.6 ℃)低于15 ℃催青组,但比较发现2种处理之间不存在显著性差异。
丙二酰化修饰水平在蚕卵胚胎期较高,但高、低温处理组间没有明显差异(图4E、5E);琥珀酰化修饰在蚕卵胚胎期发生水平较低,但在积温为100.2 ℃时,15 ℃催青处理组蚕卵蛋白在相对分子质量为70 000的琥珀酰化修饰明显增多,使这一积温处总体的琥珀酰化修饰显著增高。点青期(积温为133.6 ℃)时,2组处理之间带型差异明显,15 ℃催青组的蚕卵蛋白在相对分子质量为35 000处有明显修饰(图4F、5F),说明琥珀酰化修饰可能发生在一些特异功能蛋白上。
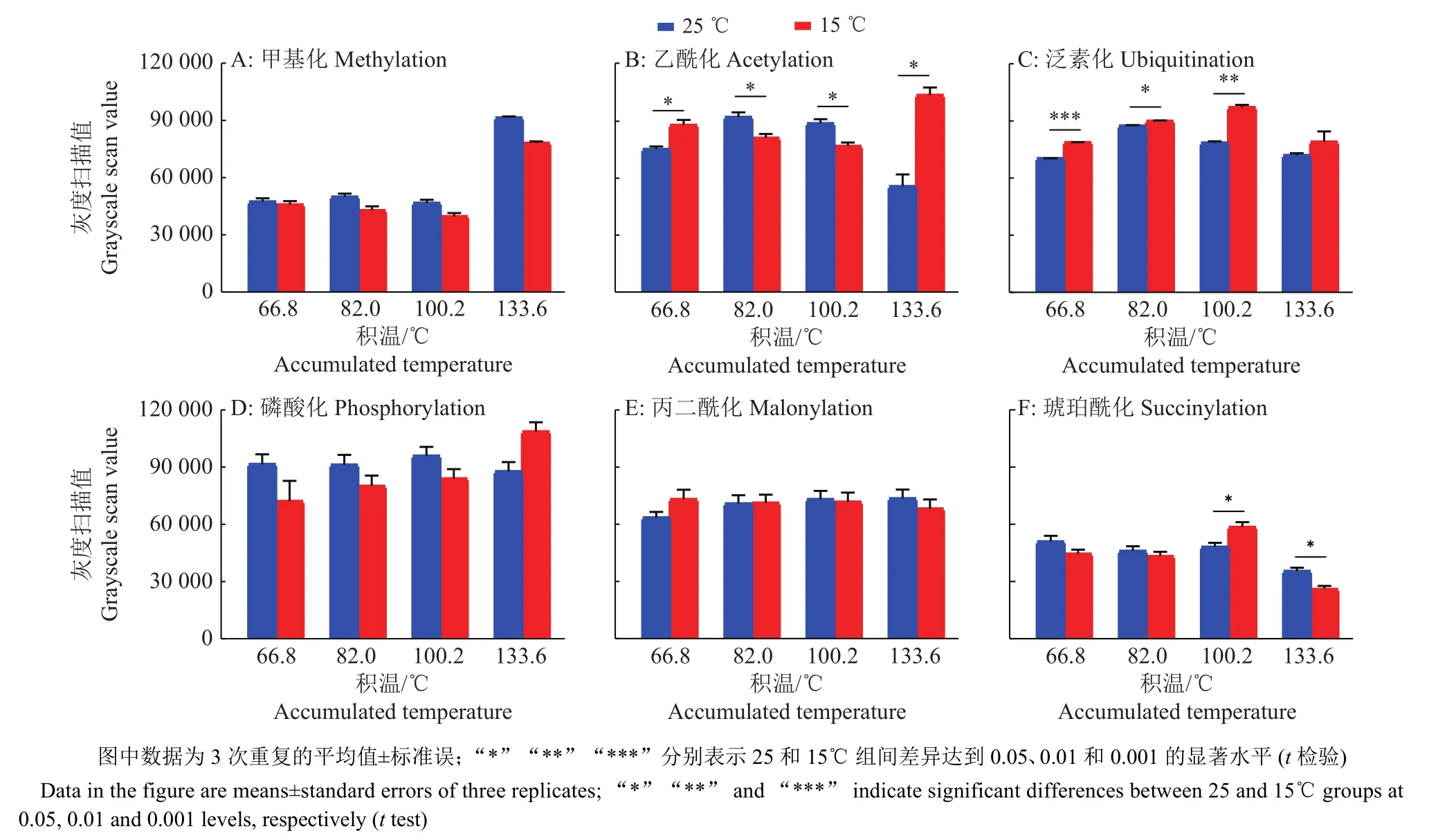
图5 高、低温催青的不同积温家蚕蚕卵的蛋白修饰灰度扫描图Fig.5 Gray-scale scanning image of protein modification of Bombyx mori eggs with different accumulated temperature incubated at high or low temperature
3 讨论与结论
家蚕滞育诱导是自身在胚胎期感受到外界环境信号,经中枢神经系统接收整合并调节自身内分泌系统,导致体内各种生理生化特性发生变化,并决定下一代是否滞育[16,21]。这种调控属于跨代效应,往往通过蛋白质修饰来实现[22-23]。我们通过Western blot检测了25和15 ℃催青后蚕卵蛋白质的甲基化、乙酰化、磷酸化、泛素化、丙二酰化和琥珀酰化修饰水平,其中,甲基化、乙酰化、泛素化、琥珀酰化修饰水平差异明显,而磷酸化和丙二酰化修饰水平差异不明显。
甲基化修饰是一种常见的蛋白质和DNA修饰形式。DNA甲基化不仅调控生物的生长发育,而且参与了生物对逆境胁迫的应答[23-24]。近年来的研究表明DNA甲基化和组蛋白的甲基化参与昆虫滞育诱导的调控。如RNA 干扰丽蝇蛹集金小蜂Nasonia vitripennis的DNA甲基转移酶1a(Dnmt1a)和DNA甲基转移酶3(Dnmt3)会破坏其由光周期诱导的滞育反应[19]。在果蝇Drosophila3 龄幼虫前 3 d干扰其Dpy-30基因,会导致组蛋白 H3(H3K4)甲基化活性下降,且组蛋白去甲基化酶基因LSD1、Su(var)3-9的表达量显著上调,随后的生长发育中会出现滞育表型[25]。Egi等[26]用DNA甲基转移酶抑制剂5-氮杂胞苷处理家蚕幼虫和柞蚕Antherea pernyi滞育蛹,发现药物处理对短日滞育维持和长日羽化无显著影响,说明DNA甲基化在家蚕光周期引起的滞育中不起作用,暗示DNA甲基化并没有参与家蚕滞育诱导的调控。但在我们对蛋白质的甲基化修饰筛查发现,25 ℃催青处理下的4个关键时间点中,蚕卵蛋白的甲基化水平始终高于15 ℃催青组,到孵化前的点青期则是显著更高,说明蛋白质甲基化可能参与了滞育诱导的调控,至于是否是通过对组蛋白的甲基化修饰诱导滞育发生则需要进一步通过蛋白质修饰组学进行研究。
蛋白质乙酰化是指蛋白质在乙酰基转移酶的催化下把乙酰基团共价结合到底物蛋白质的氨基酸残基上,与蛋白质去乙酰化形成可逆性修饰过程。组蛋白修饰具有调控基因表达、维持基因组和染色体的结构和稳定性的作用,其中组蛋白乙酰化修饰对染色体结构的影响及转录调控是研究最为深入的领域[27]。近年来的研究发现,昆虫常通过改变体内组蛋白修饰基因表达量的方式间接参与滞育诱导的调控。如地蟋蟀Allonemobius socius的组蛋白乙酰化基因reptin在不同发育阶段始终处于动态变化水平,Reynolds等[28]发现在滞育诱导期reptin基因的转录表达显著上调,滞育后则急剧下调。我们的结果表明在家蚕胚胎发育期蛋白质乙酰化修饰水平总体上较高,在25 ℃和15 ℃催青组的不同发育阶段处于动态变化中。在蚕卵孵化前的点青期,25 ℃催青组蚕卵蛋白的乙酰化修饰水平显著低于15 ℃催青组,猜测蛋白质乙酰化修饰可能对调节自身发育起着重要作用。接下来我们将通过蛋白质质谱技术进一步筛查发生乙酰化修饰差异的蛋白质,分析其与家蚕滞育诱导的关系。
蛋白质的泛素化修饰是通过泛素-蛋白酶系统(Ubiquitin-proteasome system,UPS) 介导参与的一种调节蛋白质降解过程[29]。泛素化修饰主要发生在赖氨酸(Lysine,Lys)残基上,对细胞分化、调控、生物合成、细胞凋亡和免疫应激反应等生理过程起着重要作用[30]。在本试验中25 ℃催青组的泛素化水平始终低于15 ℃催青组,说明低温处理对蚕卵是一种不良环境刺激,泛素化修饰始终参与了这个应激反应过程。蛋白质的磷酸化修饰是研究最为广泛的一种修饰方式,广泛参与到生命活动的各种生理过程,如细胞内信号转导、细胞增殖、发育与分化等[31]。在催青的前期,25 ℃处理组的磷酸化修饰水平高于15 ℃处理组,说明25 ℃催青时细胞内生命活动较15 ℃催青组的频繁,低温组的细胞分裂、增殖和分化等活动变缓。
丙二酰化和琥珀酰化修饰作为新被发现的蛋白质修饰类型,它们的修饰都发生在Lys残基上,通过在Lys上添加丙二酰基团或者琥珀基团改变蛋白质的电荷数和构象,从而影响其功能[32-33]。本试验中,高、低温处理组之间丙二酰化修饰差异并不明显,说明丙二酰化修饰在滞育诱导过程中并没起到关键作用。琥珀酰化已被证实参与脂肪酸合成和氧化、线粒体呼吸和糖酵解等多种代谢途径[34]。本试验中,在6 d(积温为 100.2℃)时,25℃ 处理组的琥珀酰化修饰水平显著低于15 ℃处理组,而在点青期又显著高于低温组,说明代谢途径可能参与了滞育诱导的调控。
本研究通过比较高、低温催青家蚕蚕卵的不同蛋白修饰种类,发现高温 25 ℃催青蚕卵相比低温15 ℃催青的蚕卵,其乙酰化和泛素化修饰水平在整个时期都存在显著性差异,而甲基化修饰水平却始终高于低温 15 ℃催青的蚕卵,且点青期差异极显著,这与跨代热可塑性结果类似,猜测组蛋白甲基化、泛素化和乙酰化可能在其中起到了作用。未来计划通过蛋白质质谱技术进一步检测这2种蛋白质修饰的关键蛋白,为家蚕滞育诱导的分子机理解析提供参考。
