基于MoS2-Fe3O4复合物水凝胶的过氧化氢比色检测
2022-01-27崔梦雨,党雪明,赵慧敏
崔 梦 雨,党 雪 明,赵 慧 敏
(大连理工大学 环境学院 工业生态与环境工程教育部重点实验室, 辽宁 大连 116024 )
0 引 言
过氧化氢(H2O2)具有强氧化性,常作为漂白剂、消毒杀菌剂、脱氯剂等,被广泛应用于化学工业、医疗、食品工程等领域.但是日常生活中H2O2过度使用的现象严重,残留的H2O2以气体、液体形式扩散,通过呼吸、吞食和皮肤接触等途径侵入人体后,易转化为羟基自由基(·OH),造成细胞膜的破坏、血清蛋白酶失活和细胞变异,与多种病变的发生有着密切的关系[1-2].因此实现水体中H2O2的快速、简便和灵敏检测具有重要意义.
比色传感法检测H2O2具有操作简便和检测快速等优势,主要是通过过氧化物酶催化H2O2氧化底物显色从而实现H2O2的检测[3].但天然酶(如辣根过氧化物酶,HRP)的活性易受酸碱度、温度、盐度等环境因素影响,导致其结构构象发生改变,进而失去催化活性[4].为解决该问题,研究者设计并制备了具有过氧化物酶活性的纳米酶,通过结构设计与纳米材料复合等方式提高催化活性,为H2O2的灵敏检测提供了新的发展思路[5-6].据报道,具有纳米片层结构的二硫化钼(MoS2)展现了较好的类过氧化物酶活性[7-9],但表面催化位点较少限制了其在H2O2灵敏检测中的进一步应用[10-11].Fe3O4作为一种良好的H2O2催化剂,将其修饰于MoS2纳米片表面可以增加催化活性位点,提高H2O2催化性能[12].同时,二维MoS2纳米材料在离子键、金属键和分子间作用力等非共价键作用下容易发生相互堆叠,导致大量的活性位点不能参与H2O2催化过程.作为一种具有三维网状结构的聚合物材料,水凝胶由单体和交联剂通过化学作用(共价偶联)和物理作用(疏水和静电)聚合而成,水凝胶三维结构的引入可增加MoS2片层之间的间距,暴露更多的活性位点[13],构建具有三维结构的MoS2类过氧化物酶体系,可以进一步提高催化活性.为此,本文制备MoS2-Fe3O4复合物水凝胶,并构建比色传感平台实现水体中H2O2的灵敏检测.
1 实验材料与方法
1.1 试剂与仪器
(1)实验试剂
二硫化钼(MoS2,分析纯,>98%)、牛血清蛋白(BSA,分析纯,>98%)、海藻酸钠((C6H7O6Na)n,分析纯,90%)、3,3′,5,5′-四甲基联苯胺(TMB,分析纯,>99%)和四氧化三铁纳米颗粒(Fe3O4NPs,≤30 nm,分析纯,>98%)购买于上海阿拉丁生化科技有限公司;其余药品氯化铁(FeCl3,分析纯)、氯化亚铁(FeCl2·4H2O,分析纯)、冰乙酸(CH3COOH,分析纯,99.5%)、乙酸钠(CH3COONa,分析纯,98%)、过氧化氢(H2O2,分析纯,30%)、无水乙醇(CH3CH2OH,分析纯,99%)购于国药集团化学试剂有限公司.
(2)实验仪器
采用扫描电子显微镜(SEM,Hitachi S-4800,日本株式会社日立制作所)对所制备的MoS2纳米片及MoS2-Fe3O4复合物水凝胶的微观形貌进行表征,通过X-射线能谱分析(EDS)观察MoS2-Fe3O4复合物水凝胶的元素分布;通过透射电子显微镜(TEM,Hitachi S-4800,日本株式会社日立制作所)观察MoS2纳米片的微观形貌;通过X射线衍射仪(XRD,LabX XRD-6000,日本株式会社岛津制作所)进行MoS2纳米片及MoS2-Fe3O4复合物水凝胶的晶体结构分析;通过X射线光电子能谱分析仪(XPS,ESCALAB 250Xi,美国Thermo Fisher公司)分析MoS2-Fe3O4复合物水凝胶材料的元素价态.
1.2 MoS2纳米片的制备
本实验采用超声剥离法制备MoS2纳米片[14-16],主要过程如下:首先,在室温条件下制备牛血清蛋白水溶液(BSA,1 mg/mL).然后将块状的MoS2粉末分散于牛血清蛋白水溶液中,MoS2与牛血清蛋白的质量比为5∶1,超声处理24~48 h;随后在3 000 r/min条件下低速离心2 min去除未剥离的块状材料,收集灰绿色的上层悬浮液,再在13 000 r/min条件下高速离心10 min,分离上清液中的牛血清蛋白,底部沉淀用去离子水重复洗涤5次.最后,通过真空冷冻干燥得到薄层MoS2纳米片.
1.3 MoS2-Fe3O4复合物水凝胶的制备
使用化学共沉淀工艺合成了MoS2-Fe3O4复合物水凝胶,实验在室温以及pH=6条件下进行,方法易于操作[17-19].具体的实验方案如下:首先制备Fe2+/Fe3+混合溶液,将1.363 g FeCl3和0.835 g FeCl2·4H2O溶于50 mL去离子水,该溶液用作MoS2-Fe3O4复合物水凝胶的交联剂.为考察不同含量MoS2纳米片基水凝胶的类过氧化物酶活性,分别将1、5、10 mg的MoS2纳米片与质量分数为1%的海藻酸钠溶液磁力搅拌1 h得到1、5、10 mg/mL的MoS2-海藻酸钠混合溶液.将不同混合比例的MoS2-海藻酸钠混合溶液滴入Fe2+/Fe3+混合溶液中后,60 ℃静置 30 min,得到黑色的MoS2-Fe3O4复合物水凝胶颗粒,冷冻干燥后研磨为粉末备用.相同实验条件下,不添加MoS2纳米片制备了Fe3O4水凝胶:将质量分数为1%的海藻酸钠溶液滴加到Fe2+/Fe3+混合溶液(与MoS2-Fe3O4复合物水凝胶的交联剂相同),60 ℃静置30 min,得到Fe3O4水凝胶颗粒,冷冻干燥后研磨为粉末备用.MoS2-Fe3O4纳米颗粒(MoS2-Fe3O4NPs)的制备:将MoS2纳米片与Fe3O4纳米颗粒物理混合、研磨均匀后备用.
1.4 水体中H2O2的检测
MoS2-Fe3O4复合物水凝胶具有高类过氧化物酶活性是基于Fe3O4和MoS2具有协同的催化作用,且水凝胶三维结构的构建使更多的催化位点暴露,促进含氧自由基的产生,有利于氧化底物3,3′,5,5′-四甲基联苯胺(TMB)形成蓝色产物,进一步提高反应体系的催化性能.通过构建比色传感平台可以实现水中H2O2的比色检测(检测过程如图1所示).
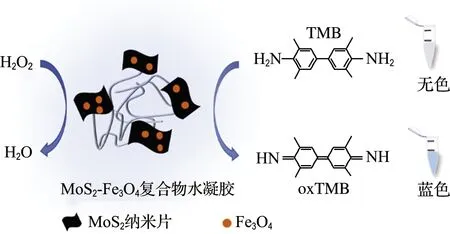
图1 MoS2-Fe3O4复合物水凝胶的H2O2检测 示意图Fig.1 Schematic illustration of MoS2-Fe3O4 composite hydrogel detect for H2O2
为得到最佳的检测效果,对显色反应的时间(3、5、10、30、40、60、75、90 min)、缓冲液pH(3.6、4.0、4.4、4.8、5.2、5.6、6.0、7.2、7.8)、反应温度(25、30、35、45、55、65 ℃)、TMB浓度(0.05、0.1、0.5、1.0、2.5、5.0、10.0、12.5、17.5 mmol/L)进行优化.通过优化实验得到最佳检测条件后,进行水体中的H2O2检测.检测过程为将960 μL的乙酸-乙酸钠(0.2 mol/L,pH=4.0)缓冲溶液,加入20 μL的MoS2-Fe3O4复合物水凝胶溶液(0.1 mg/mL),与60 μL TMB(10 mmol/L)和60 μL 不同浓度的H2O2溶液(1~2.5 mmol/L)均匀混合,混合溶液在35 ℃下反应40 min,随后转移到石英比色皿中,测量体系在652 nm处的吸光度.若无特别注明,后续实验均在该实验条件下进行.
1.5 实际水体中H2O2的比色传感检测
为探索MoS2-Fe3O4复合物水凝胶在实际水体中的应用性能,进行实验室自来水、西山水库(中国,大连)和渤海沿海岸(中国,大连)等实际水体中H2O2的检测.其中水库水样和海水水样先用0.2 μm孔径的滤膜过滤去除微生物细胞和悬浮颗粒杂质.随后将自来水、预处理过的湖水和海水作为溶剂,分别制备H2O2浓度为10、50、150 μmol/L的加标样品,后续实验按照1.4中的步骤进行.
2 结果与讨论
2.1 MoS2纳米片和MoS2-Fe3O4复合物水凝胶形貌表征
通过电镜观察MoS2纳米片及MoS2-Fe3O4复合物水凝胶的微观形貌.如图2(a)、(b)所示,超声剥离法制备的MoS2纳米片具有薄的片层结构[20].图2(c)显示MoS2-Fe3O4复合物水凝胶具有三维结构,并且Fe3O4纳米颗粒原位生长在MoS2纳米片表面.通过EDS进一步观察复合材料的元素分布,如图3所示,S、Mo、Fe、O元素的重叠部分与Fe3O4和MoS2位置(图2(c))一致,说明MoS2-Fe3O4复合物水凝胶制备过程中Fe3O4成功修饰在MoS2表面.

(a) MoS2纳米片SEM图

(b) MoS2纳米片TEM图

(c) MoS2-Fe3O4复合物水凝胶SEM图
图4为MoS2纳米片及MoS2-Fe3O4复合物水凝胶的X射线衍射图.在MoS2纳米片的谱图中,观察到14.38°、32.68°、39.54°、49.79°、58.34°等特征峰,分别对应于MoS2纳米片的(002)、(100)、(103)、(105)、(110)晶面(PDF#37-1492)[21],表明经过超声剥离后的MoS2纳米片具有六边形对称晶型结构.如图4所示,MoS2-Fe3O4复合物水凝胶的谱图中,观察到MoS2纳米片的特征峰,表明复合物中MoS2纳米片无明显的晶型变化.另外,32.86°、38.27°、45.19°、55.22°、65.86°特征峰分别对应Fe3O4的(222)、(400)、(332)、(440)、(622)晶面(PDF#39-0238)[22],表明Fe2+/Fe3+组分在MoS2-Fe3O4复合物水凝胶制备过程中转化为Fe3O4.

图3 MoS2-Fe3O4复合物水凝胶的EDS元素分布Fig.3 EDS element distribution of MoS2-Fe3O4 composite hydrogel

图4 MoS2-Fe3O4复合物水凝胶和MoS2纳米片 的XRD谱图Fig.4 XRD pattern of MoS2-Fe3O4 composite hydrogel and MoS2 nanosheets
通过X射线光电子能谱(XPS)进一步分析MoS2-Fe3O4复合物水凝胶的元素组成和价态.图5(a)中MoS2-Fe3O4复合物水凝胶的全谱图显示了C、O、Fe、S、Mo元素的存在.图5(b)、(c)、(d)显示了S、Mo和Fe元素的高分辨率XPS.如图5(b)所示S2p的XPS,在165.3 eV和162.5 eV处的特征峰对应于S2-的S2p1/2和S2p3/2轨道[23].图5(c)中Mo元素的高分辨率XPS在232.2 eV和229.1 eV处显示两个特征峰,分别对应于Mo4+的Mo3d3/2和Mo3d5/2,同时在235.7 eV处观察到较低强度的特征峰对应于Mo6+的Mo2d3/2.图5(d)中Fe2p的相关图谱显示,在727.2 eV和724.4 eV处的特征峰对应于Fe2p1/2,在714.2 eV和711.1 eV处的特征峰与Fe2p3/2相关,表明MoS2-Fe3O4复合物水凝胶包含Fe2+和Fe3+两种氧化态[24].
2.2 MoS2-Fe3O4复合物水凝胶类过氧化物酶活性研究
本实验采用典型的TMB-H2O2显色反应体系,来研究MoS2-Fe3O4复合物水凝胶的类过氧化物酶活性.从图6观察到,当反应体系为TMB和H2O2时,652 nm处的吸光度没有发生变化,说明没有发生氧化反应;当反应体系中加入MoS2-Fe3O4复合物水凝胶时吸光度显著提高,表明其具有类过氧化物酶活性.在催化H2O2-TMB显色反应中,MoS2-Fe3O4复合物水凝胶相较于MoS2纳米片和Fe3O4纳米颗粒表现出更高的类过氧化物酶活性,说明MoS2与Fe3O4协同催化作用有利于提高催化活性,这归因于Mo4+/Mo6+和Fe3+/Fe2+相互促进转化的机制[24],如以下反应式所示:

(a) 全谱
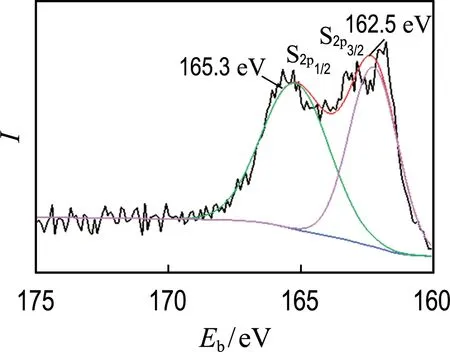
(b) S2p

(c) Mo3d

(d) Fe2p
Mo4++H2O2→Mo6++OH-+·OH
(1)
Mo4++Fe3+→Fe2++Mo6+
(2)
Mo6++H2O2→Mo4++H2O+O2
(3)
Fe2++H2O2→Fe3++OH-+·OH
(4)
Fe3++H2O2→Fe2++H++HOO·
(5)
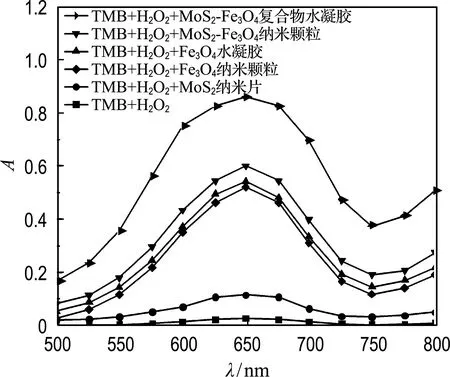
图6 不同比色反应体系的吸光度谱图Fig.6 The absorbance spectra of different colorimetric reaction systems
Mo4+/Mo6+与Fe2+/Fe3+可以催化H2O2产生·OH和HOO·,且体系中的Mo4+与Fe3+反应促进了Mo4+/Mo6+和Fe3+/Fe2+之间的价态转化(式(2)),从而提高了催化H2O2的反应速率.同时,MoS2-Fe3O4复合物水凝胶比MoS2-Fe3O4纳米颗粒和Fe3O4水凝胶表现出更高的类过氧化物酶活性,这是由于构建三维水凝胶结构暴露了更多的催化位点,进一步提高了类过氧化物酶活性.
2.3 H2O2检测条件的优化
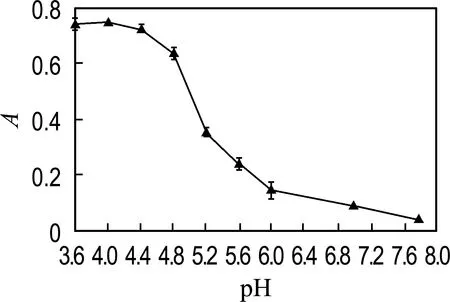
对反应时间、TMB浓度、反应温度、缓冲液pH进行优化.如图7(a)所示,反应时间在3~40 min,显色底物TMB的吸收峰强度随时间增加而增大,在40 min后无明显变化,因此选用40 min 为最佳反应时间.图7(b)显示吸光度随TMB浓度(0.05~17.5 mmol/L)的增加而增大,在10 mmol/L后无明显变化,因此选用10 mmol/L 进行后续实验.从图7(c)可以看出,当反应温度从25 ℃上升至55 ℃,吸收峰强度随温度升高而增大,反应温度高于55 ℃后有所下降.其中吸光度在25~35 ℃增加0.06,而在35~55 ℃增加0.03,变化幅度不明显.研究表明HRP在35 ℃下具有最佳的催化活性[25],而本文设计的MoS2-Fe3O4复合物水凝胶是模拟HRP的纳米酶,当温度高于35 ℃继续升温时,材料的催化活性提高不明显,因此在35 ℃下进行H2O2的比色检测.图7(d)显示当反应体系pH为4.0,吸收峰强度最大.因此实验的最佳检测条件:反应时间为40 min,TMB浓度为10 mmol/L,反应温度为35 ℃,pH为4.0.

(a) 反应时间

(b) TMB浓度
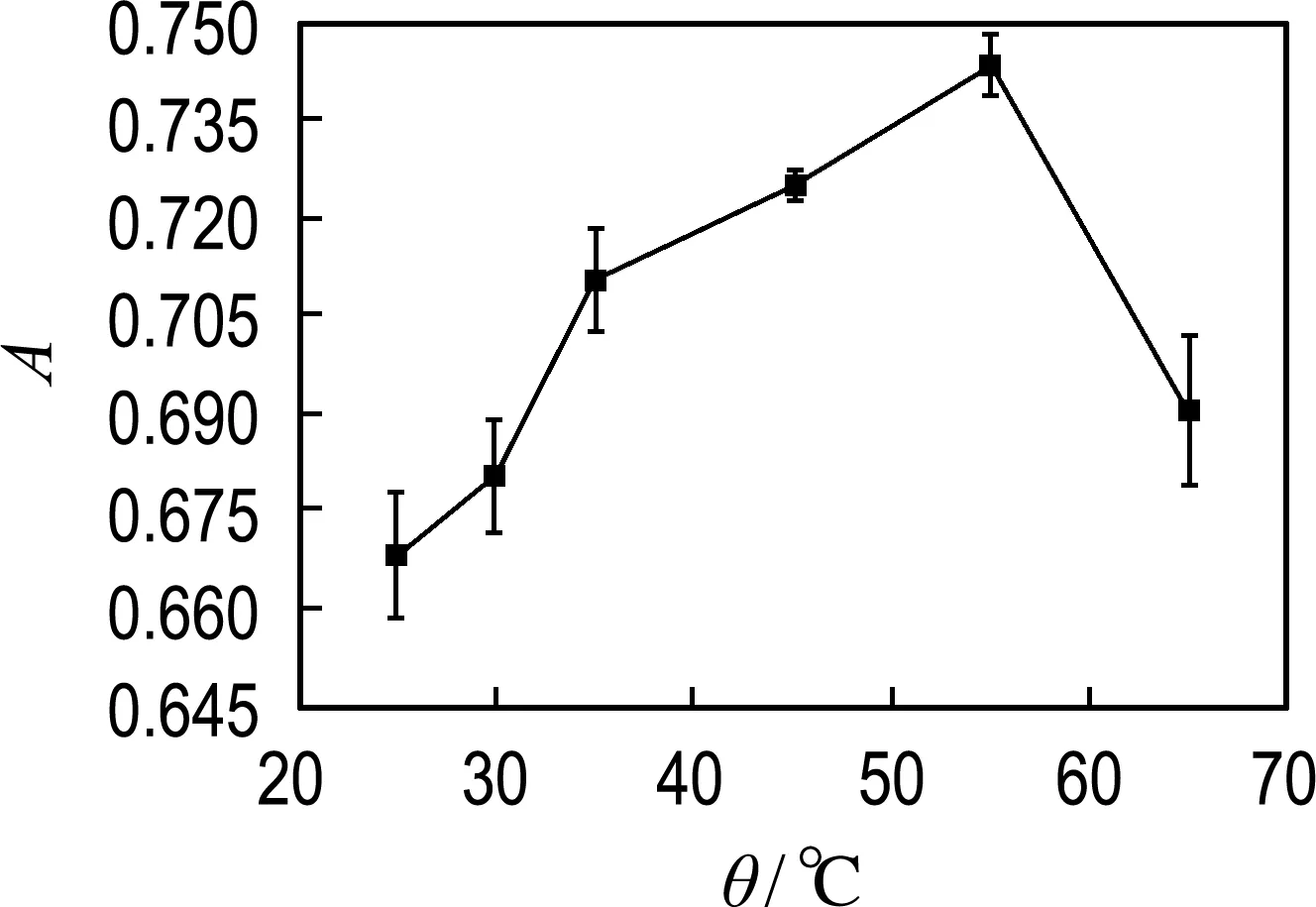
(c) 反应温度
(d) pH
2.4 MoS2-Fe3O4复合物水凝胶类过氧化物酶活性动力学分析
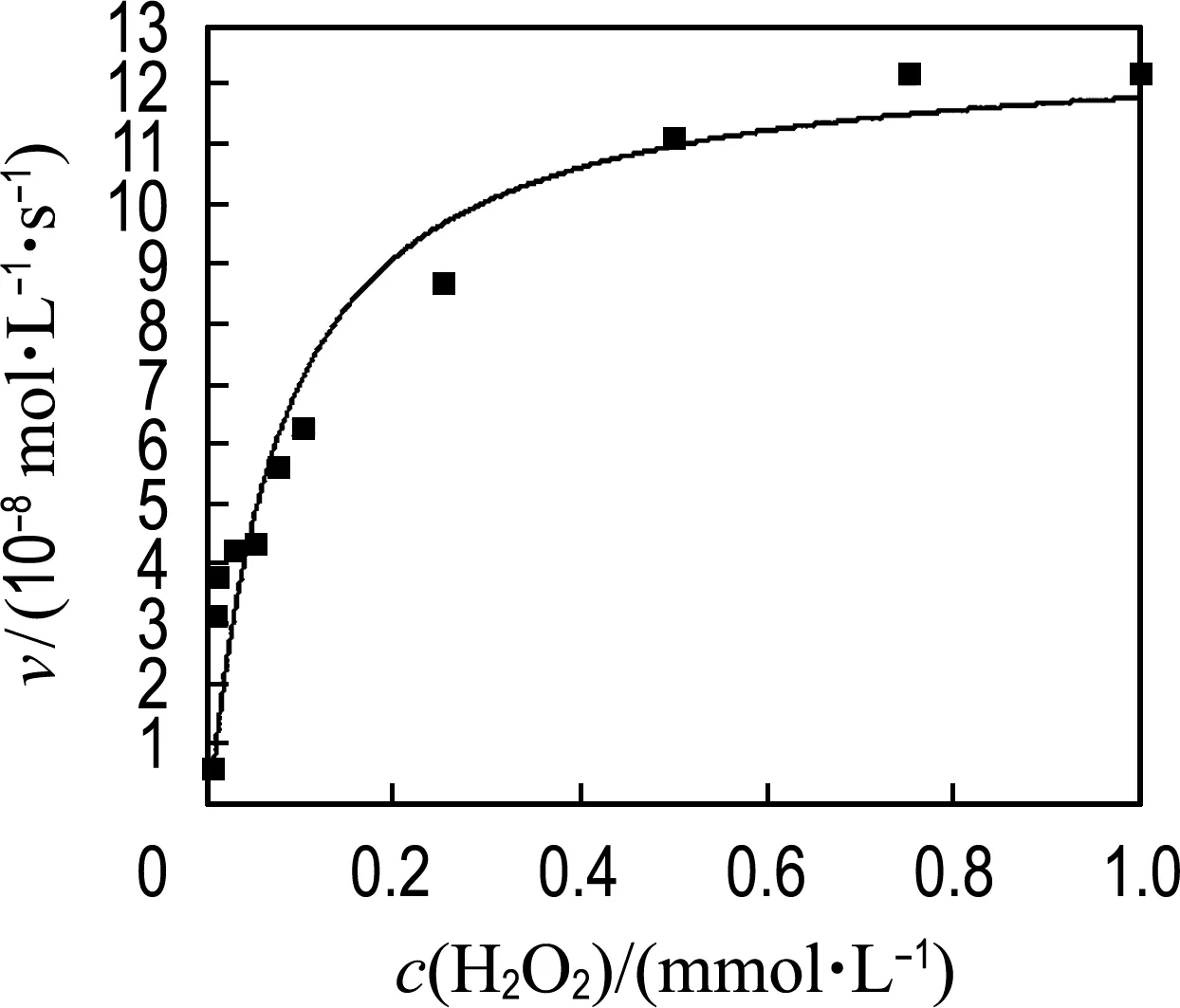
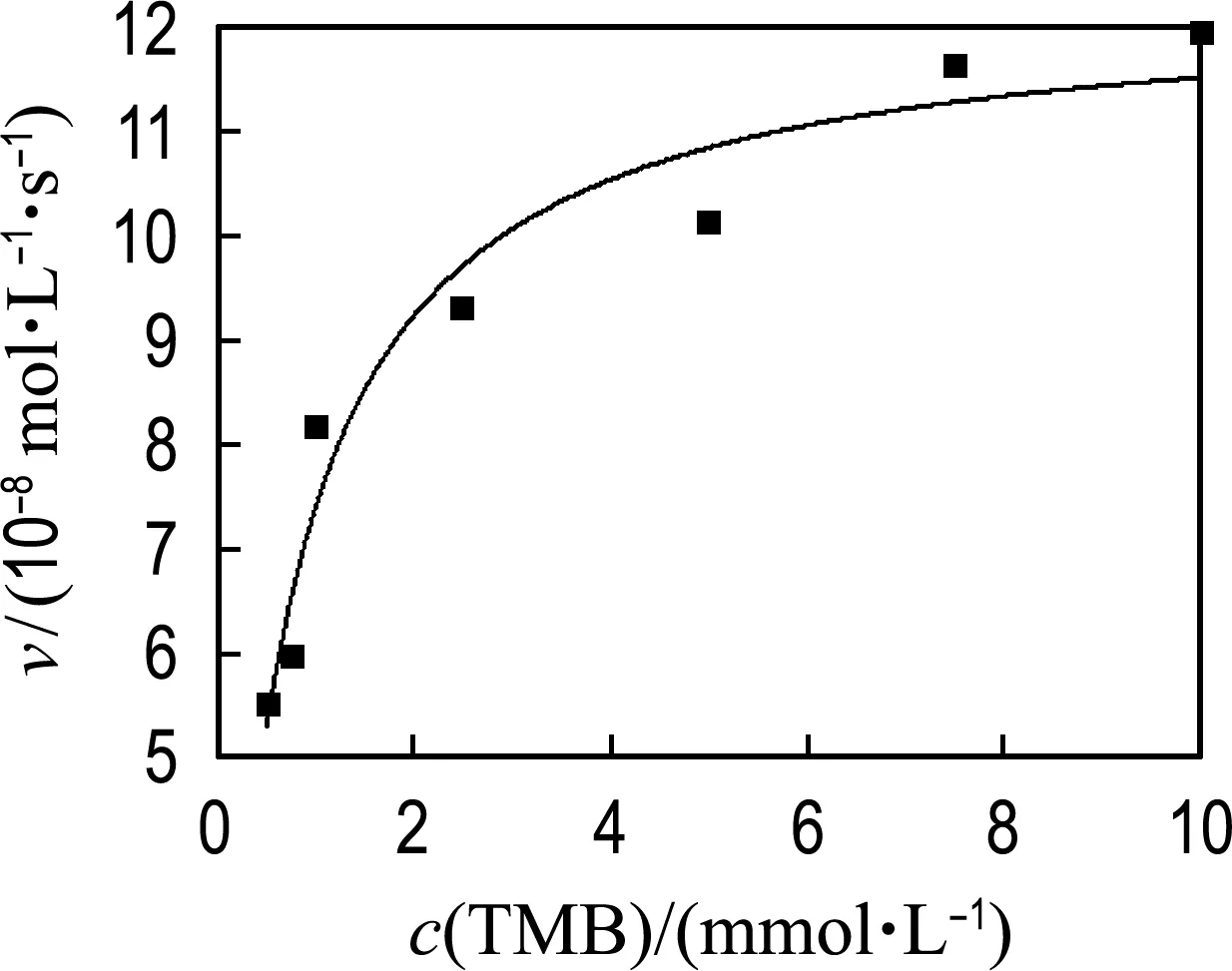
为进一步研究MoS2-Fe3O4复合物水凝胶的催化机理,在最佳优化条件下以TMB和H2O2为底物分析了动力学常数.如图8所示,MoS2-Fe3O4复合物水凝胶催化TMB和H2O2在一定浓度范围内遵循典型的Michaelis-Menten模型[26-27].Michaelis-Menten方程如下:
v0=vmaxcs/(Km+cs)
(6)
式中:v0是初始反应速率,vmax是最大反应速率,cs是底物浓度,Km是Michaelis-Menten常数.通常,Km表示催化剂与底物的结合能力,Km越小意味着催化剂与底物的亲和力越好.本文通过拟合方程计算最大反应速率(vmax)和Km.为了对比不同材料的催化活性,表1列举了MoS2纳米片、Fe3O4纳米颗粒、HRP以及MoS2-Fe3O4复合物水凝胶的Km和vmax的对比结果.对比发现,以TMB为底物时,MoS2-Fe3O4复合物水凝胶的vmax分别是MoS2纳米片的2.4倍、SDS-MoS2纳米颗粒的7.7倍、Fe3O4纳米颗粒的7.2倍、HRP的1.2倍,而MoS2-Fe3O4复合物水凝胶与上述类过氧化物酶材料的Km相差不大,说明反应过程中MoS2-Fe3O4复合物水凝胶的催化活性起主导作用,表明构建的MoS2-Fe3O4复合物水凝胶三维结构有效增加了催化位点的暴露,提高了类过氧化物酶活性.同时,以H2O2为底物时,MoS2-Fe3O4复合物水凝胶的Km是Fe3O4纳米颗粒的31.2%、是MoS2-Fe3O4纳米颗粒的3.12%、是HRP的2.1%,vmax是MoS2纳米片的3.0倍、Fe3O4纳米颗粒的2.7倍、MoS2-Fe3O4纳米颗粒的2.4倍、HRP的1.5倍,表明MoS2-Fe3O4复合物水凝胶与H2O2底物具有较好的结合能力,且在催化反应中MoS2和Fe3O4具有协同催化作用,从而提高了材料的催化性能.
(a) H2O2
(b) TMB

表1 MoS2-Fe3O4复合物水凝胶与其他纳米酶和HRP的动力学参数比较
2.5 MoS2-Fe3O4复合物水凝胶比色检测H2O2
基于MoS2-Fe3O4复合物水凝胶材料良好的类过氧化物酶活性,将其设计为比色传感平台用于检测水体中H2O2.如图9所示,H2O2浓度在1~2 500 μmol/L,反应体系在652 nm处(oxTMB 的特征吸收峰)与吸光度呈现良好的正相关关系.内插图为H2O2浓度与吸收峰强度的线性响应关系,拟合方程为A=0.16+0.002 3c(H2O2),相关系数R2为0.992.对数据线性拟合得到,H2O2检测的线性范围为3.0~200 μmol/L,检测限(LOD)为0.28 μmol/L(3δ/s).进一步与已报道的基于MoS2-Fe3O4以及MoS2-Fe3O4纳米颗粒的比色方法进行比较,发现本文构建的MoS2-Fe3O4复合物水凝胶的检测限(LOD)较低(表2).
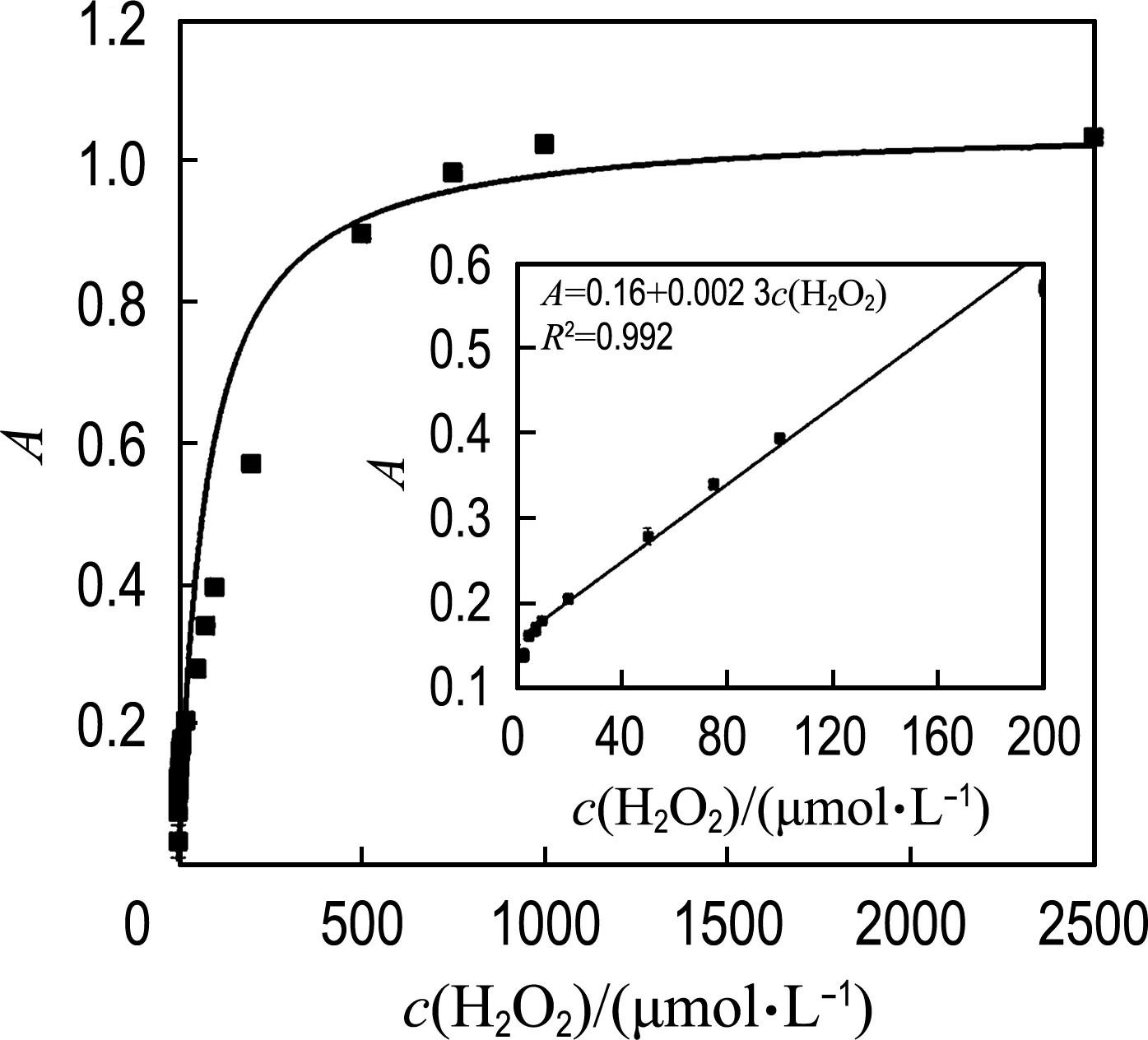
图9 652 nm处随H2O2浓度变化体系吸光 度曲线Fig.9 The absorbance curve at 652 nm as a function of concentration of H2O2
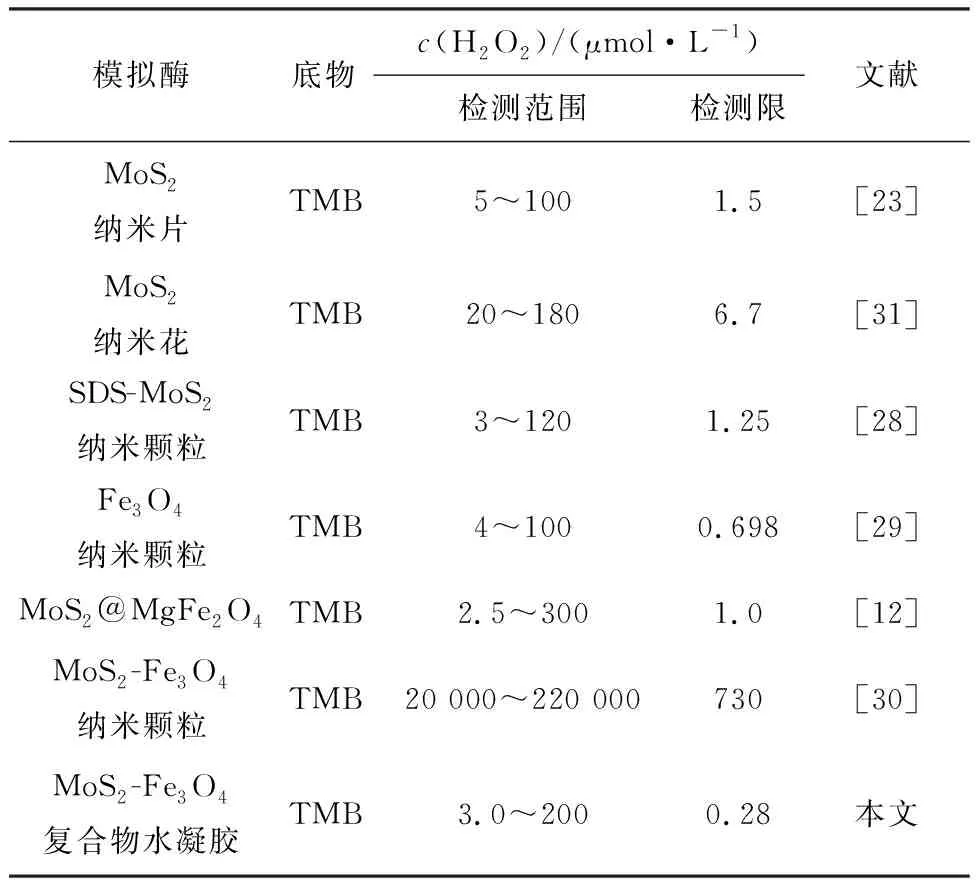
表2 不同类过氧化物纳米酶的H2O2检测性能对比Tab.2 Comparison of different peroxidase-like nanozymes for H2O2 detection
2.6 实际水体中H2O2的检测
采用加标回收法测定自来水、湖水和海水中的H2O2,对该传感方法在实际水环境中检测H2O2的可行性进行评估.实际水样经过前处理后,采用加标回收法进行检测,3种水样分别投加10、100、150 μmol/L的H2O2制备人工水样.在最佳实验条件下,对加标样品进行测定.如表3所示,经过3次重复实验,计算得到自来水和湖水的平均回收率在93.1%~98.2%,相对标准偏差值为0.4%~8.0%,达到了较好的H2O2检测效果.另外,海水体系中10 μmol/L H2O2的回收率(81.0%)低于自来水的(98.0%)和湖水的(96.0%),相对标准偏差(10.8%)高于自来水的(6.0%)和湖水的(8.0%),这是由于海水基质较为复杂,含氧自由基与金属离子存在竞争关系,从而影响H2O2的检测效果[32].

表3 实际水体中H2O2的检测Tab.3 H2O2 detection in actual waters
3 结 语
本文采用化学共沉淀法制备了MoS2-Fe3O4复合物水凝胶,并通过SEM、TEM、EDS、XRD、XPS对材料的形貌结构和元素价态进行表征,证明MoS2-Fe3O4复合物水凝胶的成功制备.同时考察了该水凝胶材料的类过氧化物酶活性以及检测条件对催化活性的影响,将其用于检测水体中H2O2,线性范围为3.0~200 μmol/L,检测限为0.28 μmol/L.采用加标回收法对实际水体(自来水、湖水和海水)中的H2O2进行检测,回收率为81.0%~98.2%,相对标准偏差值为0.4%~10.8%,具有检测不同类型实际水体中H2O2的应用潜力.
