血清生物标志物对纤维化性间质性肺疾病预后的预测价值
2022-01-27赵铁梅段智梅刘凯迪圣朝军
赵铁梅,段智梅,刘 扬,刘凯迪,华 琳,圣朝军
(1.中国人民解放军总医院呼吸与危重症医学部,北京 100853;2.首都医科大学生物医学信息学系,北京 100069)
纤维化性间质性肺疾病(fibrosing interstitial lung disease,FILD)是一组具有不同的病因、治疗方法以及一系列疾病表现的异质性疾病,包括特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)、结缔组织病相关间质性肺病(interstitial lung disease associated with connective tissue diseases,CTD-ILD)、非特异性间质性肺炎、纤维化型过敏性肺炎、Ⅳ期结节病等。2018年英国学者Wells等[1]指出在FILD中有一部分患者会进行性发展,预后不佳,并首次提出了进行性纤维化型的概念,引起越来越多的学者关注和研究。不论何种致病原因导致的肺纤维化,肺泡上皮细胞的损伤与修复在FILD的致病过程中占据重要地位。因此,本研究对FILD的患者进行前瞻性研究和随访,检测五种与肺泡上皮细胞功能障碍相关的生物标志物并进行病情进展及死亡的风险预测,给临床医生提供指导。
1 资料与方法
1.1一般资料 收集中国人民解放军总医院2019年5—12月呼吸科诊断为FILD患者的临床资料,包括性别、年龄、吸烟情况、症状、基础疾病等,行肺CT、肺功能检查,之后抽血进行生物标志物检测。随访至1年行病情评估。
本研究经医院伦理委员会审批通过,患者知情同意并签署知情同意书。
1.2入组和疾病诊断标准
1.2.1纳入标准与排除标准 纳入标准:①肺部高分辨CT(high resolution CT,HRCT)表现为肺纤维化[2-3]:网状影伴牵拉性支气管扩张,伴或不伴有蜂窝影;②签署知情同意书。排除标准:不愿行HRCT检查、不愿入组的患者。
1.2.2疾病诊断标准 IPF的诊断参照2018年Fleischner学会发表的特发性肺纤维化诊断标准[4]。结缔组织病参照各自的分类标准明确诊断,原发性干燥综合征[5]、系统性硬化症[6]、类风湿关节炎[7]、混合性结缔组织病[8]均采用相应的国际通用诊断标准进行诊断。
1.2.3病情评估标准及分组 FILD按照随访至1年时的病情评估结果分为稳定、进行性纤维化型、死亡、无法评估四组。满足下列1条判断为进行性纤维化型[9]:①用力肺活量(forced vital capacity,FVC)相对下降≥10%;②FVC相对下降≥5%,肺一氧化碳弥散量(diffusion capacity of carbon monoxide,DLCO)下降≥15%;③FVC相对下降≥5%, HRCT显示纤维化增加;④FVC相对下降≥5%,症状加重;⑤症状加重,HRCT显示肺纤维化增加。除外死亡患者,未达到进行性纤维化型标准的判断为病情稳定;在后期随访时不愿再行肺CT、肺功能检查的归为“无法评估”。
1.3方法
1.3.1血清标本的收集 空腹采集静脉血4 mL,3 000 r/min离心10 min,分离血清。
1.3.2生物标志物检测方法 糖蛋白抗原19-9(carbohydrate antigen 19-9,CA19-9)、糖蛋白抗原125(carbohydrate antigen-125,CA-125)、糖蛋白抗原15-3(carbohydrate antigen 15-3,CA15-3)由我院生化科进行检测,采用罗氏公司的电化学发光法;涎液化糖链抗原6(Krebs von den Lungen-6,KL-6)由北京迪安医学检验实验室有限公司采用化学发光法进行检测;表面活性蛋白A(surfactant protein,SP-A)应用武汉伊莱瑞特生物科技股份有限公司生产的人肺表面活性蛋白A检测试剂盒,采用酶联免疫吸附测定方法进行检测。操作严格按照仪器和试剂盒说明书进行。
1.4统计学方法 应用SPSS 19.0软件和R3.6.1软件进行统计分析。各组生物标志物检测结果采用中位数和四分位数间距表示,组间比较采用非参数Kruskal-Wallis H检验,采用竞争风险模型的生存分析和Fine-Gray回归模型提取发展为进行性纤维化型和死亡风险的影响因素。P<0.05为差异有统计学意义。
2 结 果
2.1一般资料 共入组58例患者,男性39例,女性19例,年龄32~90岁,平均(67.38±12.12)岁,其中吸烟29例,吸烟患者的吸烟年支平均为688.96±620.54。35例(60.34%)诊断为IPF,14例(24.14%)诊断为CTD-ILD,9例(15.52%)不能诊断为IPF和CTD-ILD的患者归为其他原因所致的肺纤维化。43例(74.14%)的患者合并基础疾病,常见的基础疾病为肺气肿和(或)肺大疱21例(36.21%)、胃食管反流20例(34.48%)、高血压病18例(31.03%)、糖尿病17例(29.31%)和冠心病12例(20.69%)。主要基线肺功能指标:FVC占预计值的%平均为(79.57±19.93)%,DLCO占预计值的%平均为(60.45±21.37)%。
2.2病情评估结果 随访至1年,25例(43.10%)患者病情评估为稳定;12例(20.69%)发展为进行性纤维化型;8例(13.79%)死亡;13例(22.41%)患者归为“无法评估”。
2.3血清生物标志物检测结果 进行性纤维化型、死亡患者的CA19-9、CA-125、CA15-3和KL-6基线检测数值的中位数都高于病情评估为稳定的患者,但差异无统计学意义(P>0.05),见表1。
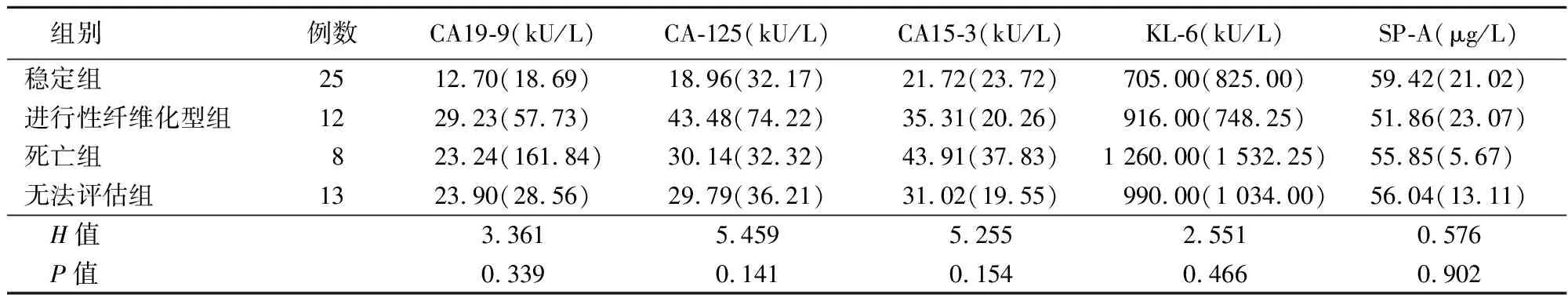
表1 纤维化性间质性肺疾病患者生物标志物检测结果Table 1 Detection of biomarkers in patients with fibrosing interstitial lung disease [M(QR)]
2.4基于竞争风险模型的分析结果
2.4.1单因素分析结果 CA125基线增高是发展为进行性纤维化型的风险因素(表2);CA199基线增高是死亡的风险因素(表3)。
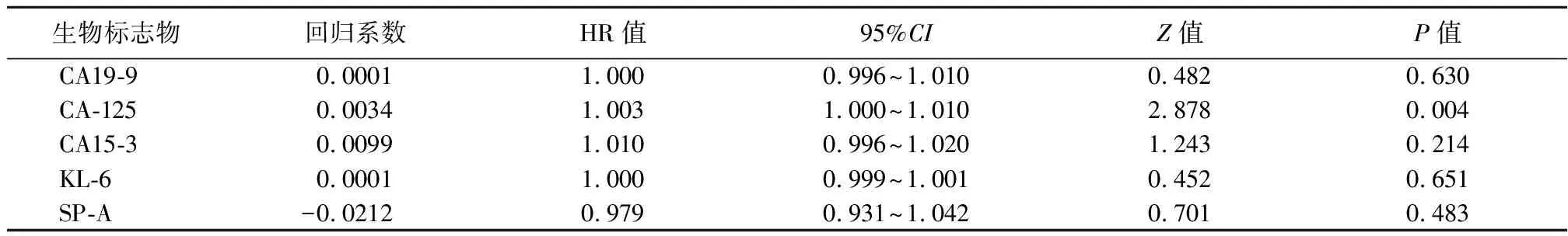
表2 进行性纤维化性间质性肺疾病的风险因素Table 2 Risk factors of progressive fibrosing interstitial lung disease
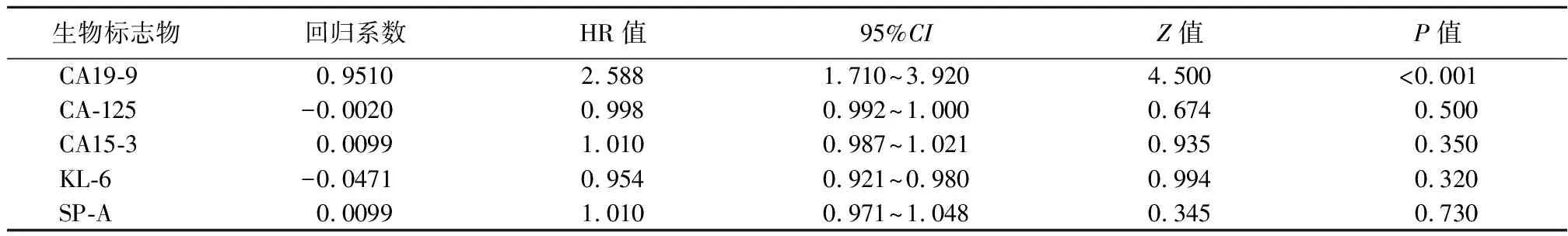
表3 纤维化性间质性肺疾病死亡的风险因素Table 3 Risk factors of death in patients with fibrosing interstitial lung disease
2.4.2多因素分析结果 将单因素分析结果显著的因素采用Fine-Gray竞争风险回归模型作多因素分析,结果显示:CA125不是发展为进行性纤维化型的风险因素,回归系数0.003,HR 1.003,95%CI:0.999~1.010,Z值=1.341,P=0.180;CA19-9是死亡的风险因素,回归系数0.007,HR 1.007,95%CI:1.001~1.061,Z值=2.014,P=0.044。
3 讨 论
FILD总体预后不佳,在FILD中最典型的IPF本身就是一种随着肺功能逐渐恶化的致死性疾病,诊断后中位生存期3~5年。近三年,非IPF的FILD越来越受到临床医生的关注,荷兰学者Wijsenbeek邀请美国、日本、德国、法国、英国、意大利、西班牙的486名呼吸科、风湿免疫科和内科医生进行在线调查,结果显示:18%~32%的非IPF的FILD可以发展为进行性纤维化型,从诊断为间质性肺疾病到发展为进行性纤维化型需要11~15个月,诊断为进行性纤维化型后这些患者的生存时间仅有30~45个月,同样预后不佳[10]。本研究也显示:随访至1年,20.69%的FILD患者发展为进行性纤维化型,13.79%患者死亡,与国外学者的报道相仿;因此,探寻可预测发展为进行性纤维化型的风险因素,及时发现病情进展,给予积极治疗,对改善患者预后至关重要。
既往的研究显示,与肺泡上皮细胞功能障碍相关的生物标志物对FILD的预后有一定的指导作用。在健康人群中,支气管上皮细胞可分泌小剂量CA19-9和CA-125;上皮细胞损伤后支气管和肺泡上皮细胞可产生丰富的CA19-9和CA-125,与上皮细胞再生有关。英国学者Maher等[11]对IPF患者进行了研究,应用1年内出现死亡或FVC%下降≥10%判断为病情进展,结果显示:CA19-9、CA-125升高可以预测IPF的预后,疾病进展的IPF患者基线CA19-9的水平高于稳定患者,分别为53.7 kU/L和22.2 kU/L(P<0.001);基线CA-125水平在稳定和疾病进展的患者中同样有差异(组间比1.26,95%CI:1.05~1.51,P=0.015),疾病进展患者CA-125在3月内升高大约25%以上,是检测限(2 kU/L)的2倍以上,随访3个月CA-125水平升高的患者死亡风险也增加(HR 2.542,95%CI:1.493~4.328,P=0.00059)。CA15-3是一种可由多种上皮细胞分泌的高相对分子质量糖蛋白,Moll等[12]研究显示:IPF患者基线CA15-3(56 kU/L)明显高于正常值(30 kU/L);以58.5 kU/L为截点,CA15-3增高组的中位生存期为29个月,明显低于未增高组(50个月,HR 1.67,95%CI:1.05~2.65,P=0.031)。Rusanov等[13]针对IPF患者肺移植前后的生物标志物进行检测,结果显示:肺移植后血清CA15-3、CA19-9较移植前显著下降,其中CA15-3下降最为明显,CA15-3水平与IPF患者生存率相关(P=0.04)。本研究也针对CA19-9、CA-125和CA15-3进行研究,联合应用症状、肺功能、肺CT影像进行综合评估判断是否发展为进行性纤维化型,结果显示,随访至1年,病情评估为进行性纤维化型、死亡患者的这三种生物标志物基线检测数值的中位数都高于病情评估为稳定的患者,但差异无统计学意义,需要扩大样本量进行进一步观察。采用竞争风险模型的生存分析和Fine-Gray回归模型,单因素分析显示,CA-125基线增高是发展为进行性纤维化型的风险因素,CA19-9基线增高是死亡的风险因素;多因素分析结果亦显示CA19-9是死亡的风险因素,与国外报道相仿。与检测肺泡灌洗液、肺组织中的生物标志物相比,应用血清进行检测方便易行,提示我们可使用CA-125、CA19-9作为FILD患者的预后指标进行基线评估和动态随访,给临床医生提供指导。
近几年在间质性肺疾病的研究中,KL-6和SP-A是比较受关注的生物标志物。KL-6是一种黏蛋白样高相对分子质量糖蛋白,表达于肺泡上皮细胞表面,当肺泡上皮细胞增殖、活化或损伤时,KL-6被释放到血液中。韩国学者Ko等[14]对间质性肺疾病(包括不能分类的间质性肺疾病、IPF、CTD-ILD、隐源性机化性肺炎等)进行研究,应用FVC%下降≥10%,出现急性加重或死亡判断为病情进展,平均随访11.1个月,多因素分析显示,血清KL-6>800 kU/L是间质性肺疾病进展的独立危险因素(HR 2.689,95%CI:1.445~5.004,P=0.002)。我国的广州地区研究也显示[15]:在多种间质性肺疾病中,KL-6水平在病情进展的患者中明显高于未发生进展者[分别为(1 985.2±1 497.8) kU/L、(1 387.6±1 313.1) kU/L,P<0.001];多因素分析显示KL-6与生存相关(相对危险度1.901,95%CI:1.294~2.793,P<0.001)。表面活性蛋白由肺泡Ⅱ型上皮细胞合成和分泌,同时肺泡Ⅱ型上皮细胞也参与表面活性物质的摄取、分解代谢和再利用;表面活性蛋白在内质网和胞浆中的积累导致内质网的慢性应激,在肺泡Ⅱ型上皮细胞凋亡和肺纤维化的发生、发展中起着关键作用。日本学者Yoshikawa等[16]研究显示,血清SP-A水平的变化可以预测IPF患者的预后,随访6个月时,临床进展组SP-A水平显著高于临床稳定组;与基线值相比,临床进展组SP-A平均升高20.2%,临床稳定组平均下降10.2%。在本研究中,未观察到基线KL-6、SP-A与病情进展或死亡的风险相关,提示基线KL-6、SP-A的水平对进行性纤维化型的预测价值有限,但也不除外与样本量偏小有关,需要进一步扩大样本量并进行长程随访观察上述指标动态的变化作进一步的研究。
综上所述,FILD患者的预后不佳,20.69%可发展为进行性纤维化型,13.79%死亡。CA-125基线增高的患者发展为进行性纤维化型的风险更高,CA19-9基线增高的患者死亡风险更高,值得临床医生关注。
