茶树SBP-box转录因子的比较基因组学与遗传分析
2022-01-26谷梦雅侯炳豪王鹏杰张兴坦叶乃兴
谷梦雅,侯炳豪,王鹏杰,,高 婷,张兴坦,叶乃兴*
(1 福建农林大学 园艺学院/茶学福建省高校重点实验室,福州 350002; 2 中国农业科学院 深圳农业基因组研究所,广东深圳 518120)
Squamosa启动子结合蛋白(SBP-box)基因是植物特有的一类转录因子,也称SPL(squamosa promoter binding protein-like),包含高度保守的SBP结构域[1]。该结构域包含约76个氨基酸残基,包括2个Zn2+结合位点(Cys-Cys-His-Cys和Cys-Cys-Cys-His)和1个核定位信号(NLS)[2]。SBP-box基因首次从金鱼草的花序cDNA文库中分离,并发现SQUAMOSA的启动子可以和某种核内蛋白发生特异结合激活该基因的转录[3]。目前已在其他植物中得到鉴定,如拟南芥[4]、番茄[5]和杨树[6]等。在植物中,SBP-box基因参与了不同的生长发育过程,包括调控开花[7]、控制植物由营养生长向生殖生长的转化[8]和调控植物的胁迫应答[9]等。目前SBP转录因子在茶树中的研究较少,刘亚芹等[10]从茶树中克隆出CsSPL6和CsSPL9,发现Csn-miR156a可能通过负调控CsSPL6和CsSPL9参与茶树生长过程,并下调CsSPL9来增加耐高温性。前人对SBP转录因子的鉴定主要是在组装水平较低的茶树基因组水平上且研究集中在SBP基因对茶树非生物胁迫和激素的响应[11-12],关于SBP转录因子在茶树杂种优势方面的研究却未见报道。
杂种优势是指杂种后代在生长势、生物量、抗逆性和适应性等方面优于亲本的现象,国外学者曾提出显性、超显性和上位性等3个经典的假说[13],然而这些假说不足以完全解释其分子机制。茶树[Camelliasinensis(L.)O. Kuntze]是多年生异花授粉植物,‘铁观音’和‘黄棪’是乌龙茶的主栽品种,因其制茶品质优异成为乌龙茶育种的重要亲本[14],前人以‘铁观音’为母本,‘黄棪’为父本,从F1中选育出‘金观音’、‘黄观音’、‘金玫瑰’、‘金牡丹’等早生优质新品种[15]。郭吉春等[16]研究表明‘金观音’和‘黄观音’超亲优势强、产量高;杨军等[17]对‘紫玫瑰’、‘金观音’、‘金牡丹’、‘悦茗香’及其自然杂交后代的群体遗传结构研究表明自然杂交后代有较强母本遗传效应,4个群体具有明显的群体遗传组成特征,然而对茶树杂种优势的分子方面研究几乎是空白。课题组前期研究表明‘金观音’和‘黄观音’在挥发性代谢物上具有显著的杂种优势[18],另外与生长发育相关的TGY15和TGY283等超高亲基因,在‘金观音’中的表达量均高于其亲本[19]。本课题组前期通过qRT-PCR检测GRF基因家族在不同茶树品种间的表达,发现CsGRF2、CsGRF5、CsGRF14等在‘黄观音’、‘紫玫瑰’中呈现优势表达,可能与茶树生长势杂种优势的形成有关[20]。此外,杂交子代基因与亲本基因表达模式的关系可分为加性和非加性,加性表达即中亲表达,而超高亲、低于双亲、偏高亲和偏低亲等4种表达模式属于非加性表达,研究发现非加性表达基因在茶树挥发性杂种优势中起着关键作用[18],且非加性表达基因可能受到转录因子(TF)等调控因子的影响[21]。
CsSBP在茶树杂种优势调控中的作用尚不清楚,且SBP基因数量在茶树中是否具有普遍性仍不明确。因此本研究基于最新组装破译的染色体级别的茶树‘铁观音’和‘黄棪’基因组,对茶树‘铁观音’基因组中SBP基因进行了系统鉴定和生物信息学分析,并对‘黄棪’、‘舒茶早’和‘龙井43’等3个不同茶树基因组的SBP基因进行鉴定和比较,包括系统发育与共线性分析等。此外,通过荧光定量检测CsTGY_SBP家族成员在‘铁观音’和‘黄棪’及其F1代品种‘金观音’、‘黄观音’、‘金牡丹’、‘紫玫瑰’等嫩梢中的表达模式,并与‘铁观音’的自然杂交品种‘紫牡丹’、‘黄棪’的自然杂交品种‘瑞香’的表达量进行比较,为完善SBP基因家族的研究及其在杂种和亲本上的遗传规律提供参考。
1 材料和方法
1.1 试验材料与处理
以母本‘铁观音’(Camelliasinensis‘Tieguanyin’,TGY)、父本‘黄棪’(Camelliasinensis‘Huangdan’,HD),及杂交后代品种‘金观音’(Camelliasinensis‘Jinguanyin’,JGY)、‘黄观音’(Camelliasinensis‘Huangguanyin’,HGY)、‘金牡丹’(Camelliasinensis‘Jinmudan’,JMD)、‘紫玫瑰’(Camelliasinensis‘Zimeigui’,ZMG)和‘铁观音’自然杂交品种‘紫牡丹’(Camelliasinensis‘Zimudan’,ZMD)、‘黄棪’自然杂交品种‘瑞香’(Camelliasinensis‘Ruixiang’,RX)的一芽二叶为试验材料,并以中小开面叶为标准采摘,于2021年4月在武夷学院茶树种质资源圃取样,每个设置3次生物学重复,液氮快速固样后,保存于-80 ℃超低温冰箱。
1.2 方 法
1.2.1 茶树SBP基因家族成员的鉴定及理化分析在Pfam网站(http://pfam.xfam.org/ search# tabview=tab1)下载SBP基因家族的蛋白特征结构域SBP(PF03110)的隐马尔可夫模型,使用HMMER软件(https://plants.ensembl.org/hmmer/index.html)进行鉴定。利用Blast-P(E≤1×10-5)分别在‘铁观音’、‘黄棪’、‘舒茶早’和‘龙井43’染色体级别基因组范围内进行比对搜索。使用CDD(https://www.ncbi.nlm.nih.gov/cdd/)和SMART(http://smart.embl-heidelberg.de/)进一步鉴定SBP基因是否具有完整的SBP保守结构域。通过在线网站ExPASy(https://web.expasy.org/protparam/)分析茶树SBP蛋白的氨基酸组成、等电点、疏水性等理化性质,在线网站WoLF PSORT(https://wolfpsort.hgc.jp/)进行亚细胞定位预测。
1.2.2 系统发育分析利用在线平台WebLogo(http://weblogo.berkeley.edu/)对CsTGY_SBPs的保守结构域进行分析。从在线网站Phytozome(https://phytozome.jgi.doe.gov/pz/portal.html)获取拟南芥、水稻和葡萄SBP蛋白序列,利用其保守序列在MEGA 7.0软件上构建系统进化树,采用邻接法,Boostrap设置为1000,相同方法构建‘铁观音’、‘黄棪’、‘舒茶早’和‘龙井43’的SBP基因家族的进化树。
1.2.3 茶树SBP_box基因家族的共线性分析从Ensembl Plants网站(http://plants.ens embl.org/index.html)获取水稻、拟南芥和葡萄的基因序列和染色体文件,利用‘铁观音’与‘黄棪’、‘舒茶早’和‘龙井43’的基因序列和染色体文件,在TBtools软件上分析铁观音与水稻、拟南芥、葡萄、‘黄棪’、‘舒茶早’和‘龙井43’的SBP基因家族的共线性。
1.2.4 启动子顺式作用元件和miR156靶基因预测在TBtools软件上提取CsTGY_SBPs转录起始位点上有2 000 bp的基因序列,利用Plant CARE在线网站(http://bioinformatics.psb.ugent.be/ webtools/plantcare/html)进行顺式作用元件预测分析。使用psRNATarget网站(http://plantgrn.noble.org/psRNATarget/)对miR156的潜在靶位点CsTGY_SBP进行分析,最大期望值设为3,其他为默认值。
1.2.5 组织特异性表达分析下载茶树‘铁观音’不同组织的转录组数据,包括花、芽、嫩叶、成熟叶、茎和根,参照前人方法[22]计算FPKM值,在TBtools工具包上可视化CsTGY_SBP家族基因的表达水平。
1.2.6 实时荧光定量PCR分析筛选出CsTGY_SBP基因家族在芽和嫩叶组织中高表达的家族成员,通过primer-blast在线程序设计荧光定量引物(表1)。用TransScript试剂盒合成双链cDNA作为实时荧光定量PCR模板,以CsGAPDH(登录号GE651107)作为内参基因,使用Bio-Rad的CFX96 Touch荧光定量PCR仪进行qRT-PCR反应,反应体系和程序参照前人方法[23]。用2-ΔΔCt方法统计基因的表达水平。通过SPSS 24.0软件的单因素LSD法进行显著性分析(P<0.05)。
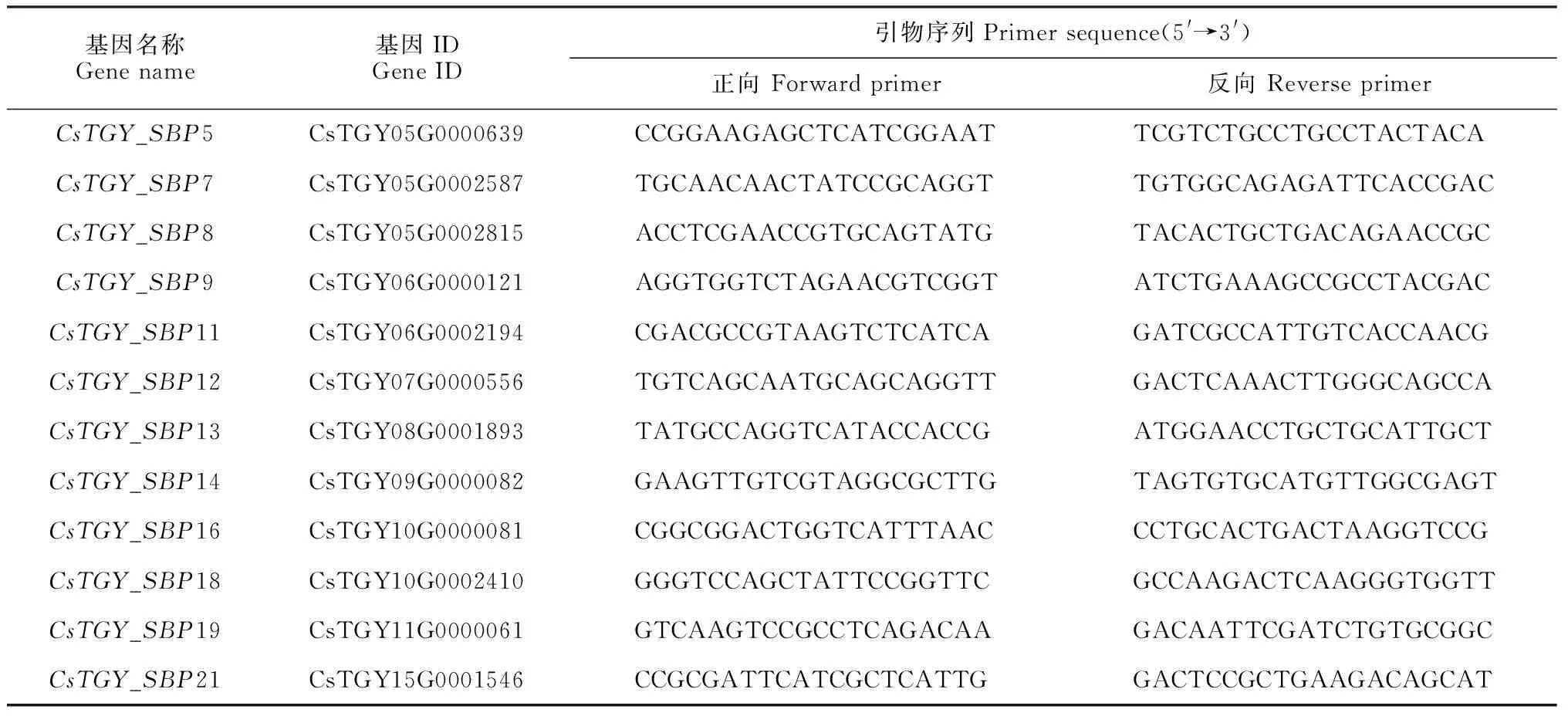
表1 引物序列
2 结果与分析
2.1 茶树SBP_box基因家族的鉴定
经过隐马尔可夫模型搜索,在‘铁观音’基因组、‘黄棪’基因组、‘舒茶早’基因组和‘龙井43’基因组分别获得21个SBP基因(命名为CsTGY_SBP1—CsTGY_SBP21)、25个SBP基因(命名为HD_SBP1—HD_SBP25)、24个SBP基因(命名为SCZ_SBP1—SCZ_SBP24)和23个SBP基因(命名为LJ43_SBP1—LJ43_SBP23)(表2)。

表2 茶树SBP基因家族氨基酸序列特征分析
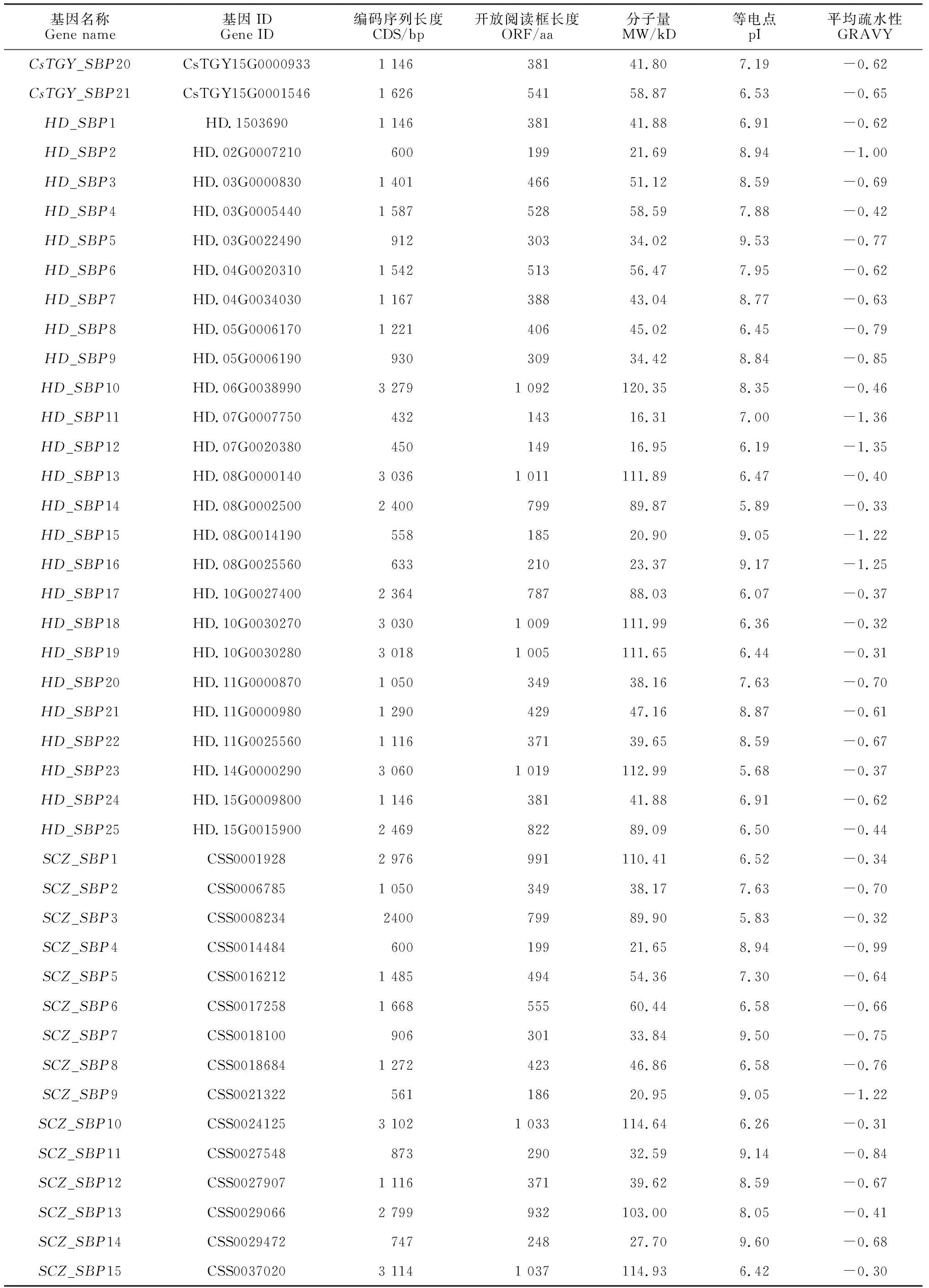
续表2 Continued Table 2
茶树SBP基因组序列的编码序列从432 bp(CsTGY_SBP13、HD_SBP11)到3 279 bp(CsTGY_SBP4、HD_SBP10、LJ43_SBP10)不等,氨基酸数量位于143(CsSBP15)到1 092(CsSBP22)之间。分子量为16.31(CsTGY_SBP13、HD_SBP11)~120.35(HD_SBP10)kD,理论等电点范围为5.56(CsTGY_SBP19)至9.60(SCZ_SBP14),59%的SBP蛋白为碱性蛋白(等电点大于7)。所有茶树SBP蛋白都是亲水性的,亲水性的平均值低于0。仅SCZ_SBP8和LJ43_SBP7定位于叶绿体中,其他茶树SBP家族成员都定位于细胞核。
2.2 茶树CsTGY_SBP家族的多序列比对和系统发育分析
对CsTGY_SBP蛋白进行多重序列比对。结果表明,21个CsTGY_SBP的SBP结构域是保守的(图1,A),所有SBP结构域都包含Cys-Cys-Cys-His(CCCH)和Cys-Cys-His-Cys(CCHC)2个锌指结构,以及1个位于碳末端的核定位信号(NLS),且所有CsTGY_SBPs的核定位序列(NLS)都高度保守。

A.CsTGY_SBP保守结构域;B.铁观音与葡萄、拟南芥和水稻的SBP基因的系统发育分析:CsTGY. ‘铁观音’;Vv. 葡萄;At. 拟南芥;Os. 水稻;C.‘铁观音’与‘黄棪’、‘舒茶早’和‘龙井43’的SBP基因的系统发育分析:CsTGY. ‘铁观音’;HD. ‘黄棪’;SCZ. ‘舒茶早’;LJ43. ‘龙井43’图1 CsTGY_SBP蛋白的SBP结构域和进化树分析A.The sequence logos of the conserved CsTGY_SBP domains; B. Phylogenetic analysis of SBP genes of CsTGY_SBP and VvSBP, AtSPL and OsSPL. CsTGY. Camellia sinensis ‘Tieguanyin’; Vv. Vitis vinifera; At. Arabidopsis thaliana; Os. Oryza sativa; C. Phylogenetic analysis of SBP genes of CsTGY_SBP and HD_SBP, SCZ_SBP and LJ43_SBP. CsTGY. Camellia sinensis ‘Tieguanyin’; HD. Camellia sinensis ‘Huangdan’; SCZ. Camellia sinensis ‘Shuchazao’; LJ43. Camellia sinensis ‘Longjing43’Fig.1 The SBP domain and phylogenetic analysis of CsTGY_SBP proteins
为了研究植物中SBP基因家族的系统发育关系,使用来自茶树、拟南芥、水稻和葡萄的74个保守的SBP结构域序列来构建系统发育树。结果表明(图1),上述4个物种的SBP基因可分为8个亚家族(Ⅰ—Ⅷ),每组至少包含拟南芥的1个成员和茶树的1个成员。除亚家族Ⅲ和亚家族Ⅵ外,其余亚家族均含有4种SBP基因,亚家族Ⅲ和亚家族Ⅵ均缺少水稻的SPL基因。此外,发现大多数的CsTGY_SBP基因与葡萄和拟南芥的基因亲缘关系更近。来自4个不同茶树品种的93个SBP基因构建系统进化树仍然分为8个亚家族(Ⅰ—Ⅷ)(图1,C),发现在‘黄棪’、‘舒茶早’和‘龙井43’基因组中均能检测到CsTGY_SBP的同源基因,且CsTGY_SBPs和HD_SBPs高度同源,意味着CsTGY_SBP基因和HD_SBP基因具有很强的进化关系。
2.3 茶树SBP家族的共线性分析
为了进一步分析CsTGY_SBP基因的进化过程,对茶树品种‘铁观音’与1种单子叶植物水稻、2种双子叶植物(拟南芥和葡萄)及其他3个茶树品种(‘黄棪’、‘舒茶早’和‘龙井43’)中SBP基因进行了共线性分析(图2,A)。结果显示,‘铁观音’与水稻、拟南芥、葡萄、‘黄棪’、‘舒茶早’和‘龙井43’有共线性关系的基因分别为3、12、15、23、21和22个,说明茶树和拟南芥、葡萄的共线性关系与单子叶植物相比更强,同物种内发现‘铁观音’和‘黄棪’的共线性关系更显著。此外发现SBP基因在4个茶树基因组中主要定位在5号、10号和6号染色体(图2,B),且除HD_SBP基因在9号染色体无分布,其他3个基因组中的SBP基因均有分布,尤其6个SCZ_SBP基因被挂载到9号染色体。
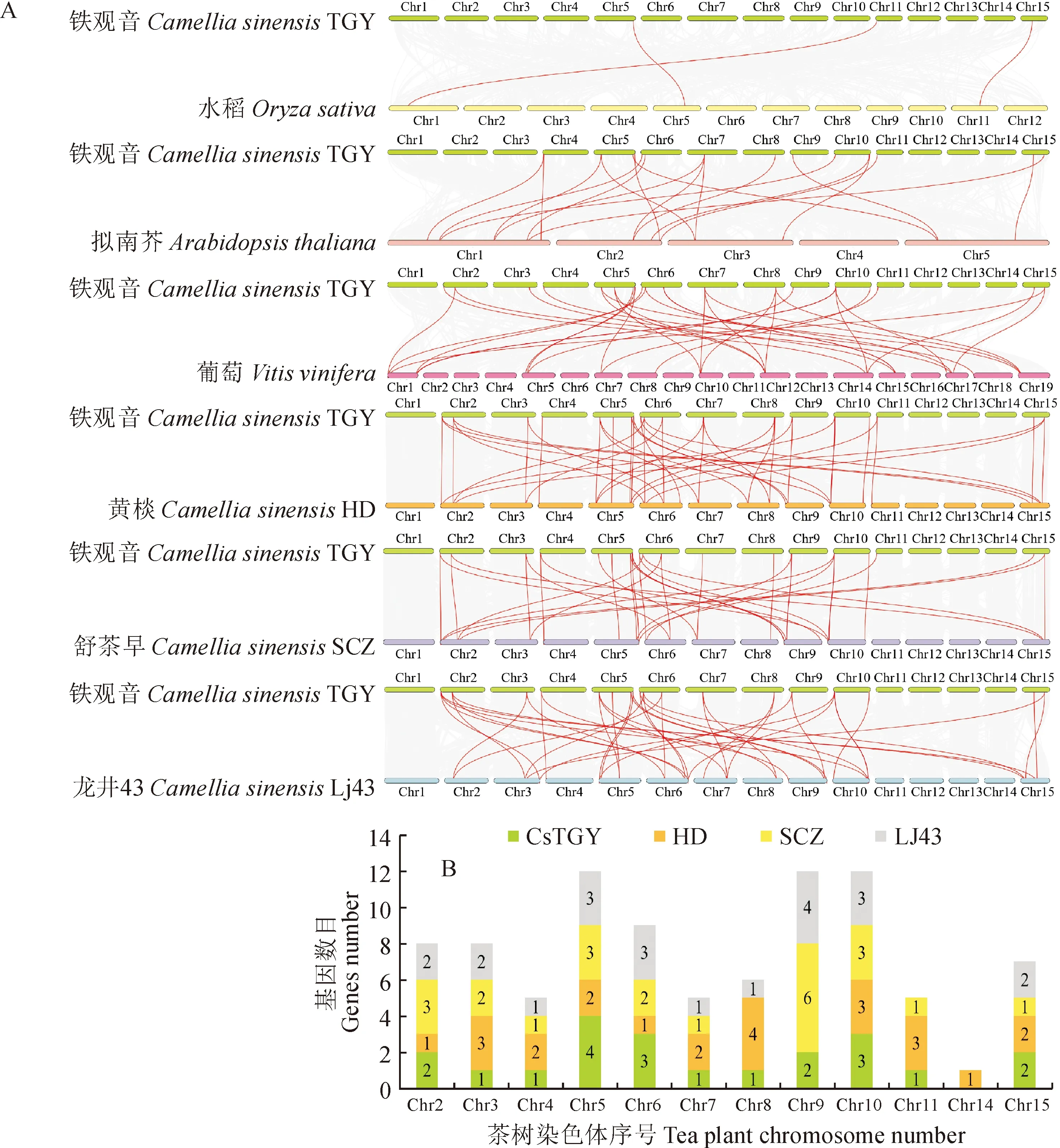
图2 CsTGY_SBP基因家族的共线性分析和染色体分布数目Fig.2 Synteny analysis and chromosome distribution number of CsTGY_SBP gene family
2.4 茶树CsTGY_SBP家族的启动子序列预测分析
顺式元件在植物生长发育中起着调控基因转录的重要作用,为了解CsTGY_SBP基因的转录调控机制,预测了CsTGY_SBP基因的2 kb上游启动子区域的顺式作用元件。除核心顺式元件(TATA-box和CAAT-box)外,共预测出4种类型的顺式作用元件:光响应元件、植物生长、胁迫响应和激素响应(图3)。其中光响应元件包括Box4、G-box和GT1-motif等,尤其是Box4分布在90%的CsTGY_SBP基因中;CsTGY_SBP基因中发现了CAT_box、O2_site和GCN4_motif等与植物发育相关的顺式元件;非生物胁迫相关顺式元件包括厌氧诱导的必需基因(ARE)和低温响应元件(LTR)等;与激素响应相关的CGTCA_motif广泛分布于80%的CsTGY_SBP基因中。
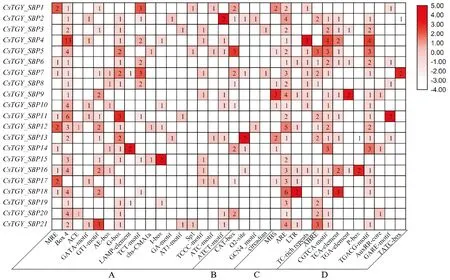
A.光响应元件;B.植物生长;C.胁迫响应;D.激素响应图3 CsTGY_SBP基因家族启动子区的主要顺式元件A. Light responsive; B. Plant growth; C. Stress responsive; D. Phytohormone responsiveFig.3 Main cis-elements in CsTGY_SBP gene family promoters
2.5 茶树CsTGY_SBP家族的miR156靶位点
为了确定茶树中是否也存在miR156介导的CsTGY_SBP基因转录后调控,使用psRNATarget服务器鉴定CsmiR156的靶位点。结果显示,13个CsTGY_SBPs是miR156的潜在靶位点。miR156的靶位点位于9个CsTGY_SBP1、CsTGY_SBP2、CsTGY_SBP9、CsTGY_SBP10等的编码区(图4),这些基因属于不同的Ⅰ、Ⅱ、Ⅲ和Ⅳ亚家族。其他4个CsTGY_SBPs(CsTGY_SBP5、CsTGY_SBP6、CsTGY_SBP12和CsTGY_SBP13)属于同一Ⅵ亚族,其目标位点位于3′-UTR区域。说明mir156介导SBP-box基因的转录调控在茶树中是保守的。

图4 CsTGY_SBP基因家族在CDS区的mir156靶位点分析Fig.4 Analysis of miR156 target sites of CsTGY_SBP gene family in CDS zone
2.6 茶树CsTGY_SBP家族在不同组织的表达分析
为了进一步研究CsTGY_SBP家族的潜在功能,对CsTGY_SBP家族的基因在6个组织(芽、嫩叶、成熟叶、花、茎和根)中的表达模式进行分析(图5)。结果显示21个CsTGY_SBP基因在6个组织中表达,且具有很强的组织特异性表达模式。CsTGY_SBP基因在芽、嫩叶和茎中高表达的数量高于成熟叶、花和根,如CsTGY_SBP2、CsTGY_SBP9、CsTGY_SBP16和CsTGY_SBP17等,表明这些基因可能在芽、嫩叶和茎中具有重要的功能;CsTGY_SBP19的转录本主要在根中积累;CsTGY_SBP6在花中的表达量最高,说明该基因可能在花的发育中起关键作用。

图5 CsTGY_SBP基因家族在不同组织的表达谱Fig.5 Expression profiles of CsTGY_SBP gene family in different tissues
2.7 茶树CsTGY_SBP家族基因在不同茶树品种中的表达分析
为探讨茶树F1代品种与亲本之间SBP基因表达模式的差异,对‘铁观音’和‘黄棪’及其F1杂交品种的表达量进行分析,并与‘铁观音’自然杂交品种‘紫牡丹’和‘黄棪’自然杂交品种‘瑞香’的表达量进行比较(图6)。结果显示部分CsTGY_SBPs基因在F1‘金观音’中的表达量介于母本‘铁观音’和父本‘黄棪’之间,呈中亲表达的模式,如CsTGY_SBP5、CsTGY_SBP9和CsTGY_SBP14的表达量高于母本‘铁观音’,低于父本‘黄棪’,且表达量偏向母本;多数CsTGY_SBPs基因在F1‘黄观音’中的表达量与其亲本相比呈下调趋势,呈低于双亲表达模式;在F1‘金牡丹’中除CsTGY_SBP5和CsTGY_SBP8显著高于亲本,呈超高亲表达的模式,其他整体上呈低于双亲表达的模式;CsTGY_SBP5、CsTGY_SBP7、CsTGY_SBP12、CsTGY_SBP16和CsTGY_SBP18在F1‘紫玫瑰’中的表达量显著高于亲本,呈超高亲表达的模式,具有杂种优势;CsTGY_SBPs基因在‘紫牡丹’中整体表达趋于亲本‘铁观音’,在‘瑞香’中整体呈现低于亲本‘黄棪’的表达模式。

不同小写字母表示同一基因不同品种间表达差异显著(P<0.05)图6 CsTGY_SBPs在不同茶树品种中的表达模式Different normal letters indicate the expression differences between different tea plants under the same gene at 0.05 levelFig.6 Expression patterns of CsTGY_SBPs in different tea plants cultivars
3 讨 论
3.1 茶树SBP家族基因进化特征和功能分析
转录因子在植物生长发育过程中起着重要作用,SBP基因是植物特有的转录因子,在植物中含有高度保守的SBP结构域[2]。通过植物全基因组分析,已鉴定出多种植物的SBP基因,包括杨树的28个[6]、拟南芥的17个和水稻的19个[4]等。本研究在茶树品种‘铁观音’‘黄棪’‘舒茶早’和‘龙井43’基因组中分别鉴定出21、25、24和23个SBP基因,SBP基因数量的差异可能是由于全基因组重复(WGD)事件[2]。茶树SBP家族基因数量多于模式植物拟南芥和水稻[4]。对铁观音、拟南芥、水稻和葡萄构建系统进化树发现所有的SBP基因分为8个亚家族(Ⅰ-Ⅷ),与番茄[5]的分类一致。通过系统进化树和共线性分析发现茶树SBP基因与葡萄和拟南芥的聚类比与水稻的聚类更紧密,这与茶树、葡萄和拟南芥都是双子叶植物这一事实相一致[24]。鉴于茶树SBP基因和拟南芥的同源性,推测同一亚族的SBP同源基因可能发挥相似的功能,AtSPL9和AtSPL15调控芽叶成熟[8],其同源基因CsTGY_SBP18可能具有相同的功能。ATSPL3、ATSPL4和ATSPL5调控拟南芥的营养生长时相转变和开花[7],推测其同源基因CsTGY_SBP5、CsTGY_SBP6、CsTGY_SBP12和CsTGY_SBP13可能参与茶树花开花的过程。
3.2 茶树SBP家族基因miR156靶位点的保守性分析
MicroRNAs在基因表达调控中发挥重要作用,SBP基因的表达水平可由miR156或miR157调控,在水稻中有11个OsSPL基因被miR156预测或验证为靶向基因[25]。过表达miR156在拟南芥中下调多个SPLs的表达,但没有识别靶位点的SPLs不受影响[26],突变AtSPL3的miR156/157识别位点后,AtSPL3的转录水平显著升高[27]。Salinas等[5]研究表明miR156和miR157在番茄的幼苗、叶片和花药中的表达量最高,而大多数miR156靶向的SlySBP基因在幼花序和果实发育成熟过程中都有表达,表明SlySBP基因受miR156/157调控。本研究发现miRNA靶基因预测有13个CsTGY_SBP基因受miR156调控,其中有9个靶向的CsTGY_SBP基因在编码区,且CsTGY_SBP2、CsTGY_SBP9和CsTGY_SBP16等miR156靶向的基因在芽、嫩叶和茎中高表达,推测miR156-SBPs模式可能共同作用于茶树的生长发育。但关于miR156-SBPs处于怎样的调控网络有待进一步研究。
3.3 CsTGY_SBP家族基因在茶树中的杂种优势与遗传分析
目前茶树杂种优势在分子机制上的研究与水稻[28]、玉米[29]和烟草[30]等模式植物相比较少,其中重要原因是茶树亲本基因组研究未见报道,本研究基于亲本茶树‘铁观音’和‘黄棪’基因组,对SBP转录因子在茶树杂种优势中的作用进行研究。研究表明CsTGY_SBP5、CsTGY_SBP9和CsTGY_SBP14在F1‘金观音’中的表达量介于母本‘铁观音’和父本‘黄棪’之间,在F1‘黄观音’中的表达量下调,且表达量偏向母本‘铁观音’,与郭吉春等[16]研究并不完全一致,郭吉春等认为‘金观音’和‘黄棪’属于早生种,‘黄观音’的芽叶和嫩茎等遗传性状趋向父本‘黄棪’,而本研究的多数CsTGY_SBP基因在‘金观音’和‘黄观音’中的表达量不完全趋向父本‘黄棪’,可能是亲本和杂种基因的差异表达还受顺、反式作用元件及环境因子等的影响[19,31]。本研究发现CsTGY_SBPs基因在‘瑞香’中整体呈现低于亲本‘黄棪’的表达模式,与前人对‘瑞香’的生长势研究结果一致[32],侯炳豪等[20]研究显示在‘瑞香’中CsGRF相对表达量显著低于‘黄棪’,也证实‘瑞香’的生长势低于‘黄棪’这一观点,且前人研究发现‘瑞香’与‘黄棪’亲缘关系最近[33]。此外,非加性基因在植物杂种优势中发挥重要作用,在水稻中有34%的基因表现出非加性表达模式[28],超显性对于玉米的穗重和株高及穗位高相关性状的调控发挥着重要作用[29],在烟草中参与烟碱合成和转运的关键基因呈现超显性模式,可能是烟碱杂种优势的主要原因[30],本研究表明‘铁观音’与‘黄棪’杂交产生的F1‘紫玫瑰’在CsTGY_SBP5、CsTGY_SBP7、CsTGY_SBP12、CsTGY_SBP16和CsTGY_SBP18呈超高亲表达的模式,F1‘金牡丹’中在CsTGY_SBP5和CsTGY_SBP8中的表达显著高于亲本,存在杂种优势,符合非加性表达在杂种优势形成中起主要作用[18]和超显性假说[31]的观点。且在F1‘金牡丹’和F1‘紫玫瑰’中均显著高于亲本的CsTGY_SBP5可能是茶树杂种优势的重要调控因子。本研究将有助于阐明SBP家族基因在茶树杂种和亲本上的遗传规律,但仍需要对这些候选基因的生物学功能及miR156-SBPs的调控网络进一步研究。
