中国南瓜CmNPR1基因的克隆和表达分析
2022-01-26陈培雯陈学进李新峥李庆飞
陈培雯,张 立,陈学进,李新峥,李庆飞*
(1 河南科技学院 园艺园林学院,河南新乡453003;2 河南省园艺植物资源利用与种质创新工程研究中心,河南新乡 453003)
病程相关基因非表达子(nonexpressor of pathogenesis related genes1,NPR1)是植物系统获得性抗性防御反应的关键调控因子,最早发现于拟南芥突变体中,并以其突变体npr1的表型命名[1-4]。NPR1蛋白包含典型的锚蛋白重复序列(ankyrin repeats,简称ANK)结构域和BTB /POZ(broad-complex,tramtrack,and bric-a-brac /poxvirus and zinc-Finger)结构域,其结构域与蛋白和蛋白之间的互作密切相关。拟南芥NPR1的ANK结构域介导其与Basic Domain/Leucine Zipper转录因子TGA的相互作用,在ANK突变体中无法形成NPR1-TGA复合体,且不能诱导病程相关基因(PR)的形成,其共激活需要BTB/POZ结构域和C端半胱氨酸的氧化[5-7]。NPR1通过BTB/POZ结构域与乙烯受体蛋白(ethylene insensitive3,EIN3)相互作用,干扰EIN3与靶基因启动子的结合,从而阻碍顶端弯钩的形成[8]。N端的BTB/POZ结构域可与C端的反式激活结构相互作用抑制其功能,而NPR1与SA的结合可通过构象变化破坏这种相互作用[9]。
诱导抗性响应在植物防御系统中起着重要的作用。NPR1是系统获得性抗性(SAR)信号传导途径上的关键调控因子,是调节植物的抗病性的重要基因[10]。SAR的诱导物促进NPR1在Ser11/Ser15残基上的磷酸化,然后促进其被cullin3为基础的泛素连接酶补充。磷酸化的NPR1的转换是完全诱导靶基因和SAR建立所必需的[11]。蜡状芽孢杆菌AR156通过激活SAR来增强拟南芥的抗病能力,AR156诱导的SAR依赖于NPR1和SA信号通路[12]。水杨酸(SA)是植物免疫所需的一种防御激素。拟南芥的NPR1和NPR3/NPR4先前被证明可以结合SA,这3种蛋白都是SA受体。NPR1为转录共激活因子,而NPR3/NPR4被认为是促进NPR1降解的E3连接酶,其在SA诱导的防御基因转录调控中起着相反的作用[13]。NPR1基因参与了多种植物病菌的防御调控。香蕉NPR1家族成员MaNPR4 及MaNPR11的表达量随着枯萎病菌的侵染时间延长而不断增加[14]。在拟南芥中,超量表达AtNPR1基因可以增强植株对霜霉病菌(peronosporaparasitica)和丁香假单胞菌(pseudomonassyringae)的抗性[15]。拟南芥AtNPR1基因在其他作物中也被证实可以增加植株抗病性,AtNPR1转基因番茄不仅对番茄花叶病毒产生抗性,还对多种真菌性和细菌性病害表现出广谱抗性[16];AtNPR1转基因胡萝卜对核盘霉等病菌的抗性均明显提高[17];转基因油菜表现出对丁香假单胞菌的抗性[18]。
除此之外,NPR1家族成员基因还参与了植物花和果实的发育。研究发现,2个NPR1-like基因BOP1和BOP2可以调控叶片和花的不对称生长,其双突变体出现多叶叶柄,花器官脱落,和被苞片包住的不对称花[19]。油桐3个NPR1 家族基因在其雌花、雄花、两性花中都显著差异表达,且在雄花中表达量最高,推测油桐的3个NPR1 家族基因(VfNPR1/3/5)参与了花、果实发育和根系系统获得性抗性信号途径[20]。
南瓜是葫芦科南瓜属一年生蔓性草本植物[21],具有易成活、营养价值高、产量大的特点,在世界各地均有种植[22]。中国南瓜(Cucurbitamoschata)是最具经济价值的栽培种,可炒食、蒸食,果肉和种子中含有较高的多糖、β-胡萝卜素、果胶等保健成分,在降血糖、降血脂、增强机体免疫等方面具有明显作用[23]。因此,南瓜是一种具有较高的营养价值和药用价值的蔬菜作物。前期课题组研究发现,CmNPR1在南瓜雌蕊败育(表现为柱头不同程度的缺失)材料中显著下调表达,推测该基因对南瓜雌花发育具有重要作用。本研究对中国南瓜CmNPR1基因进行表达模式分析、基因克隆、生物信息学分析以及亚细胞定位,为进一步研究南瓜CmNPR1基因的生物学功能提供重要的参考依据。
1 材料和方法
1.1 植物材料
试验所用植物材料为中国南瓜自交系‘3-1’,种植于新乡市新东农场试验田,采用常规方法进行栽培管理。在植株盛花期,取不同发育时期的雌花、雄花(纵径0.5、1.0和2.0 cm),选取叶片、幼嫩雌花、雄花(肉眼能区分花不同结构的最幼嫩时期,纵径0.5~1.0 cm)解剖为雌花萼片、柱头和子房,雄花萼片和雄蕊,取样后立即放入液氮中冷冻,存储于-80 ℃超低温冰箱,用于后续检测CmNPR1基因在花不同发育时期和花不同结构中的表达水平以及用于后续基因克隆实验。
1.2 方 法
1.2.1 中国南瓜CmNPR1基因的克隆采用TaKaRa公司MiniBEST Plant RNA Extraction Kit试剂盒提取南瓜雌花的总RNA,根据 TaKaRa公司PrimeScriptTM1st Strand cDNA Synthesis Kit试剂盒进行一链cDNA的合成。利用中国南瓜基因组数据库(http://cucurbitgenomics.org/organism/9)中同源基因的CDS序列,设计基因特异引物,并送往郑州生工生物工程有限公司合成,引物序列信息见表1。以合成的cDNA为模板进行PCR扩增,PCR产物用1%的琼脂糖凝胶电泳检测,回收目的基因片段。然后,将其连接至pMD19-T载体,转化到大肠杆菌DH5α感受态细胞,选取阳性单克隆菌液送郑州生工生物工程有限公司测序。
1.2.2CmNPR1的生物信息学分析利用ExPASy ProParam tool(https://web.expasy.org/protparam/)预测蛋白的理化性质,利用NCBI-CDS(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)预测蛋白的保守结构域,利用Net Phos3.1 Serve(http://www.cbs.dtu.dk/services/NetPhos/)预测蛋白质磷酸化位点,利用NPS@:SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)在线工具预测二级结构,利用TMHMM Server V2.0(http://www.cbs.dtu.dk/services/TMHMM/)在线工具进行跨膜结构域预测分析,利用SignalP 4.0 Server(http://www.cbs.dtu.dk/services/SignalP-4.0/)在线工具预测信号肽,利用NCBI blast(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行基因序列同源性比对分析,利用DNAMAN 6.0软件进行多序列比对分析,MEGA7.0构建系统进化树。
1.2.3CmNPR1基因在植株不同结构中的表达采用TaKaRa公司MiniBEST Plant RNA Extraction Kit试剂盒分别提取不同发育时期的雌花、雄花(纵径0.5、1.0和2.0 cm),叶片和花不同结构的总RNA,采用PrimeScriptTMRT Master Mix(Perfect Real Time)试剂盒进行反转录。利用Primer Premier 5.0 软件设计CmNPR1和内参β-Actin7基因的荧光定量引物,送郑州生工生物技术有限公司进行合成,引物序列信息见表1。按照TaKaRa公司的TB Green®Premix Ex TaqTMⅡ(Tli RNaseH Plus)荧光染料说明书进行实时荧光定量PCR,反应设置3个生物学重复,采用2-ΔΔCt法计算目标基因的相对表达量[24]。

表1 引物序列表
1.2.4 CmNPR1亚细胞位置的预测及定位首先利用在线软件WoLF PSORT Prediction和Plant-mPLoc server对CmNPR1蛋白进行亚细胞定位预测分析。其次,构建GFP融合表达载体转化拟南芥原生质体,确定CmNPR1蛋白表达的亚细胞位置。采用酶切连接法,将CmNPR1基因CDS片段(去掉终止密码子)连入带有GFP标签的pBWA(V)HS-ccdb-GLosgfp载体,构建目的基因及GFP融合表达载体。挑取阳性融合载体的菌斑,摇菌,提取质粒DNA以备转化。
制备拟南芥原生质体并转化:选取25 ℃培养7~15 d的拟南芥愈伤组织,称取5~10 g,磨碎。在组织中加入5~10 mL酶解液,以全部浸泡组织为宜。28 ℃,缓慢震荡酶解5~6 h,用40 μm滤网过滤原生质体,然后用大离心管50×g离心10 min,去上清,用预冷W5溶液10 mL洗涤2次,每次50×g,离心5 min,可见管底浑浊沉淀。根据需要加入500 μL的MMG溶液悬浮。镜检:40倍镜下,检测原生质体。取200 μL原生质体悬液加入10 μL的质粒DNA(最好500 ng以上),取与DNA和原生质体体积相等的PEG溶液,500 ng以上的纯化质粒进行轻柔均匀混合。室温静置30 min。用1 mL W5稀释原生质体。混合均匀终止反应。100×g离心5 min收集原生质体,去上清。加入1 mL W5溶液洗1~2次。最后,加入1 mL W5溶液,移至2 mL离心管中,28 ℃暗培养24~48 h,激光共聚焦显微镜观察。其中,酶解液、W5溶液、MMG溶液参照Yoo等[25]进行配制。
2 结果与分析
2.1 南瓜CmNPR1基因的克隆
以南瓜雌花组织RNA反转录得到的cDNA为模板,用CmNPR1基因特异引物CmNPR1-F和CmNPR1-R进行PCR扩增,扩增产物进行1%琼脂糖凝胶电泳,电泳结果如图1,可见唯一特异条带,CmNPR1基因的CDS全长为1 442 bp。
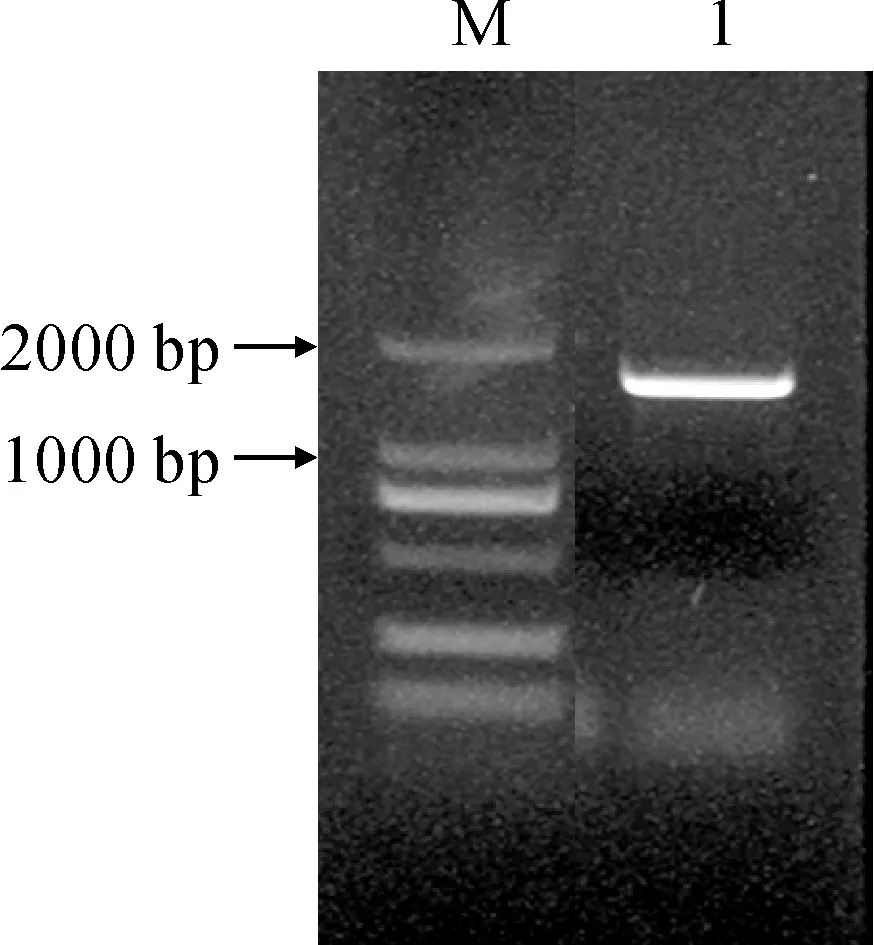
M. DL2000; 1. CmNPR1图1 CmNPR1的PCR扩增Fig.1 PCR product of CmNPR1
2.2 CmNPR1蛋白的理化性质及结构分析
经预测CmNPR1蛋白由480个氨基酸组成,分子式为C2254H3628N646O698S24,总原子数7 250,相对分子量为51.71 kD,等电点值为5.88,正电荷残基(精氨酸+赖氨酸)39个,负电荷残基(天冬氨酸+谷氨酸)52个,脂肪氨基酸系数 95.50,平均亲水性-0.047,不稳定系数49.65,说明该蛋白属于不稳定性亲水蛋白质。磷酸化是蛋白翻译后最重要的修饰之一。NetPhos 3.1 server预测显示,CmNPR1有76个磷酸化位点,其中丝氨酸49个,苏氨酸21个,酪氨酸6个。利用NPS@:SOPMA预测发现,CmNPR1含有45.83%的α-螺旋,41.67%的无规则卷曲,7.92%的延伸链,4.58%的β-转角,其中α-螺旋比例最高(图2,A)。以已知蛋白结构DARPin-DARPin (PDB ID:5leb.1.A)为模板,采用SWISS MODEL建模,得到CmNPR1的三维结构,如图2,B。SignalP 4.0 server和TMHMM分析显示,CmNPR1蛋白无信号肽(图3,A)和跨膜结构(图3,B)。CmNPR1保守结构域预测结果显示,CmNPR1氨基酸序列含有一个BTB-POZ(8-174位氨基酸)保守结构域,一个DUF3420(209-265位氨基酸)和一个锚蛋白重复序列Ank-2(272-353位氨基酸)特异位点(图4)。

A. 二级结构预测(a. α-螺旋;b. β-转角;c. 延伸链;d. 无规则卷曲);B. 三级结构预测图2 CmNPR1蛋白的二级结构和三级结构预测A. Prediction of the secondary structure (a. α-helix; b. β-turn; c. Extended strand; d. Random coil); B. Prediction of the tertiary structureFig.2 Prediction of the secondary and tertiary structures of CmNPR1

A. 信号肽预测;B. 跨膜结构预测图3 CmNPR1蛋白的信号肽及跨膜结构预测A. Prediction of the signal peptide;B. Prediction of the transmembrane domainFig.3 Prediction of the signal peptide and transmembrane domain of CmNPR1
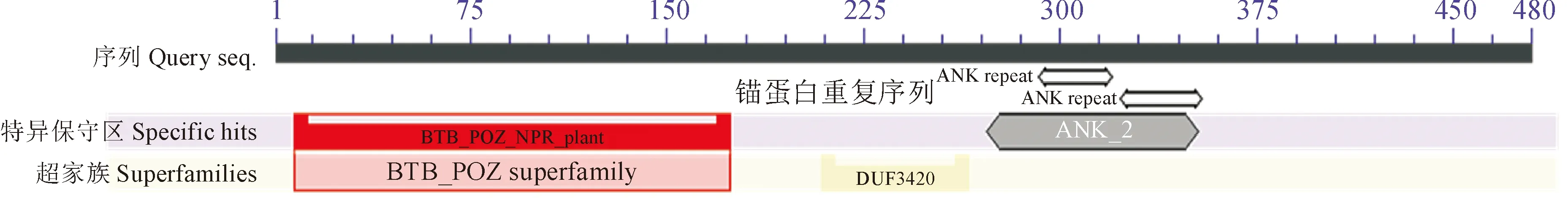
图4 CmNPR1蛋白保守结构域预测Fig.4 Prediction of conserved domains of CmNPR1
2.3 CmNPR1蛋白的同源序列比对及进化分析
同源比对结果显示,CmNPR1氨基酸序列与中国南瓜数据库中基因XP_022932990.1的氨基酸序列一致性最高,达到96.67%,其次与美洲南瓜(Cucurbitapepo, XP_023554537.1)、印度南瓜(Cucurbitamaxima,XP_022967689.1)、冬瓜(Benincasahispida,XP_038883416.1)和黄瓜(Cucumissativus, XP_004150250.1)等葫芦科作物的氨基酸序列一致性较高,分别为96.05%、95.63%、86.00%和86.44%(图5),与其他科作物相似性较低。系统进化树分析结果与同源序列比对结果相似,中国南瓜CmNPR1与美洲南瓜NPR1亲缘关系最近,其次亲缘关系较近的为印度南瓜、冬瓜和黄瓜等同科作物,与黄木薯、橡胶树、栗、中粒咖啡、香樱桃咖啡和小果咖啡等其他科属作物亲缘关系较远(图6)。

图5 CmNPR1蛋白与其他同源作物的氨基酸多序列比对分析Fig.5 Multiple sequence alignment analysis of CmNPR1 protein with homologous proteins of other plants
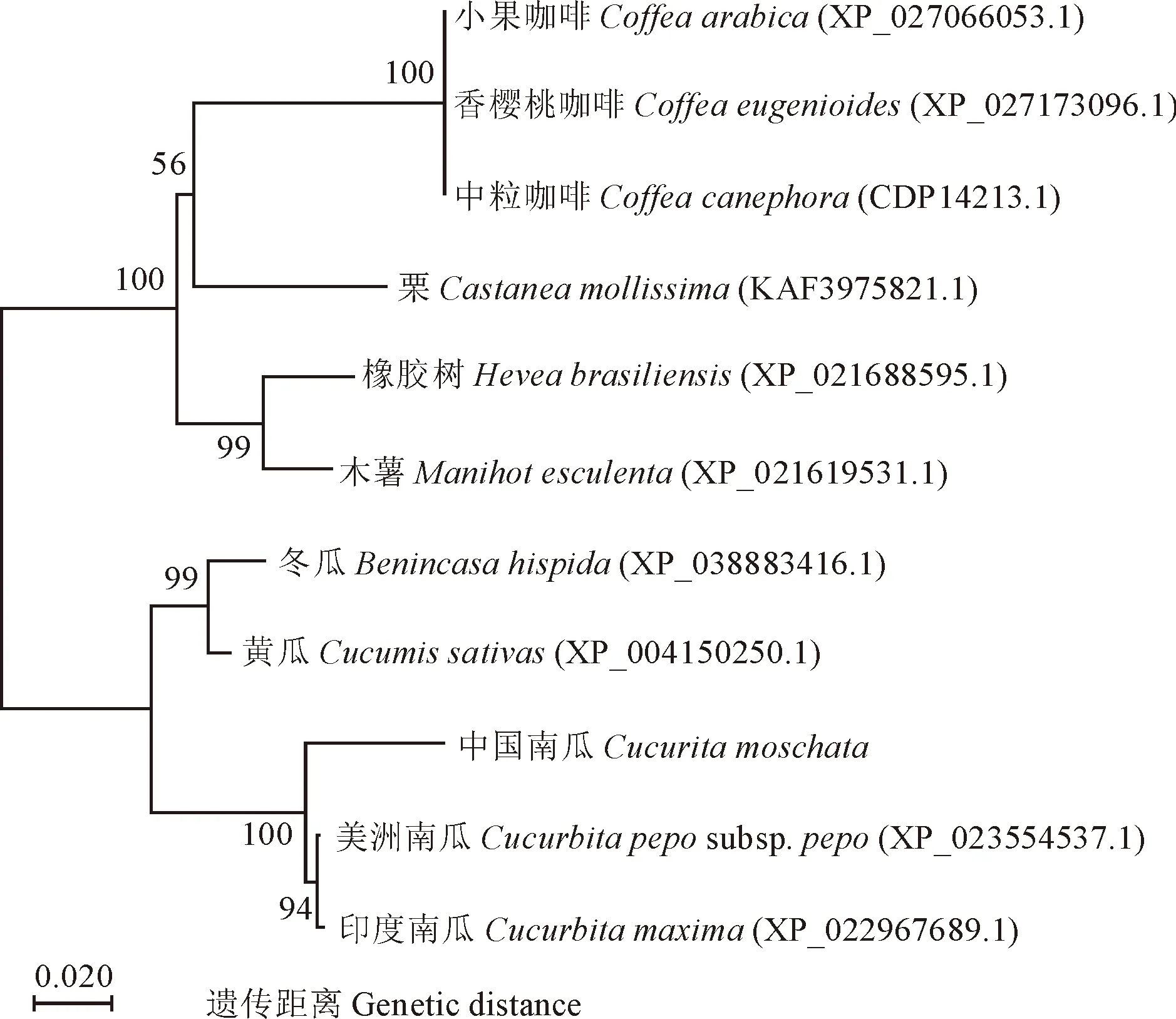
图6 中国南瓜与其他作物NPR1蛋白的进化分析结果Fig.6 Phylogenetic analysis results of NPR1 in Cucurbita moschata and other plants
2.4 花发育不同时期及不同组织中CmNPR1的表达
利用荧光定量PCR技术,分析CmNPR1基因在南瓜雌花、雄花不同发育时期及花不同结构中的表达水平发现,CmNPR1基因在不同发育时期(纵径0.5、1.0和 2.0 cm)的雌花和雄花中都有表达,其中在所取最幼嫩的雌花或雄花(0.5 cm时期)中表达量最高,该时期是花分化为花不同结构的关键时期,其表达量显著高于1.0 cm和2.0 cm时期,说明随着雌花和雄花的发育,该基因表达量逐渐降低(图7,A)。对该基因在雌花和雄花不同结构中的表达分析发现,CmNPR1基因在雌花柱头中的表达量最高,其次是雄花萼片、雌花萼片、雄蕊、叶片和子房。其中,柱头中表达量是雄蕊中表达量的15倍,是叶片中表达量的47倍(图7,B);推测CmNPR1在南瓜花发育过程中具有重要作用。

不同小写字母表示基因表达存在显著差异(P<0.05)图7 花发育不同时期及不同结构组织中CmNPR1的表达Different normal letters indicate significant difference in gene expression (P<0.05)Fig.7 Expression levels of CmNPR1 in different developmental stages and different structures of flowers and leaves
2.5 CmNPR1蛋白的亚细胞定位
在线软件WoLF PSORT Prediction和Plant-mPLoc server亚细胞定位预测结果显示CmNPR1蛋白位于叶绿体、细胞核、细胞质、质体的可能性较大。为了确定CmNPR1蛋白的亚细胞位置,构建了CmNPR1-GFP融合蛋白表达载体,在激光共聚焦显微镜下观察显示,CmNPR1-GFP融合蛋白在叶绿体未见明显荧光,根据荧光所在位置判断CmNPR1可能位于细胞质和细胞核(图8)。

图8 CmNPR1的亚细胞定位Fig.8 Subcellular localization of CmNPR1
3 讨 论
南瓜是世界广泛种植的蔬菜作物之一[26]。研究表明NPR1基因在植物花和果实的发育[19-20]、昼夜节律稳态[27]以及抗冻性[28]等方面具有重要的调控作用,是SAR途径中的关键调控因子,几乎参与植物的整个生命周期[29]。本研究克隆南瓜CmNPR1基因,并对其进行生物信息学分析。研究发现, NPR1在各物种中具有高度保守性,含锚蛋白重复和BTB/POZ两个蛋白互作结构域,这两个结构域和蛋白与蛋白的相互作用紧密相关,对NPR1基因发挥其功能至关重要[2,6-9]。本研究中保守结构域预测发现,CmNPR1蛋白具有一个BTB/POZ保守结构域和一个锚蛋白重复序列(ANK),本研究结果与陈观水等[30]对甘薯等7种植物NPR1蛋白预测结果相似。同源序列比对和系统进化树分析显示,CmNPR1与同为葫芦科作物的美洲南瓜、印度南瓜、冬瓜和黄瓜的NPR1一致性较高,说明该蛋白在进化过程中比较保守。了解蛋白的亚细胞定位有助于系统探究该基因的功能及其所在亚细胞位置和参与的代谢活动。NPR1蛋白的核转运是其发挥调控作用的重要步骤,在没有病原体攻击的情况下,核NPR1蛋白不断地被蛋白酶从细胞核中清除,抑制了其共激活活性[11]。本研究结果显示CmNPR1蛋白位于细胞质和细胞核中,说明CmNPR1可能在细胞质和细胞核中行使功能,这与苹果中MdNPR1蛋白定位于细胞质和细胞核的结果一致[31]。推测CmNPR1蛋白位于细胞质和细胞核两个细胞位置可能和NPR1蛋白的核转运有关。
多项研究发现NPR1家族成员可能参与了植物花和果实的发育[19-20]。在苹果中,研究发现MdNPR7、MdNPR8均在花中表达量最高,且在茎,叶片及种子中表达量较低[31]。ZmNPR1在玉米各组织中均有表达,其中在雌穗中的表达量较高[32]。本课题组前期研究发现南瓜CmNPR1基因在南瓜雌蕊败育材料中显著下调表达[33]。为探究该基因在南瓜花发育中的作用,本研究分析了该基因在雌雄花不同发育时期、不同结构中的表达,结果显示,该基因在最小花发育时期和雌蕊柱头中的表达量最高。该研究结果与玉米[32]中ZmNPR1的研究结果具有一致性,推测CmNPR1基因可能对南瓜雌花尤其是雌蕊的发育具有重要作用。但该基因在南瓜花发育方面的功能还需要进一步进行功能分析。本研究中CmNPR1基因CDS的获得和生物信息学分析及其在雌雄花不同发育时期、不同结构中的表达分析结果为深入研究该基因在南瓜花发育中的功能奠定了研究基础。
