肠易激综合征两种亚型的肠黏膜免疫激活情况及其肠道微生态研究
2022-01-26鲁艳妮周清文
鲁艳妮,周清文
长安医院消化内科,陕西西安 710016
肠易激综合征(IBS)是临床上常见的一种疾病,主要表现为腹痛、粪便性状异常等。目前,在我国IBS疾病的发病率最高可达到10%[1]。IBS具有反复发作的特点,对患者的日常生活及工作等均有影响,同时也增加患者经济压力。有研究显示IBS的发病机制可能与肠黏膜免疫激活及肠道微生态存在关系,主要表现为肠道菌群具有多样性,且益生菌数量异常下降,致病菌的数量异常上升[2-3]。目前,临床上主要将IBS分为2种亚型,即腹泻型肠易激综合征(IBS-D)和便秘型肠易激综合征(IBS-C)[4]。但是目前关于以上两种亚型的肠黏膜免疫激活情况及其肠道微生态的观察研究较少。本研究为了进一步分析IBS-D和IBS-C在肠黏膜免疫激活及肠道微生态方面的研究,选取IBS患者176例作为研究对象,旨在为临床治疗以上2种亚型IBS提供参考,现报道如下。
1 资料与方法
1.1一般资料 选取2017年4月至2020年4月本院收治的IBS患者176例作为研究对象。根据IBS 2种亚型分为 IBS-D组86例、IBS-C组90例。IBS-D组男性42例、女性44例,年龄29~51岁,体质量指数(BMI)为19.38~27.49 kg/m2,IBS-C组男性42例、女性48例,年龄29~51岁,平均(40.23±10.44)岁,BMI 为19.38~27.49 kg/m2,两组一般资料比较,差异无统计学意义(P>0.05)。本研究已获得本院伦理委员会的批准,且所有患者均已签署知情同意书。纳入标准:(1)所有患者均分别符合IBS 2种亚型的诊断标准[5];(2)既往无其他免疫系统方面的疾病;(3)均同意参加本次研究。排除标准:(1)心、肺等脏器功能障碍;(2)既往存在其他恶性肿瘤疾病;(3)既往伴有精神疾病史者。
1.2方法
1.2.1标本的采集 取所有研究对象早晨新鲜粪便标本,置于-80 ℃冰箱中进行保存。所有纳入的研究对象都在结肠镜下结肠直乙交界处取活检标本2~3块,立即放入到10%的中性福尔马林固定液当中,固定后之后制成石蜡切片。
1.2.2粪便性状评分 采用Bristol大便分型量表进行评分[6]。1型为1分、2型为2分,依次类推。
1.2.3采用实时荧光定量PCR检测粪便中肠道菌群数目 取上述标本新鲜粪便,通过显微镜观察涂片染色标本,选择具有代表性的视野中的部分区域,一般要选择100~200个细菌,计算各个细菌所占的比例。再按照连续稀释法称取0.5 g粪便放入到匀浆瓶当中,稀释成不同的稀释度,按照不同细菌正常菌落数量的范围采用不同稀释度完成培养。使用选择性培养平板来培养乳杆菌、肠球菌、大肠杆菌、双歧杆菌等。平板分别放置在37 ℃孵箱和厌氧菌培养箱当中培养(需氧培养24 h,厌氧培养72 h),之后按照平板上的活菌计数法完成计数,鉴定细菌。提取总DNA,再根据双歧杆菌、大肠埃希菌等的序列设计引物序列,PCR扩增,采用紫外分光光度计检测各个菌株的DNA片段,建立标准曲线,计算基因拷贝数。
1.2.4RT-PCR检测各组结肠组织标本中Toll样受体(TLR)4、TLR5 mRNA表达 提取结肠组织中总RNA,逆转录,再将逆转录的产物置于PCR仪器中进行扩增操作,凝胶电泳,TLR4、TLR5 mRNA均采用β-actin校正。
1.2.5各组炎性因子检测 取上述结肠组织标本,剪碎,再予以适量的生理盐水溶液及抑肽酶,将其置于玻璃匀浆中,离心,去除下层沉淀,采用酶联免疫吸附试验(ELISA)检测各组炎性因子肿瘤坏死因子-α (TNF-α)、白细胞介素(IL)-10水平。
1.2.6肥大细胞检测 取上述结肠组织标本,采用胰酶溶液进行消化,获取肥大细胞,予以甲苯胺蓝溶液进行染色。肥大细胞的判定:取5个视野,在不重复的情况下进行观察,取平均数。
1.3观察指标 观察各组粪便性状评分、肠道菌群数目、肥大细胞数目、结肠组织中TLR4、TLR5 mRNA、炎性因子TNF-α、IL-10水平。

2 结 果
2.1各组患者粪便性状评分比较 IBS-D组、IBS-C组患者粪便性状评分分别为(5.76±0.65)分、(5.68±0.58)分,差异无统计学意义(P>0.05)。
2.2各组肠道菌群数目比较 IBS-D组、IBS-C组双歧杆菌、乳酸杆菌数目比较差异有统计学意义(P<0.05),大肠埃希菌、肠球菌数目比较,差异无统计学意义(P>0.05)。见表1。
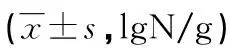
表1 各组肠道菌群数目比较
2.3各组结肠组织中肥大细胞数目比较 甲苯胺蓝溶液染色结果显示,IBS-D组、IBS-C组患者均能够明显观察到大量肥大细胞的表达,且主要呈现紫蓝色,其中细胞核主要呈现蓝色,大量存在于黏膜固有层中,且细胞的大小不一,未脱落细胞比较完整,且细胞膜清晰可见,脱落细胞的细胞膜明显破裂,并且细胞的形状不一。见图1。IBS-D组、IBS-C组肥大细胞的数目分别为(25.28±3.25)个/5 Hp、(25.17±2.89)个/5 Hp,差异无统计学意义(P>0.05)。
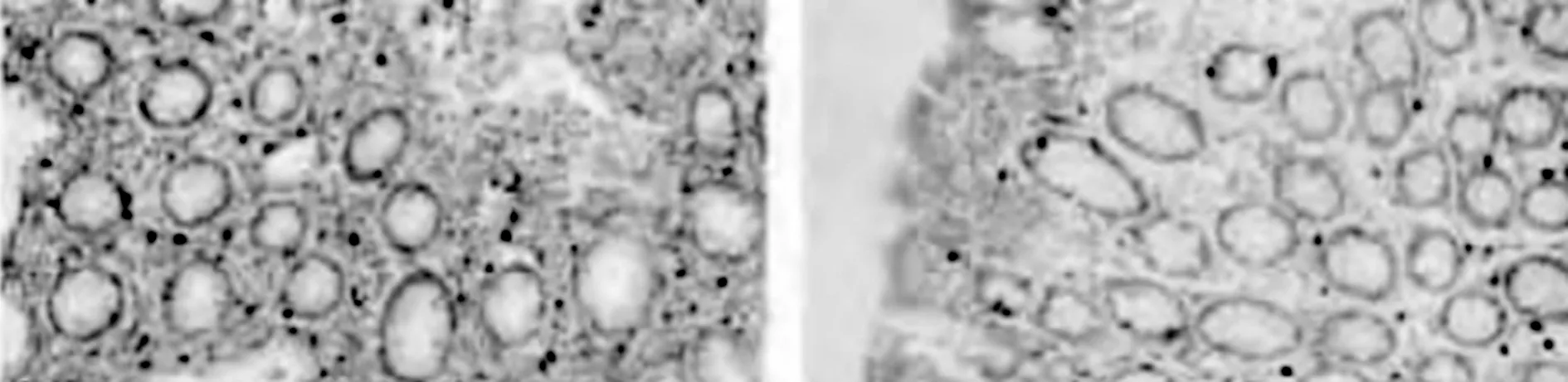
注:A为IBS-D组;B为IBS-C组。
2.4各组TLR4、TLR5 mRNA及炎性因子TNF-α、IL-10水平比较 IBS-D组、IBS-C组TLR4 mRNA、TLR5 mRNA及炎性因子TNF-α、IL-10水平比较,差异无统计学意义(P>0.05)。见表2。

表2 各组TLR4、TLR5 mRNA及炎性因子TNF-α、IL-10水平比较
3 讨 论
目前,临床上关于IBS的发病机制尚且需要进一步研究。本研究主要探讨IBS-D、IBS-C的发病机制是否均与肠黏膜免疫激活的情况及肠道微生态有关,从而对以上两种亚型疾病的发病机制提供参考。IBS-D以腹泻为主,IBS-C以便秘为主,本研究结果显示,IBS-D组、IBS-C组患者粪便性状评分分别为(5.76±0.65)分、(5.68±0.58)分,差异无统计学意义(P>0.05)。IBS-D组粪便性状评分略高,分析其原因可能由于选取的样本量少有关,期待后续研究扩大样本量进行分析,以提高研究结果准确性。
IBS-D组、IBS-C组肥大细胞的数目分别为(25.28±3.25)个/5 Hp、(25.17±2.89)个/5 Hp,差异无统计学意义(P>0.05)。提示肥大细胞数量与疾病类型无关,无论何种类型的IBS,均存在肥大细胞数量异常的情况。肥大细胞主要来源于淋巴、黏膜血管等位置,并且还具有免疫活性的作用,与此同时还能够不断分泌炎性物质等,主要在肠黏膜的免疫调节中发挥作用,当机体的免疫系统被抗原激活以后,机体中的感觉神经末梢会产生兴奋作用,进一步促进机体不断分泌出IgE抗体,抗原与抗体形成复合物,从而导致肥大细胞受到激活作用或者脱落,进一步促进肥大细胞不断分泌出炎性物质等,如炎性因子TNF-α、IL-10等[7-8]。越来越多的研究均显示[9-11],IBS是主要由于内分泌-免疫系统出现异常,从而引起的一种动力性疾病,在免疫系统各个环节中,肥大细胞发挥着重要的作用,主要发挥信息调控作用。激活后的肥大细胞主要将免疫应答信息传递给神经系统,进一步对神经系统发挥调控作用,从而调节机体靶器官,最终使机体产生免疫应答[12]。有研究报道,免疫系统发育的过程与肠道菌群存在关系,肠道菌群分泌的毒性物质具有免疫原性作用,一定程度上能够对机体免疫系统发挥刺激作用,从而增强机体对以上毒性物质的抵抗能力[13]。总之,IBS-D和IBS-C两种亚型疾病的发病机制可能均与肠黏膜免疫激活存在关系。
本研究结果显示,IBS-D组、IBS-C组双歧杆菌、乳酸杆菌数目比较差异有统计学意义(P<0.05),大肠埃希菌、肠球菌数目比较,差异无统计学意义(P>0.05)。此研究结果提示IBS可能与肠道微生态异常存在关系。分析其原因可能是由于肠道菌群多样性及数目等出现异常变化,增加肠道的通透性,从而引起机体免疫系统出现严重紊乱的现象,进一步导致机体多种炎性反应,肠道通透性增加,体液在进入肠腔处异常增多,粪便中的含水量则上升,肠道处的活性物质不断刺激肠道平滑肌,使其收缩,进一步促进胃肠蠕动,从而导致患者出现腹泻症状,另外,相关炎性因子及活性物质的刺激作用亦可对患者的内脏感觉系统发挥激活作用,从而影响患者机体胃肠反射,诱导患者出现腹痛症状。还有研究报道,两种亚型IBS患者中致病菌大肠埃希菌、肠球菌的数目均比体检健康者多,优势菌双歧杆菌、乳酸杆菌均较少,微生态环境变化,进一步加重IBS患者疾病症状[14]。本研究结果显示,IBS-D组、IBS-C组TLR4 mRNA、TLR5 mRNA及炎性因子TNF-α、IL-10水平比较,差异无统计学意义(P>0.05)。有研究报道,TLR4、TLR5均在微生态失调与炎性反应之间发挥着重要的作用,微生态失调引起机体炎性反应,TLR4、TLR5基因表达均异常上升[15]。
综上所述,IBS-D和IBS-C发生、发展过程中均存在肠黏膜免疫激活的情况及肠道微生态异常,可能与活化TLR4、TLR5的表达有关,从而产生炎性因子,促进IBS的发生、发展,其中IBS-D患者结肠组织中双歧杆菌、乳酸杆菌的数目更低。
