口腔中不同假丝酵母菌的毒力因子活性与口腔鳞状细胞癌相关性研究*
2022-01-26李锦峰陈艳炯郭昱成
陈 鑫,李锦峰,陈艳炯,郭昱成
1.西安交通大学医学部基础医学院病原生物学与免疫学系,陕西西安 710061;西安交通大学口腔医院:2.口腔医学检测中心;3.颌面外科;4.正畸科,陕西西安 710004
口腔鳞状细胞癌(OSCC)是头颈部最常见的恶性肿瘤之一,其发病率占头颈部恶性肿瘤的90%,其5年生存率相对较低,约为50%。导致OSCC的危险因素包括吸烟、大量饮酒、口腔卫生差、不健康饮食和微生物感染[1]。由于OSCC的全球患病率增加,其发生机制还未清楚,因此需要进行深入的多因素分析以了解OSCC发生的潜在机制,以及与其他风险因素(尤其是生物病原体)的可能关联[2]。口腔中存在600多种微生物,其最主要的种类是假丝酵母菌、拟杆菌、变形杆菌和放线菌[3]。假丝酵母菌是一种二倍体无性酵母菌,属于机会致病菌,其导致的口腔疾病包括口腔扁平苔藓、口腔念珠菌病和纤维上皮息肉[4]。正常情况下,微生物在宿主中平衡存在,这种平衡的破坏可引起宿主免疫反应,从而可能导致肿瘤发生[5]。越来越多的证据表明,长期暴露于微生物和(或)其产物(内毒素、蛋白酶、胶原酶、纤维蛋白溶酶、磷脂酶等)可对宿主细胞造成损害,并可能诱导突变,影响细胞的信号通路、增殖和凋亡。本研究旨在了解从OSCC患者口腔中分离出的假丝酵母菌的生物膜形成能力及其毒力因子(蛋白酶、磷脂酶、溶血性和酯酶)活性。比较OSCC和健康人假丝酵母菌菌株之间毒力因子的差异,进一步揭示假丝酵母菌在OSCC中的致病机制,为OSCC的诊断、治疗奠定基础。
1 资料与方法
1.1一般资料 收集2018年1月至2020年10月就诊于西安交通大学口腔医院的100例OSCC患者,无手术、放化疗及其他辅助治疗史,所有病例均经组织病理学确诊,作为OSCC组。同时收集该院体检的年龄与性别相匹配的100例健康人作为对照组。OSCC组年龄为31~85岁,平均(60.2±11.3)岁,对照组年龄为26~78岁,平均(59.1±12.4)岁。排除标准:最近使用含有抗真菌剂的漱口水或药物的患者、人类免疫缺陷病毒(HIV)阳性患者、糖尿病患者。
1.2仪器与试剂 恒温培养箱(天津泰斯特)、酶免分析仪(深圳雷杜)。葡萄糖、结晶紫、亚甲蓝购于天津科密欧公司。脑心浸出液肉汤、PBS缓冲液、卵黄乳液、牛血清清蛋白购于青岛高科海博。MH琼脂、麦氏比浊管购于温州康泰公司。蛋白胨、琼脂粉购于北京奥博星。CaCl2、K2HPO4、吐温80购于天津天力公司。酵母膏粉购于杭州天和公司。血琼脂培养基购于安图生物。标准菌株白念珠菌ATCC 90028、近平滑念珠菌ATCC 22019购于温州康泰公司。使用文献[6]中的方法配制牛血清清蛋白培养基、卵黄琼脂培养基[7]、吐温80琼脂培养基[8]及0.5%的结晶紫储存液。
1.3方法
1.3.1菌株分离鉴定 所有研究对象标本采集前漱口,采用无菌拭子收集标本,OSCC组收集病灶区域标本,对照组采集颊黏膜标本。标本接种于沙保弱琼脂培养基,于25~30 ℃孵育5~7 d,对分离的可疑菌落采用基质辅助激光解吸电离飞行时间生物质谱仪(德国布鲁克)进行鉴定。
1.3.24种毒力因子活性检测 配制浓度为1麦氏浊度的菌悬液,取10 μL滴于牛血清清蛋白琼脂培养基,将培养基倒置放入培养箱,经35 ℃、4 d培养检测磷脂酶活性。取10 μL滴于卵黄琼脂培养基,经35 ℃、7 d培养检测蛋白酶活性。取10 μL滴于吐温80琼脂培养基,经35 ℃、5 d培养检测酯酶活性[9]。取10 μL滴于血琼脂培养基,经35 ℃、48 h培养检测溶血活性。试验以白念珠菌ATCC 90028测定结果作为阳性对照,近平滑念珠菌ATCC 22019测定结果作为阴性对照。结果判读:达到培养时间后,平板上菌落周围会出现沉淀圈或透明圈,量取菌落直径与沉淀区直径,并将其计算为菌落直径与沉淀区直径之比。酶活性的测定是基于酶活性指数(EAI),根据EAI指数确定活动范围:EAI≤0.99表示产此活性,EAI=1,表示不产此活性[10-11]。
1.3.3生物膜检测 采用结晶紫染色法检测其生物膜的形成。将培养液加入96孔板中,使用酶标仪测定570 nm波长的吸光度 (A570),吸光度大于临界值的样品为阳性,吸光度小于或等于临界值的样品为阴性[12]。试验以不含微生物的无菌BHIB作为阴性对照,所有试验重复3次。
1.4统计学处理 采用SPSS18.0统计软件进行数据分析。采用LSD-t检验和单因素方差分析(ANOVA)比较OSCC组与对照组及不同分离菌种属之间毒力因子的差异。P<0.05表示差异有统计学意义。
2 结 果
2.1假丝酵母菌菌种检出情况分布 OSCC组标本分离出假丝酵母菌82株,明显高于对照组的24株,差异有统计学意义(P<0.05)。OSCC组和对照组分离率最高的均为白假丝酵母菌。OSCC组白假丝酵母菌59株(72.0%)、热带假丝酵母菌8株(9.7%)、近平滑假丝酵母菌7株(8.5%)、克柔假丝酵母菌5株(6.1%)、杜氏假丝酵母菌3株(3.7%),且存在9株混合感染,包括2株白假丝酵母菌和热带假丝酵母菌混合感染、2株白假丝酵母菌和近平滑假丝酵母菌混合感染、2例近平滑假丝酵母菌和热带假丝酵母菌混合感染、3株杜氏假丝酵母菌和热带假丝酵母菌混合感染。对照组检出白假丝酵母菌[20株(83.3%)]和克柔假丝酵母菌[4株(16.7%)]。
2.2两组分离株毒力因子的比较 OSCC组不同假丝酵母菌均产生蛋白酶、酯酶、溶血活性及生物膜。两组标本分离的假丝酵母菌产生的磷脂酶活性、蛋白酶活性、酯酶活性、溶血活性及生物膜形成能力进行比较,结果显示:OSCC组磷脂酶活性平均EAI(0.685)低于对照组(0.852),差异有统计学意义(P<0.05);OSCC组蛋白酶活性平均EAI(0.733)低于对照组(0.883),差异有统计学意义(P<0.05);OSCC组溶血活性平均EAI(0.585)低于对照组(0.674),差异有统计学意义(P<0.05);OSCC组酯酶活性平均EAI(0.714)与对照组(0.708)比较,差异无统计学意义(P>0.05);OSCC组吸光度(2.032)明显比对照组(1.017)低,差异有统计学意义(P<0.05)。见表1~5。
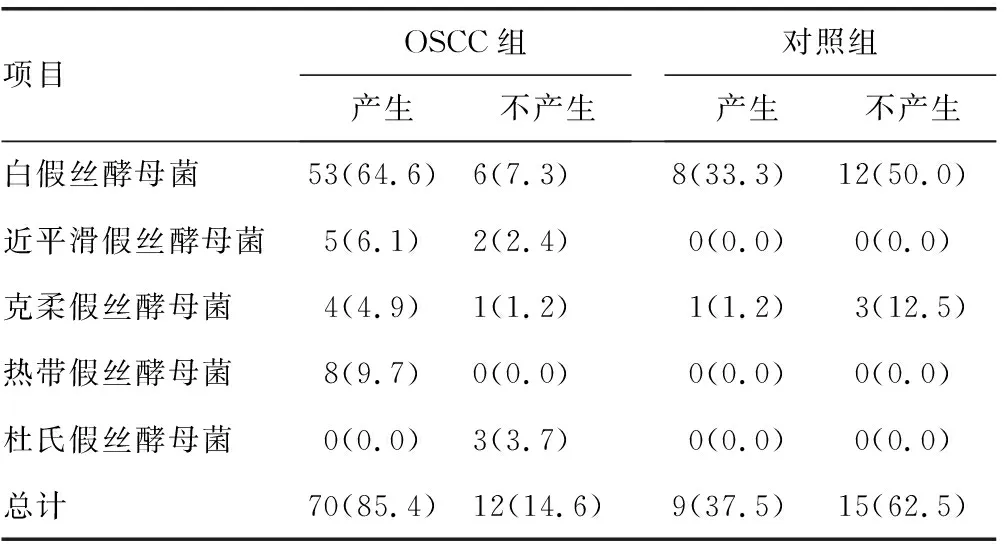
表1 两组不同假丝酵母菌磷脂酶活性比较[n(%)]
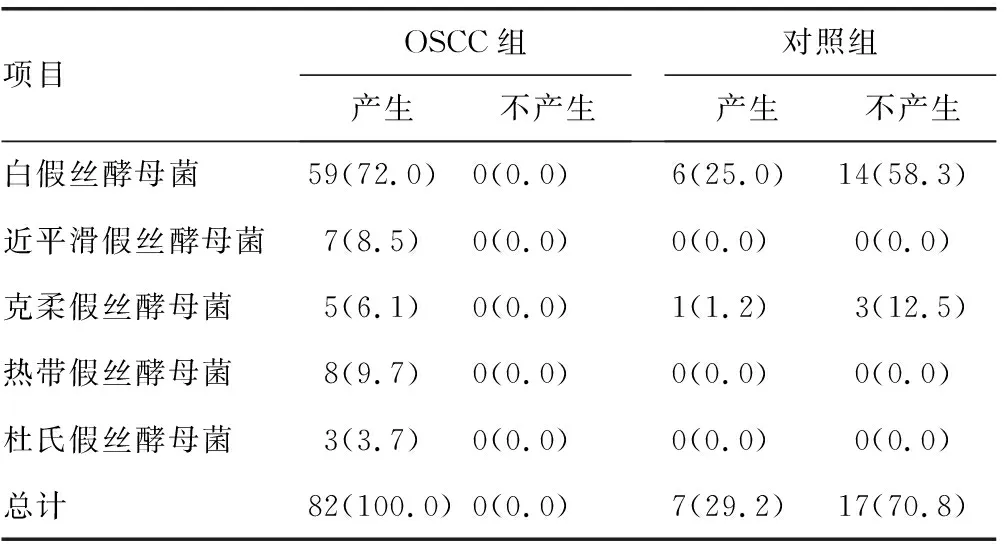
表2 两组不同假丝酵母菌蛋白酶活性比较[n(%)]
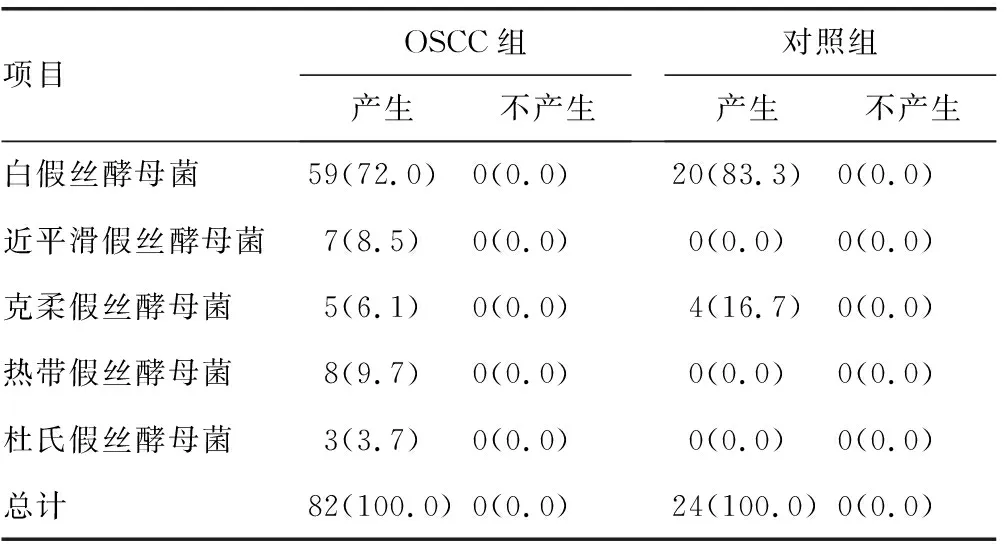
表3 两组不同假丝酵母菌酯酶活性比较[n(%)]
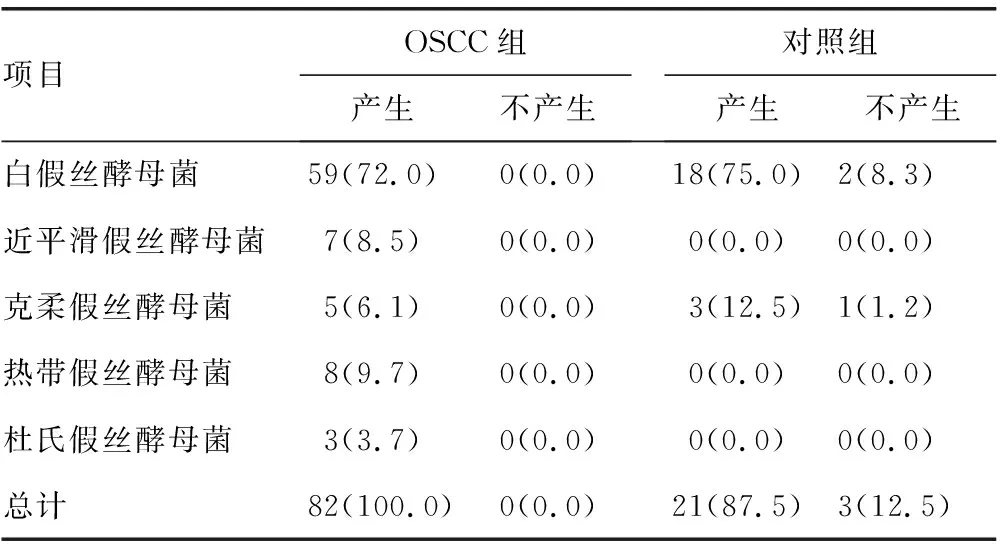
表4 两组不同假丝酵母菌溶血活性比较[n(%)]
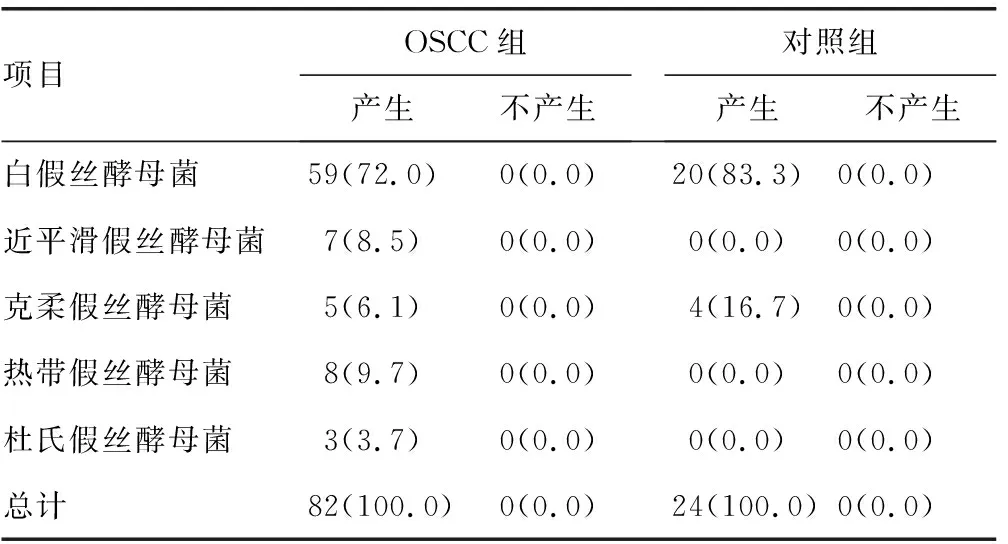
表5 两组不同假丝酵母菌生物膜比较[n(%)]
2.3不同分离株之间毒力因子比较 在所研究的假丝酵母菌中杜氏假丝酵母菌没有磷脂酶活性,将OSCC组中分离出的5种假丝酵母菌毒力因子进行比较,不同菌种间的磷脂酶活性、蛋白酶活性、酯酶活性、溶血活性及生物膜形成能力比较,差异均无统计学意义(P>0.05),见表6。
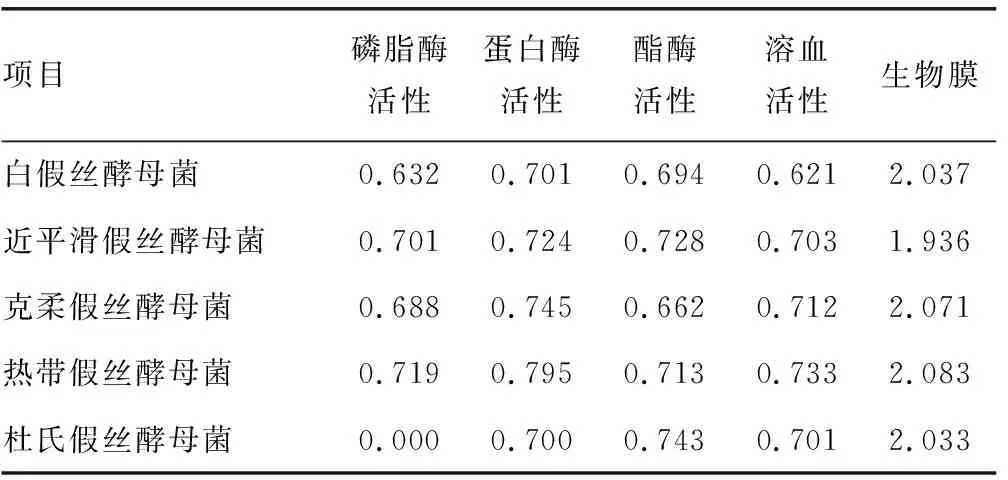
表6 OSCC组中不同假丝酵母菌毒力因子比较(平均EAI/吸光度)
3 讨 论
本研究结果显示,OSCC患者口腔中定植的酵母菌具有多样性,其中白假丝酵母菌的定植率最高,其他依次是热带假丝酵母菌及近平滑假丝酵母菌。白假丝酵母菌的存在被认为是OSCC的重要危险因素,但也需要关注非白假丝酵母菌对疾病的影响。白假丝酵母菌是一种机会致病菌,可通过攻击宿主细胞导致疾病的发生,其在某些条件下会引起口腔疾病,尤其是在机体抵抗力下降时[13]。酵母菌致病性被认为是一个多因素过程,其可通过毒力因子的侵袭机制参与感染的发生和发展[14]。
酵母菌的致病性可归因于各种毒力因子,如可黏附宿主表面的磷脂酶、蛋白酶、酯酶,其黏附宿主的过程可调节酵母菌在宿主中的定植,同时这些毒力因子的分泌导致黏膜屏障受损,有助于感染及侵袭的发生[15]。在本研究中,几乎所有的OSCC患者口腔中酵母菌都具有磷脂酶、蛋白酶活性,且此两种酶活性高于健康人,对照组分离菌株中检测出的蛋白酶活性和磷脂酶活性明显低于OSCC组,表明这些因子在疾病的发生、发展中起重要作用。本研究结果显示,OSCC组酯酶活性平均EAI与对照组比较,差异无统计学意义(P>0.05)。OSCC组溶血活性平均EAI低于对照组,差异有统计学意义(P<0.05),可能是不同酵母菌产生的溶血素酶导致从红细胞释放的铁所致。
酵母菌从孢子到菌丝的形态转换被认为是侵入宿主细胞的毒力因素。白假丝酵母菌产生的生物膜促进了菌丝的广泛生长,并成为侵入性酵母菌感染的来源。微生物黏附是生物膜形成的第一步,酵母菌特别是白假丝酵母菌,通过与上皮细胞的互相作用在疾病的发展中起重要作用,从而导致上皮细胞侵袭性表现[16]。当白假丝酵母菌产生生物膜时,很有可能发生上述作用。
综上所述,OSCC患者口腔分离的假丝酵母菌菌株具多样性,且分离株的磷脂酶活性、蛋白酶活性、溶血活性、生物膜形成能力均高于健康人,为酵母菌的致病性与疾病损害严重程度之间的联系提供了证据。本研究提示酵母菌在OSCC的发生、发展中具有重要作用,但酵母菌的具体致癌分子机制尚需要进一步研究,以明确宿主与酵母菌之间的多重复杂作用,为其进一步诊断、治疗奠定了基础。
