细胞焦亡与自噬、凋亡、坏死的新认知
2022-01-25单春兰赵维薇高利波敖平星
张 博,邓 静,万 全,单春兰,赵维薇,赵 汝,高利波,敖平星,肖 鹏*,高 洪*
(1.云南农业大学 动物科学技术学院,云南 昆明 650201;2.云南农业大学 动物医学院,云南 昆明 650201;3.云南农业大学 食品科学技术学院,云南 昆明 650201)
细胞是组成生命的基本单元,机体的新陈代谢常伴随着细胞死亡的发生。人们对细胞死亡的认识经历了漫长的过程,随着研究的不断细化发现在机体生长发育的过程中,细胞死亡中涉及到许多物质的参与,死亡背后涉及的基因或生物学过程较为复杂[1-2]。细胞死亡方式主要分为被动性细胞死亡,即细胞在应激、损伤或受病原微生物感染时,产生的自我保护机制,在此过程中伴随着炎症的产生,故也称炎症性死亡,典型的被动性细胞死亡有细胞焦亡(cell pyroptosis)和细胞坏死(cell necrosis)[3-4]。此外,还有生物体为了调节细胞数目、促进形态发生、去除有害或者异常的细胞等而产生的细胞自我调节过程,即主动性细胞死亡方式,主要包括细胞凋亡(cell apoptosis)与自噬性死亡(cell autophagy),均是由基因调控的细胞行为[5-6]。
细胞焦亡又称细胞炎性坏死,随着半胱天冬酶-1(Caspase-1)依赖性细胞死亡的进一步表征,发现其与细胞凋亡有所不同,诱发炎性反应是其有别于凋亡的一大特征。因此,在2001年,Caspase-1依赖性细胞死亡被命名为细胞焦亡[7]。自噬性死亡即自噬,源于1962年ASHFORD等[8]在肝细胞中观察到一种自食现象,由粗面内质网的双层膜包裹的部分胞质或细胞内需要降解的细胞器构成。细胞凋亡是一个“主动性细胞自杀”的过程,由1965年KERR等[9]在研究肝脏的供血与肝组织结构时发现,是指有核细胞在一定条件下通过启动其自身内部遗传机制,经内源性DNA内切酶的作用而造成的细胞自然死亡的过程。此外还有一种具有坏死特征的细胞凋亡,即“坏死性凋亡(necroptosis)”,此概念的提出源于对细胞死亡受体的研究,DEGTEREV等[10]筛选出这种死亡类型的特异性抑制剂necrostatin-1(nec-1),并将这种特殊的细胞死亡形式首次命名为坏死性凋亡。而细胞坏死是极端的物理化学因素或严重的病理性刺激引起的细胞死亡,具有代谢功能丢失和细胞完整性遭到破坏的特点,大多数均是在变性、萎缩的基础上发展而来的[11-12]。细胞坏死时可表现出不同特征,早在1997年美国毒力病理学家学会细胞死亡命名委员会建议[13],若细胞坏死表现出凋亡特征时,则判定为“凋亡样坏死”(apoptotic necrosis);若细胞坏死时出现细胞肿胀、线粒体肿胀及嵴破坏并消失、内质网肿胀、细胞核凝集及溶解、胞膜完整性破坏崩解等胀亡性特征时,则判定为“肿胀样坏死(oncotic necrosis)即胀亡”;若坏死细胞因未知过程产生或细胞特征无法确定,则不加修饰词,称为“坏死”[14]。
综上所述,焦亡、自噬、凋亡及坏死于概念上就有所不同,这4种不同死亡方式的原因、机制如何及蕴含的意义?这4种细胞死亡方式的机制、特征的异同及相关性如何?上述问题,将是现在着重探究之处,以引申出对这4种细胞死亡方式的新认知。
1 细胞焦亡、自噬、凋亡及坏死简述
1.1 焦亡——GSDMD打孔性细胞死亡细胞焦亡发生发展中其形态变化主要有细胞核染色质凝结,边移到细胞核的一侧导致细胞轻微的肿胀,形成类似“卷心菜”或“煎蛋”样形态[15]。扫描电镜下可见细胞膜出现多个泡状突起,这些泡状物会逐渐分隔形成“焦亡小体”,细胞膜上产生1.1~2.4 nm的孔洞,随着焦亡的发展,细胞膜上产生的膜孔数量越来越多,细胞愈加扁平,细胞内容物得以释放,残余的细胞碎片被巨噬细胞所吞噬[16]。其形态特征图以海马神经元细胞的焦亡为例,如图1所示,这样的形态是细胞焦亡异于凋亡、自噬及坏死的显著特征,此外,于共聚焦显微镜下可见发生焦亡的细胞其细胞核具有完整性但周围可见球形囊泡,此特征凋亡不具有[15]。细胞焦亡是许多疾病恶化到一定程度的表现,发展较凋亡更为迅速,可简言之,伴有迅速细胞膜受损的裂解性细胞死亡[17]。
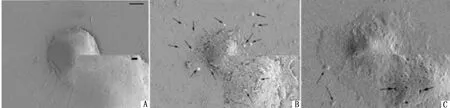
A.正常对照;B~C.焦亡细胞(箭头所指的泡状物、孔洞为焦亡小体及膜孔;标尺=5 μm)
细胞焦亡在抵抗外部病原体入侵和感知内源危险信号中发挥着不可替代的作用,其发生依赖于gasdermin蛋白家族成孔活性,GSDMD-N结合膜脂及在膜上打孔的特性是诱导细胞焦亡的分子基础[19-20]。目前,细胞焦亡的激活途径包含以下2种方式:(1)经典细胞焦亡主要依赖于由炎性体激活的Caspase-1的作用,当病原体入侵宿主细胞时,细胞表面或内部的特异性模式识别受体(pattern recognition receptors,PRRs)识别病原体相关分子模式(PAMP)结构和内源性危险相关分子模式(DAMP)[21]。模式识别受体与特定配体结合,再与其他蛋白结合形成多聚体蛋白复合物炎性体(pyroptosomes),不同炎性体分别对不同程度的危险刺激产生应答。如NLRP3炎性体被激活,其配体能够刺激真核细胞产生活性氧(ROS)并使溶酶体损伤而释放溶酶体蛋白酶,以介导NLRP3活化,活化后的NLRP3使无生物活性的pro-caspase-1形成具有活性的Caspase-1,产生炎症反应,诱导细胞焦亡[22](图2)。(2)非经典细胞焦亡是以激活Caspase-4/5/11为前提的途径,主要通过炎性Caspase-4/5/11蛋白前体与细胞质内的LPS直接结合来组装引发细胞焦亡[23],如最新研究发现的线粒体细胞焦亡途径中发现胆汁酸激活Caspase-4以介导的细胞焦亡[24]。当病原微生物感染宿主细胞时,位于胞质内的PRRs经识别并结合相应配体,组装形成胞浆内的多蛋白复合物,激活炎性Caspase-4/5/11以进一步切割GSDMD蛋白对细胞膜进行打孔,促进细胞焦亡的发生。同时炎性小体作用于下游分子,促进炎症细胞因子(如IL-1β、IL-18等)、趋化因子、黏附分子等成熟经破裂的细胞膜释放到细胞外,募集并激活更多炎症细胞引发炎症反应[25](图2)。
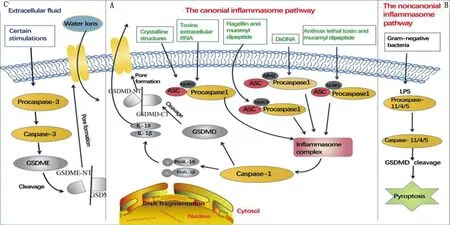
A.细胞焦亡经典途径;B.细胞焦亡非经典途径;C.细胞外途径
1.2 自噬——保护细胞和减轻应激细胞自噬在正常情况下维持低水平,主要清除衰老的细胞器、蛋白质,调控及维持机体的稳态,但当受到严重生理或病理刺激时,细胞自噬水平显著上升引起自噬程度加深,造成自噬性死亡以减轻应激反应[27]。细胞自噬的发生较为迅速,如在饥饿条件下自噬体约在10 min 出现,约1.0 h达到高峰,半衰期约0.5 h,自噬体向自噬溶酶体转变需7~8 min[28]。目前已发现的40种自噬相关基因中有 20多种主要的自噬相关基因(autophagy related gene,ATG)在自噬过程中发挥着不同的作用[29]。自噬包括启动、自噬体成核、自噬体延伸与封闭及自噬溶酶体形成4个阶段[30](以哺乳动物细胞自噬为例,图3)。
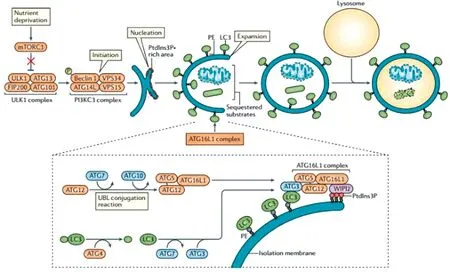
图3 细胞自噬的机制图[33]
①启动:自噬诱导主要通过unc-5l样激酶(unc-51 like kinase,ULK)1,FAK家族相互作用蛋白200 kDa(FAK-family intcracting protein of 200 kDa,FIP200)和ATG13这3种蛋白形成ULKl复合物,并且与雷帕霉素靶蛋白复合物(mammalian target of rapamycin,mTORC)1相互作用而实现[31]。②自噬体成核:自噬体成核首先激活空泡分选蛋白(vacuolar protein sorting,Vps)34,Vps34与紫外线抵抗相关基因(ultravi1et irradiation resistance-associated gene,UVRAG)形成多蛋白复合体,从而促使自噬体成核[32]。③自噬体延伸与封闭:自噬体延伸过程包含2个泛素样结合体系的参与。一个泛素样结合体系为ATG5与ATG12的共价结合;另一个为磷脂酰乙醇胺(phosphatidylethanolamine,PE)与水溶性微管相关蛋白1轻链3(microtubule-associated protein 1 1ight chain 3,LC3)的结合导致LC3-Ⅰ转化为与自噬泡结合的LC3-Ⅱ。此后在自噬体成核基础上,月牙形自噬体核结构扩大并封闭,形成双层膜结构,即自噬体形成[33]。此阶段电镜下可见自噬前体(autophagosome precursor)多呈新月形或半环形,为游离双层膜结构,2层膜之间有腔。在胞质内可观察到一种游离的模型结构,即自噬泡,是细胞发生自噬的证据之一[34]。随后吞噬泡不断延伸,将胞质内待降解的线粒体等细胞器及部分胞质包裹起来,形成双层或多层膜结构的“自噬小体”,观察到自噬小体结构是证明细胞发生自噬的金标准[35]。④自噬溶酶体形成。溶酶体与自噬泡融合形成自噬溶酶体,最后使细胞膜和自噬泡所包含的内容物被溶酶体降解[33],由于自噬体内膜很快被降解,在透射电镜下自噬溶酶体常不易与其他形式的溶酶体区别[36](图4,5)。
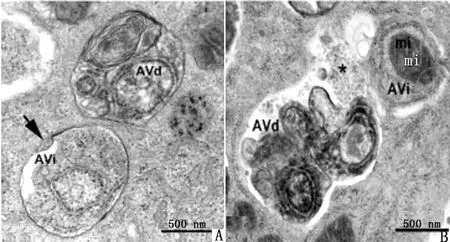
A.自噬小体(AVi.自噬小体或早期自噬泡;AVd.降解的自噬液泡;箭头.双层膜);B.自噬溶酶体(AVi.含粗面内质网及线粒体;mi.线粒体;*.多个小泡,表明自噬小体与多囊泡胞内体融合)
1.3 凋亡——诱发多形态核的细胞死亡细胞凋亡的形态学变化是多阶段的,只涉及单个细胞,可见其与周围的细胞脱离且体积缩小,随后细胞中胞浆萎缩及核固缩,同时细胞膜发生内陷,各种结构尚保持完整的细胞器和染色质的片段被内陷的细胞膜包裹后,这些泡状物会逐渐分隔形成数个表面光滑的膜包小体,称为“凋亡小体”,这样的凋亡小体以发芽(budding)、起泡(zeiosis)的方式形成[39]。此外,还有以自噬体形成的方式形成凋亡小体,凋亡细胞内线粒体、内质网等细胞器和其他胞质成分一起被内质网膜包裹形成自噬体,并与凋亡细胞膜融合后,自噬体排出细胞外成为凋亡小体(图6以体外培养的小鼠原始生殖细胞凋亡的透射电镜及扫描电镜图为例),因胞膜完整,整个过程中无内容物外溢,不引起炎症反应,此为一种保护现象,可使周围组织免受死亡细胞释放的内容物引起的可能损害,随凋亡进程后续出现凋亡细胞先被吞噬后溶解的显著特征[40]。凋亡细胞中细胞核可呈现多种形态,当染色质块聚集于核膜下使胞核呈新月形、“八字形”、花瓣状或环状;而染色质块聚集于核中央部则使细胞核呈现眼球状,而异染色质丰富,常染色质少的细胞核,在凋亡发生中染色质呈现为高度浓缩的致密核(黑洞样)[41](图7)。此外,凋亡细胞的胞质因脱水而明显浓缩,是细胞凋亡形态学变化的第2大特征。

A.由双膜分隔开的早期自噬小体;B.缺乏蛋白质颗粒的单层自噬小体;C.由富含蛋白质颗粒的单层膜分隔开的自噬溶酶体
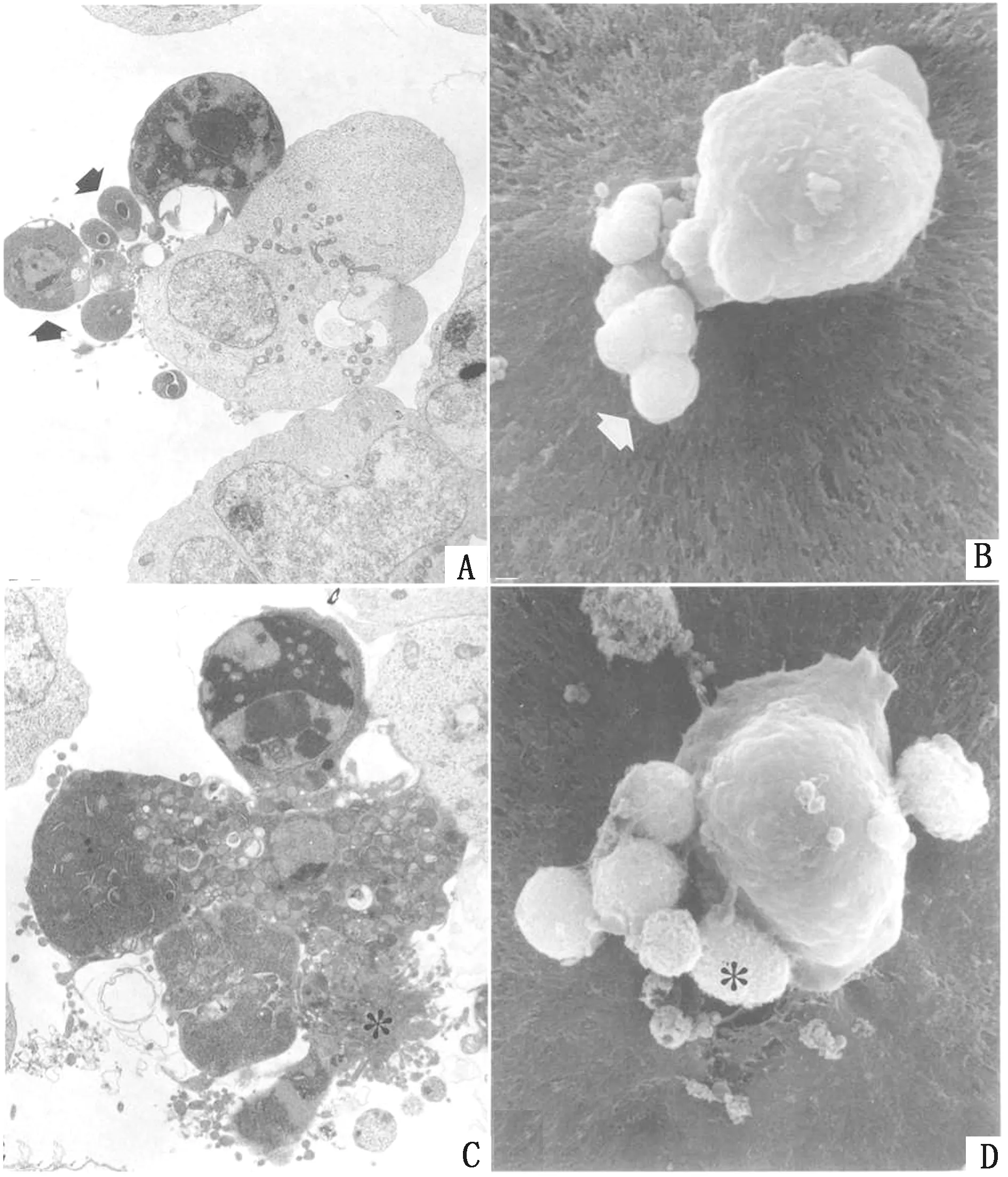
A.小鼠原始生殖细胞被感染5~6 h(透射电镜结果,×4 000);B.小鼠原始生殖细胞被感染5~6 h(扫描电镜结果,×7 700);C.小鼠原始生殖细胞被感染16~18 h(透射电镜结果,×5 600);D.小鼠原始生殖细胞被感染16~18 h(扫描电镜结果,×6 600)。箭头.指向为凋亡小体; *.逐渐退化的凋亡小体(在体内罕见,因处于这一阶段的细胞常被邻近细胞吞噬)

注:从左至右形态图依次为新月状、八字形、花瓣状、环状、眼球状及黑洞样
细胞凋亡是程序性细胞死亡的一种表现形态,对免疫应答的进行负反馈调节,是消耗ATP的主动死亡,从启动到结束都是在基因的严密调控下进行的且涉及一系列含Caspase的水解、活化以及信号传递过程,从细胞凋亡开始到凋亡小体的出现仅数分钟,而整个细胞凋亡过程可延续4~9 h[43-44]。由于凋亡信号的来源不同,凋亡分内源性和外源性2种途径[45]。细胞凋亡中的内源性(胞内)途径是主动的细胞凋亡,当细胞受到内源性刺激时可诱导B细胞淋巴瘤-2基因(BCL-2)相关蛋白(BAX)和BCL-2的拮抗蛋白(BAK)的激活,以改变线粒体外膜的渗透性,从而使CytC、Caspase的激活蛋白SMAC、凋亡诱导因子(apoptosis inducing factor,AIF)等大量蛋白从膜内释放出来[46-47]。线粒体释放的CytC与凋亡酶激活因子(apoptotic protease activating factor-1,Apaf1)相结合,诱导其在内质网上的构象复合体募集、寡聚和激活细胞凋亡起始蛋白Caspase-9,随后切割并激活效应蛋白Caspase-3
细胞凋亡的外源性(胞外)途径中,细胞死亡受体TNF与其相应的配体FAS/CD95结合,并在细胞内募集相应的衔接分子,如死亡域蛋白(FADD)等,随后其通过募集和寡聚形成死亡信号复合体,并激活细胞凋亡起始蛋白Caspase-8,活化的Caspase-8蛋白切割并激活效应蛋白Caspase-3和Caspase-7,诱导细胞凋亡[2](图8)。凋亡的细胞最终被巨噬细胞或邻近的细胞吞噬消化,此过程不会影响其他细胞的正常功能[49]。
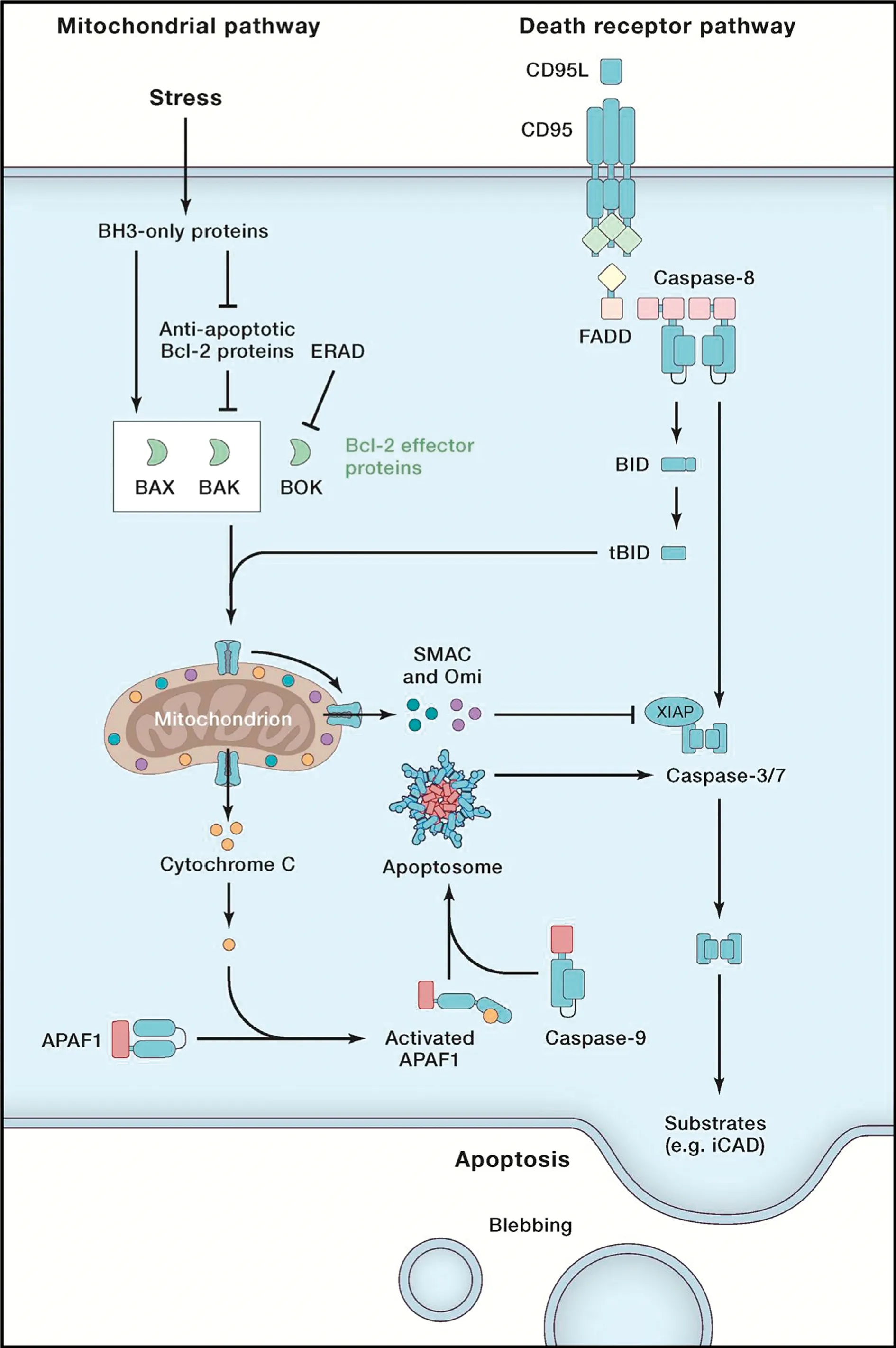
图8 细胞凋亡的机制图[2]
1.4 坏死——核碎裂细胞的由来细胞坏死可致组织出现凝固性坏死、干酪样坏死、液化性坏死及纤维素样坏死等[50]。坏死细胞表现为细胞体积及细胞器明显肿大,胞膜破裂呈爆破样,胞质内容物释放,细胞核肿大,DNA呈弥散性降解[51]。镜下判定组织和细胞是否发生坏死,通常是以细胞核的变化为依据的。细胞核在坏死过程中的主要变化为核浓缩(pyknosis),核体积变小,染色质浓缩、深染;核碎裂(karyorrhexis),核染色质凝集,崩解呈碎粒状聚体在核膜处,随着核膜的破裂,染色质的颗粒就直接分散于胞浆中;核溶解(karyolysis),即自溶,此时核失去对碱性染料的着色反应。综合可知细胞坏死的特征性标志即细胞核的浓缩、碎裂及溶解,如图9所示[52-53]。
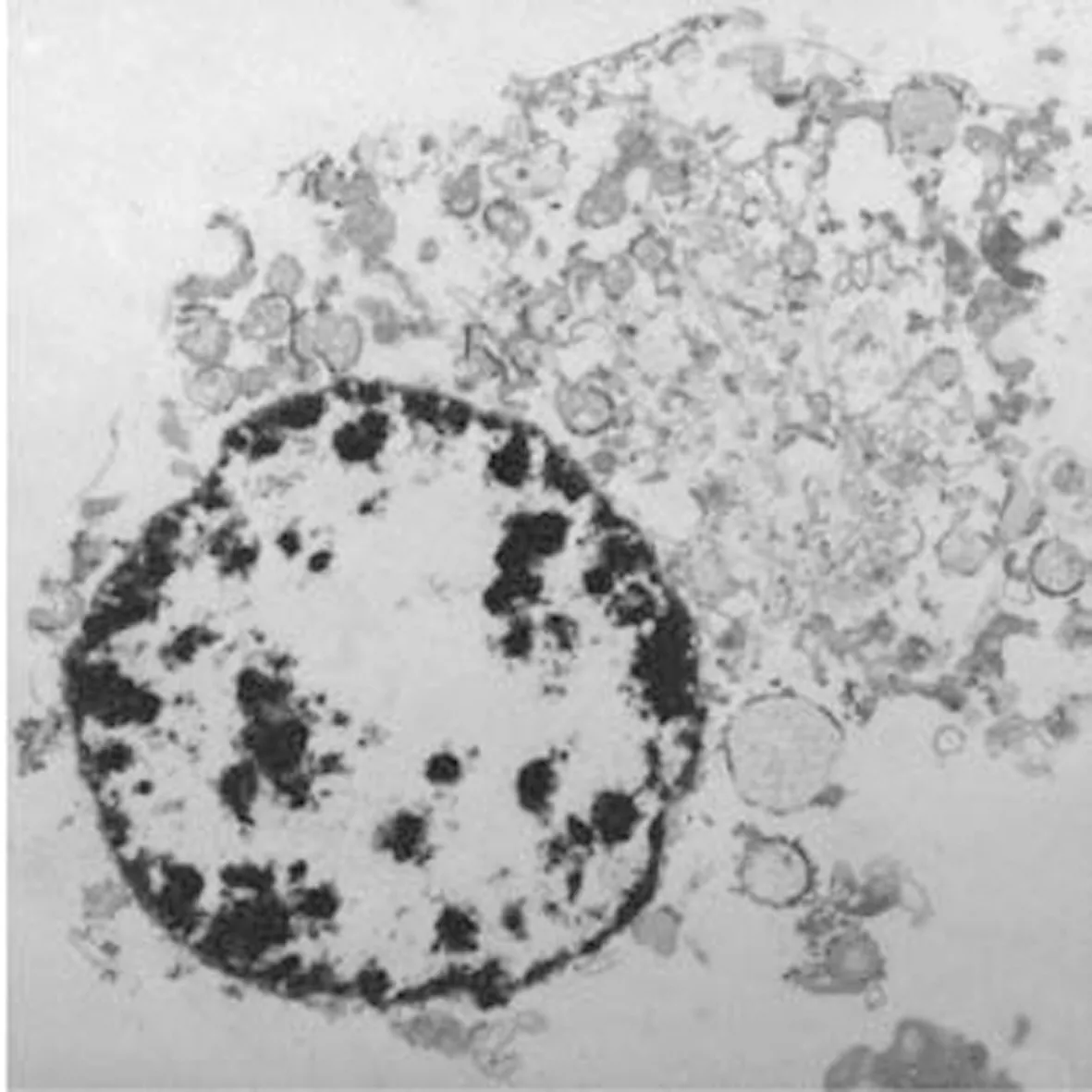
图9 细胞坏死形态图[51]
细胞坏死通常由严重和急性的损伤所致,严重的物理化学伤害(强酸、强碱、辐射等)、免疫反应异常及病原微生物的感染都会引起细胞发生坏死[54]。细胞内高浓度的ROS、ATP含量的下降、BCL-2的大量表达引起的BCL家族蛋白表达失衡、Caspase活性被抑制等都会造成细胞的坏死途径,从而导致细胞膜渗漏,细胞膨大至爆裂,引发炎症反应(图10)[55]。研究指出坏死细胞膜渗透的发生,由肿瘤坏死因子(tumor necrosis factor,TNF)信号通路中受体相互作用蛋白(receptor interacting protein,RIP)家族中的蛋白激酶RIP3和RIP1的激活引起,RIP3和RIP1可相互作用形成“坏死小体”,然后募集细胞中混合系列蛋白激酶结构域样蛋白(mixed lineage kinase dominan-like protein,MLKL),并使之磷酸化,磷酸化的MLKL蛋白转移到细胞膜上形成寡聚物,并在细胞膜上打孔使细胞膜崩解,细胞爆裂[56]。
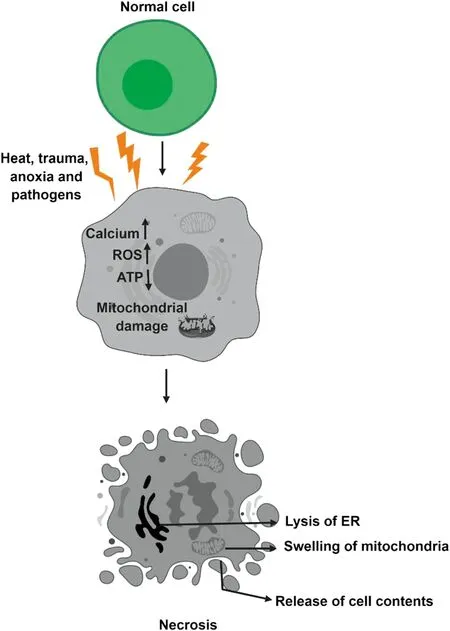
图10 细胞坏死机制图[55]
2 细胞焦亡与自噬、焦亡、坏死间的联系
综上所述,细胞焦亡、自噬、凋亡及坏死的分子调控有着既定的模式,在机体复杂的环境中是否会因某一关键基因或蛋白的缺失、定位、表达不同致使细胞呈现出不同的死亡方式呢?相关研究如ROGERS等[57]指出,GSDMD缺失使Caspase-1不能引发进一步的焦亡,从而转向Bid-caspase-9-caspase-3细胞凋亡途径,该通路可进一步导致GSDMD依赖的细胞再次坏死或焦亡;对小鼠胚胎成纤维细胞NIH3T3细胞凋亡研究中发现RIP3蛋白的表达量是控制细胞凋亡或细胞坏死的关键,如果RIP3表达量高细胞则走向坏死路径,RIP3表达量低细胞则走向凋亡路径[58];如TAABAZDING等[59]对巨噬细胞凋亡研究指出,丝氨酸肽酶DPP8和DPP9 (DPP8/9)在缺乏焦磷酸介导底物GSDMD的情况下,Caspase-1激活Caspase-3和Caspase-7并诱导凋亡,相反,在细胞凋亡过程中,Caspase-3/Caspase-7通过在与炎症Caspase失活蛋白不同的位置裂解GSDMD来特异性地阻止细胞焦亡,表明巨噬细胞的焦亡与凋亡具有紧密互作关系;FRITSCH等[60]研究指出,Caspase-8作为一种分子开关,在小鼠胚胎发育和成年期控制细胞焦亡、凋亡和坏死,并防止组织损伤。自噬与疾病的研究中发现通过自噬来阻断癌症会逐渐导致神经退行性变的发展,反之亦然,或表明它们之间具有拮抗关系,故在考虑单纯提高或抑制自噬并不是一种可行的治疗疾病的策略[61]。以上研究均体现出细胞焦亡、自噬、凋亡及坏死这4种细胞死亡方式间有着千丝万缕的联系,单一刺激可以引发多种不同的细胞死亡模式但细胞的生理状态决定了对特定刺激的最终反应结果[62]。
为便于更好的甄别比较细胞焦亡与自噬、凋亡及坏死的特征,故归纳于表中。由表1可知,细胞焦亡时细胞核于电镜下有别于自噬及坏死的特征是染色质边聚、核固缩;与坏死一样均能使质膜打孔,但焦亡的膜孔由GSDMD介导(表1)。

表1 细胞焦亡、自噬、凋亡及坏死
3 结语
细胞死亡是一个基本的生物学过程,对于机体生理或病理具有重要的生物学意义。那么细胞死亡究竟有多重要呢?依进化论的观点而言,活细胞的自杀行为有可能是为了限制其内部的寄生生物向同类细胞的传染;有些细胞则因为周围营养的限制选择“无私的”自杀行为,此外为了对抗感染而导致的受调控细胞死亡行为在细胞焦亡的模式里比较明显,此时细胞的死亡具有重要价值。在机体复杂的环境中,细胞死亡如何判定呢,有研究指出当细胞膜的完整性被破坏且无法修复时即细胞死亡[64],那么在细胞自噬及凋亡中未见膜的完整性被破坏的情况,又该如何判定细胞在某一时刻已死亡呢,这样的问题还有待于未来的研究。
结合现有的研究报道比较分析细胞焦亡、自噬、凋亡、坏死的特征及机制,阐述它们之间的联系及凝练这4种细胞死亡方式发生中的形态学特征,为后续研究者清晰的认知及掌握这4种细胞死亡方式的形态特征奠定了基础。目前对于这4种细胞死亡方式的机制及形态学的认知仍有欠缺之处,如有研究指出自噬保护细胞免受凋亡[27],但这些机制如何至今未见充分阐述。细胞焦亡时GSDMD的激活方式和功能还有哪些,其他的家族成员是如何被活化的,在哪些病理过程中发挥重要功能?细胞焦亡、自噬、凋亡及坏死间相互联系的机制还有多少种?当一群细胞受到刺激时,是否只因细胞具有不同生理状态而致一些细胞对刺激具有“抗性”且存活而其中一些却最终死亡?这些问题仍悬而未决,随着研究的深入,其定将成为研究热点所在。如这些问题得以解析,未来对于细胞焦亡、自噬、凋亡及坏死的机制与生理病理关系的认知将会更加明晰,相关疾病的治疗也将会有更多渠道。
