高分辨率微细血流成像引导术前经皮穿刺活检
2022-01-25王肖辉荆自伟宋新浩于瑞娜穆晓伟栗河莉
王肖辉,周 霖,荆自伟,张 涛,宋新浩,于瑞娜,穆晓伟,栗河莉*
(1.郑州大学第一附属医院超声科,2.药学部,河南 郑州 450052)
超声因其安全、无创、无辐射等优点而成为引导经皮穿刺活检的首选方法[1],但传统多普勒超声显示病灶血流有一定局限性[2],且难以鉴别肿块的坏死区与非坏死区,用于引导取材存在漏诊、误诊风险[3]。高分辨率微血流成像(high definition micro flow imaging, HDMFI)无需造影剂敏感捕捉微血管内较为低速的血流信号,并行高帧频、高分辨率检测,可有效弥补常规CDFI的不足,有利于评价组织器官的微血流灌注[4]。本研究观察HDMFI用于引导经皮穿刺活检的临床价值。
1 资料与方法
1.1 一般资料 回顾性分析2020年10月—12月于郑州大学第一附属医院接受超声引导下经皮穿刺活检的46例单发占位性病变患者,男27例,女19例,年龄6~69岁,平均(42.3±7.8)岁;31例病灶位于浅表部位(颈部13例、腋窝7例、胸部3例、腹股沟3例、颌面部2例、下肢2例、睾丸1例),8例位于腹腔(肝脏4例、腹膜后2例、肾脏1例、脾脏1例),7例位于盆腔(子宫体1例、宫颈2例、附件4例);病灶最大径0.46~13.80 cm,中位最大径2.48 cm;其中25例接受常规CDFI引导下穿刺(CDFI组),21例接受HDMFI靶向引导下穿刺(HDMFI组)。纳入标准:①影像学检查发现单发占位性病变;②接受手术切除病灶,术后病理诊断明确。排除标准:①严重出血倾向或凝血功能障碍;②超声显示病变不清晰;③不能配合检查。本研究经院医学伦理委员会批准,术前患者或家属签署知情同意书。
1.2 仪器与方法 采用Philips EPIQ 7彩色多普勒超声诊断仪,C5-1凸阵(1~5 MHz)及el18-4线阵(1~18 MHz)探头;在保证血流不外溢及出现噪声的前提下,尽可能将彩色血流增益标尺调至最低;行HDMFI时将增益调整至显示最佳,并保存图像。由工作年限>5年的2名主治及以上职称超声科医师完成以下操作。
根据病灶位置适当选取患者体位。先以2D超声行多切面扫查,观察肿块大小、边界、内部回声及周围组织情况,测量肿块最大径,再对肿块行CDFI或HDMFI,观察其内血流情况。根据超声所见选择穿刺路径,并行体表标记,确定最短且最安全的穿刺进针点及进针方向。对最大径<1 cm病灶采用细针穿刺,≥1 cm者采用粗针穿刺。
HDMFI组:①细针穿刺(图1),以HDMFI所示选择微细血流信号相对较强的实性区域作为靶区,于实时超声引导下,以22G甲状腺细针(CL型,长70 mm)从探头侧缘刺入,确认穿刺针进入靶区域后,以非负压法取材,尽量多角度、多点取材,之后退针;重复取样2次;②粗针穿刺(图2),在实时超声监视引导下,将同轴穿刺针(C1616A或C1816A)置入预先设定的靶区域边缘,避开肿块内HDMFI示无血流成像区域,选择微细血流相对较高的实性区域作为靶区,拔出同轴针芯,沿同轴针道置入全自动一次性活检针(MC1616或MC1816),扣动扳机,进行快速切割活检取材;重复取材2~5次。

图1 患者男,28岁,面部肿物,接受HDMFI引导下细针穿刺活检 A.二维超声声像图示右侧颌面部腺体边缘4.8 mm×5.2 mm类圆形囊性结节,边界清楚,后壁回声增强; B.CDFI示病灶内部无明显血流信号,囊壁见点状血流信号; C.HDMFI示病灶内分支状血流信号; D、E.分别为第1针(D)、第2针(E)细针穿刺活检,均以HDMFI显示存在分支状血流区域作为靶区; F.病理图(HE,×100),病理诊断为(面部)反应性增生
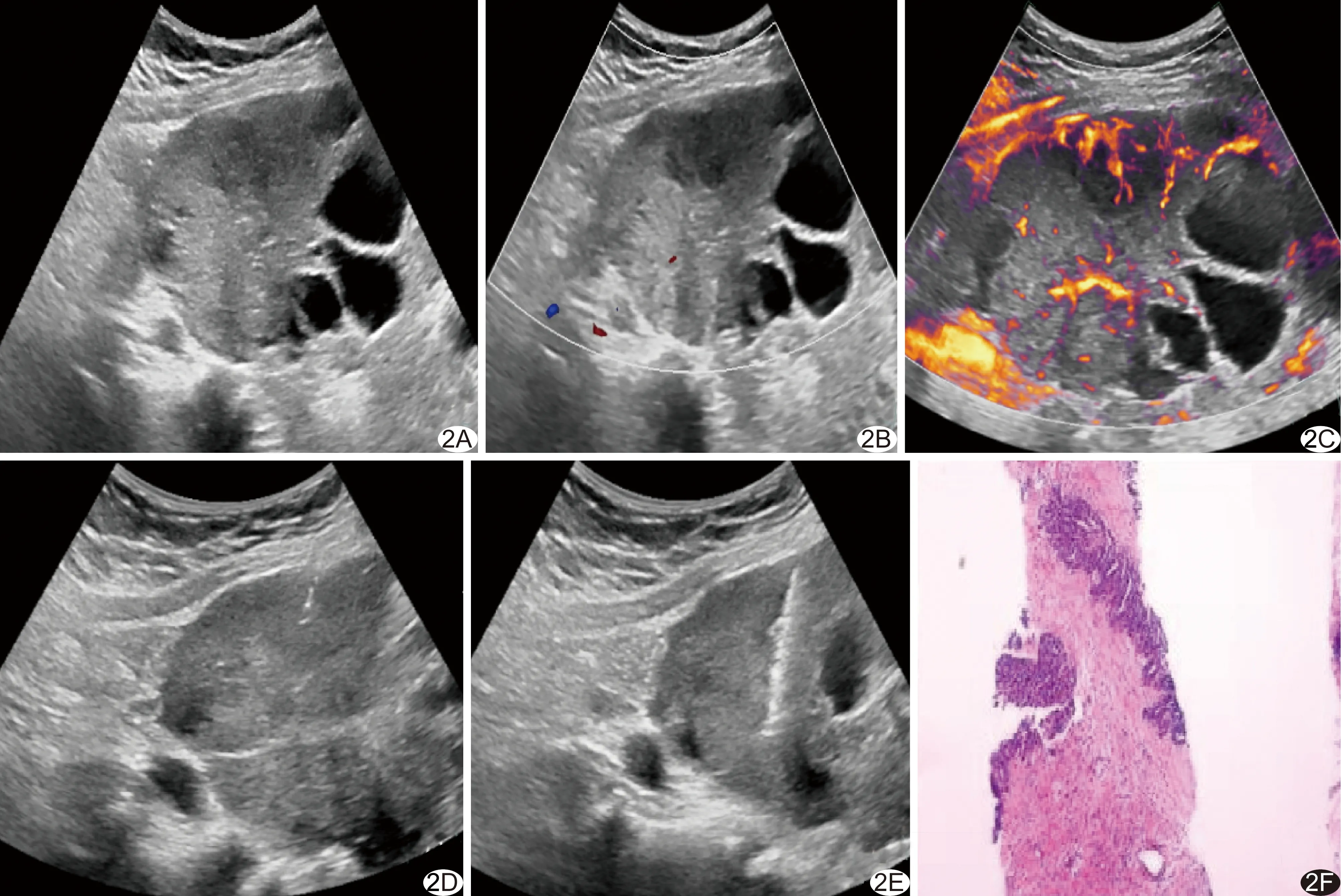
图2 患者女,54岁,盆腔肿物,接受HDMFI引导下粗针穿刺活检 A.二维超声声像图示盆腔偏右侧11.1 cm×7.0 cm囊实性肿物,边界清楚,以实性为主,囊性部分透声可; B.CDFI示肿物内无明显血流信号; C.HDMFI示肿物内点状及分支状血流信号; D.行粗针穿刺,选择HDMFI显示存在分支状血流的实性部分区域作为穿刺靶区,将同轴针置于其前缘; E.沿同轴针鞘将活检针刺入靶区取材; F.病理图(HE,×200),病理诊断为(盆腔)浆液性癌
CDFI组:选择CDFI血流相对丰富区域作为穿刺靶区(避开肿块内无血流信号显示区域及邻近粗大血管区域),其余穿刺活检步骤同HDMFI组。
1.3 观察指标 统计CDFI、HDMFI引导下穿刺取材成功率、诊断符合率和穿刺后并发症。判定取材成功标准[5-8]:细针活检标本至少包含6组、每组不少于10个适宜观察的细胞;粗针活检至少1条组织可获得明确病理诊断。
1.4 统计学分析 采用SPSS 21.0统计分析软件。以±s表示符合正态分布的计量资料,采用t检验进行组间比较;不符合者以中位数(上下四分位数)表示,行秩和检验;采用χ2或Fisher精确概率检验比较计数资料。P<0.05为差异有统计学意义。
2 结果
组间患者性别、年龄、病灶最大径、病灶位置及穿刺活检类型差异均无统计学意义(P均>0.05),见表1。

表1 接受HDMFI与CDFI引导下穿刺活检的占位性病变患者的一般资料及病灶相关资料比较
CDFI组对16例行细针穿刺,对9例行粗针穿刺;共穿刺61次,52次取材成功,每个病灶穿刺2~4次。22例获得明确病理诊断;3例未获得明确病理诊断,其中1例浅表肿块粗针穿刺活检4针,组织条均呈碎块样,另2例细针活检取材量不足,病理未能明确诊断。
HDMFI组对15例行细针穿刺,对6例行粗针穿刺;共穿刺48次,46次取材成功,每例穿刺2~3次。20例细胞量及组织条完整,均获得明确病理诊断结果;1例6岁儿童睾丸结节细针活检因取材量不足而未获得明确病理诊断。
HDMFI组穿刺取材成功率和诊断符合率均高于常规CDFI组(P均<0.01),组间穿刺次数差异无统计学意义(P>0.05),见表2。穿刺术中及术后均未见肿块内部或周边明显出血及周围重要组织结构损伤。
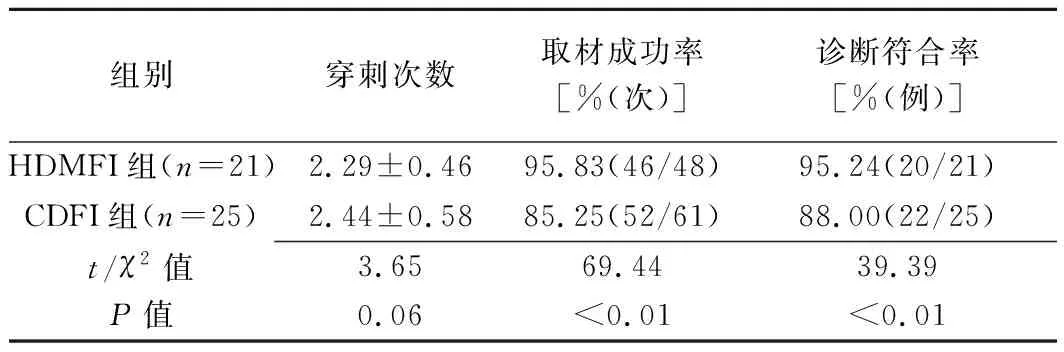
表2 HDMFI与CDFI引导经皮穿刺活检诊断占位性病变结果比较
3 讨论
超声引导下经皮穿刺活检占位性病变是术前获得病理诊断的常用方法,具有实时、可视、操作便捷、精准安全、无辐射且创伤小等优点[9-10];但穿刺活检本身存在一定局限性,如活检标本取材不足或获取位置不准确,而病变的异质性和复杂性,如伴有坏死、液化、良性与恶性病变共存等病理状态[11]均可影响穿刺活检效果。
常规超声可有效鉴别病灶实质区域与液化区域,但无法准确辨别不伴液化的坏死区与非坏死区[12],用于引导穿刺易产生假阴性结果,或诊断结果不明确。CDFI可提高引导穿刺的准确性,但显示低速微小血流能力不足,故诊断乏血供或存在部分坏死区肿瘤时假阴性率较高。HDMFI可无需造影剂敏感捕捉微血管内较为低速的血流信号并进行高帧频、高分辨率检测,有效评价微血流灌注[4]。
本研究对比观察HDMFI与常规CDFI引导经皮穿刺活检占位性病变的穿刺次数、诊断效能及术后并发症,发现其间平均穿刺次数差异无统计学意义,且穿刺过程中及穿刺术后均未见明显并发症,表明2种引导方式下穿刺活检的安全性均较好;而在诊断效能方面,HDMFI组取材成功率、诊断符合率均高于常规CDFI组。与常规CDFI相比,HDMFI能更清晰地显示纡曲走行的微细小血管,有效分辨肿瘤内坏死区,有助于提高对混合性及囊性为主肿块的穿刺取材成功率,进而提升诊断效能。HDMFI组对1例睾丸实性结节行细针穿刺活检时因所取组织细胞量较少而未获得明确病理诊断,可能与睾丸结节活动度较大、穿刺时结节内实际提插位移较短有关。
HDMFI引导穿刺活检要点:①穿刺前以HDMFI观察病变内部血流灌注,避开坏死区域及粗大血管,选择血供相对丰富的高灌注区域进行穿刺;②行粗针穿刺活检时,可利用同轴活检针进行操作,有助于降低肿瘤种植及出血风险;③行细针穿刺活检时,尤其病灶较小且血供不丰富时,宜以单针进行多点、多方位取材,以获取可满足病理诊断要求的细胞数量。
综上,HDMFI可清晰显示病变内部微细血流灌注,有助于精准引导经皮穿刺和取材。但本研究样本量较小,有待累积病例进行前瞻性大样本临床研究,进一步观察HDMFI用于引导经皮穿刺活检的临床价值。
