表观弥散系数值用于预测肝外胆管癌淋巴血管侵犯
2022-01-25王华梦黄新荞周铁军
王华梦,舒 健*,黄新荞,周铁军,苏 松
(1.西南医科大学附属医院放射科,2.病理科,3.肝胆外科,四川 泸州 646000)
肝外胆管癌(extrahepatic cholangiocarcinoma, ECCA)可根据解剖位置而分为肝门部胆管癌(perihilar cholangiocarcinoma, PCCA)和远端胆管癌(distal cholangiocarcinoma, DCCA),其中前者约占90%~95%[1-2]。淋巴血管侵犯(lymphovascular invasion, LVI)指肿瘤细胞侵犯周围淋巴管和/或血管,易致肿瘤复发和远处转移[3-4]。目前主要依靠术后组织病理学检查判断LVI;如能术前早期判断LVI,将有利于选择治疗方案和改善预后。弥散加权成像(diffusion weighted imaging, DWI)基于水分子运动反映细胞和分子水平组织器官的结构和功能状态,并以表观弥散系数(apparent diffusion coefficient, ADC)值进行量化[5-7],已用于胆管癌诊断、临床分期及病理分级[6-8]。本研究旨在分析ADC值对于预测ECCA患者是否存在LVI的价值。
1 资料与方法
1.1 一般资料 回顾性分析2011年8月—2017年12月85例于西南医科大学附属医院就诊并接受MR检查,且经术后病理确诊的单发病灶ECCA患者,男48例,女37例,年龄29~84岁,平均(57.7±10.2)岁;纳入标准:①临床、影像学及病理资料完整;②MR图像清晰。排除标准:①肿瘤较小,MRI不能准确显示病灶;②同时罹患其他系统恶性肿瘤;③存在MR检查禁忌证。
1.2 仪器与方法 扫描前对患者进行屏气训练。采用Philips Achieva 3.0T MR扫描仪行上腹部扫描,范围自膈顶至十二指肠水平部下缘;扫描序列包括轴位双快场回波(dual fast field echo, dual FFE)-T1W、轴位T1高分辨率各向同性容积激发(T1 high resolution isotropic volume excitation, T1HRIVE)、轴位呼吸触发快速自旋回波(turbo spin echo, TSE)脂肪抑制T2W、轴位呼吸触发DWI、冠状位TSE-T2W、MR胆胰管成像(MR cholangiopancreatography,MRCP)及3期动态增强扫描。DWI参数:TR 3 200 ms,TE 70 ms, FA 90°,NEX 4次,b值为0、50、800 s/mm2,FOV 375 mm×375 mm,矩阵128×256,层厚7 mm,层间距1 mm。
1.3 图像后处理和数据测量 将MRI传至Philips MR(R2.6.3.1)工作站进行后处理。由分别具有2年及5年MR诊断经验的主治医师各1名参考常规MRI确定ECCA病灶位置,于b值为800 s/mm2的DWI中选择病灶最大层面(图1A),避开坏死区及邻近胆管、血管勾画ROI,并复制到对应的ADC图上(图1B),软件自动计算ADC值。以二者所获平均值为最终结果。
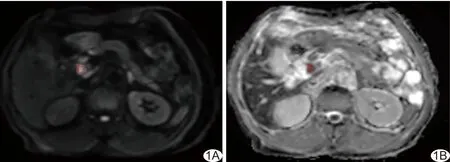
图1 于ECCA病灶勾画ROI示意图 A.于b=800 s/mm2的DWI上勾画ROI(红圈); B.将ROI复制于对应ADC图上(红圈)
1.4 病理检查 由2名具有10年以上病理诊断经验的副主任医师评估术后组织标本,评估肿瘤T分期、局部淋巴结状态及LVI等;以淋巴管和/或血管中存在肿瘤细胞为LVI阳性。
1.5 统计学分析 采用SPSS 23.0统计分析软件。以±s表示符合正态分布的计量资料,否则以中位数(上下四分位数)表示,分别以t检验、Mann-WhitneyU检验进行比较。采用χ2检验比较计数资料。以组内相关系数(intra-class correlation, ICC)[9]分析2名医师测量ADC值的一致性,ICC>0.8为一致性良好。采用受试者工作特征(receiver operating curve, ROC)曲线评估ADC值预测ECCA患者LVI的价值。P<0.05为差异有统计学意义。
2 结果
病理结果显示,85例ECCA中,22例存在LVI(LVI阳性组),63例无LVI(LVI阴性组)。2组患者性别、年龄、肿瘤位置差异无统计学意义(P均>0.05),T分期及有无局部淋巴结转移差异均有统计学意义(P均<0.05),见表1。

表1 LVI阳性与LVI阴性ECCA患者相关资料比较
ECCA病灶于T1WI呈稍低/等信号、T2WI呈等/稍高信号,DWI呈不同程度高信号,在相应ADC图上呈低信号,见图2、3。2名医师测量ADC值的一致性良好(ICC=0.86,P<0.05)。LVI阳性组ADC值为1.17×10-3(1.08×10-3,1.31×10-3)mm2/s,LVI阴性组为1.32×10-3(1.25×10-3,1.45×10-3)mm2/s,组间差异有统计学意义(Z=-4.19,P<0.05)。
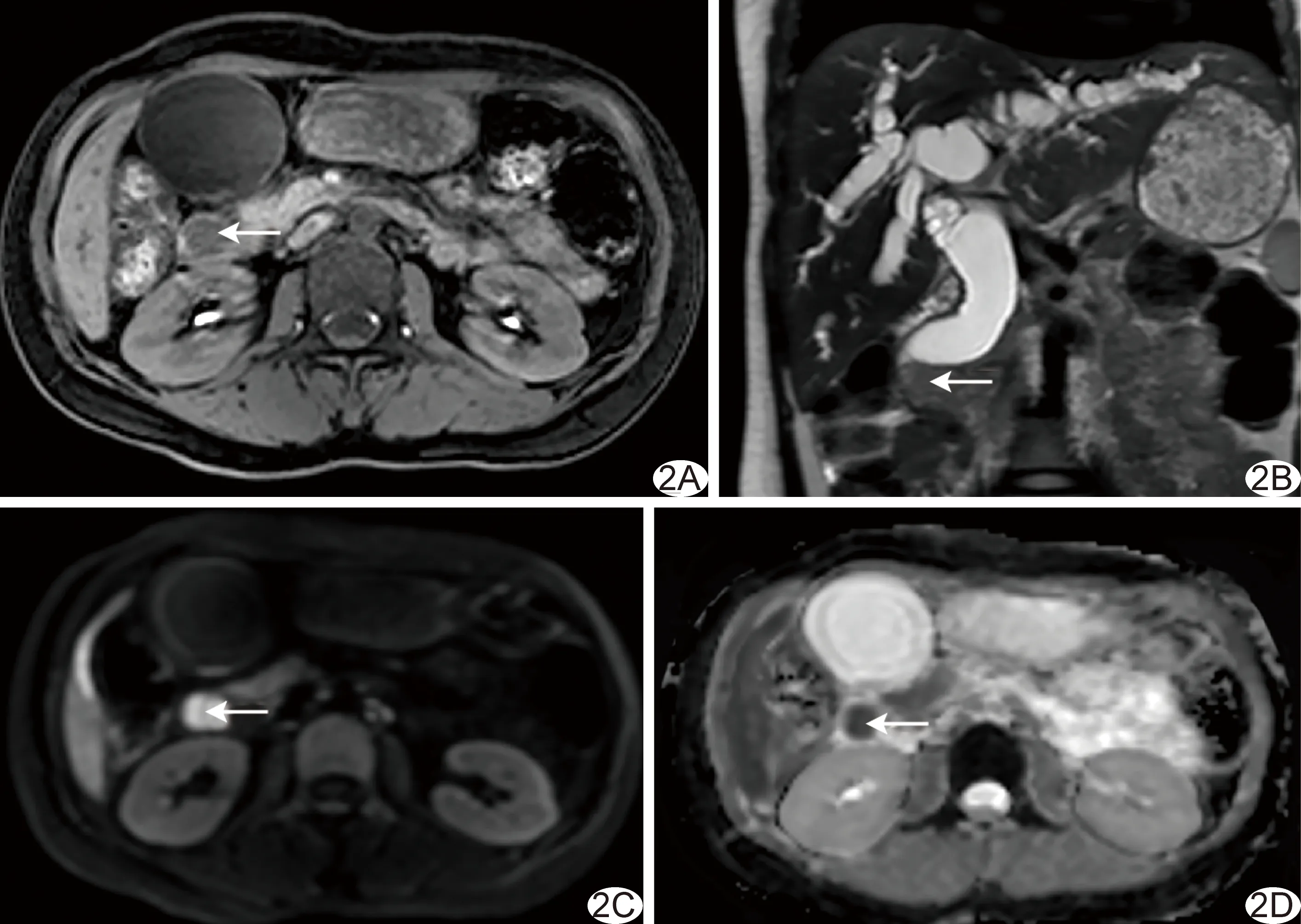
图2 患者女,43岁,DCCA,LVI阳性 A.轴位T1WI示病灶呈稍低信号; B.冠状位T2WI示病灶呈稍高信号; C.b=800 s/mm2 DWI图示病灶呈高信号; D.ADC图示病灶呈低信号,ADC=1.15×10-3 mm2/s (箭示病灶)

图3 患者女,58岁,PCCA,LVI阴性 A.T1WI示病灶呈低信号; B.T2WI示病灶呈高信号; C.b=800 s/mm2 DWI图示病灶呈高信号; D.ADC图示病灶呈低信号,ADC=1.26×10-3 mm2/s (箭示病灶)
以病理结果为金标准,绘制ADC值预测LVI的ROC曲线(图4),其曲线下面积(area under the cure,AUC)为0.80[95%CI(0.69,0.91),P<0.05];以1.18×10-3mm2/s为ADC值判断LVI的阈值,其敏感度、特异度、阳性预测值、阴性预测值及准确率分别为63.64%(14/22)、90.48%(57/63)、70.00%(14/20)、87.69%(57/65)及83.53%(71/85)。
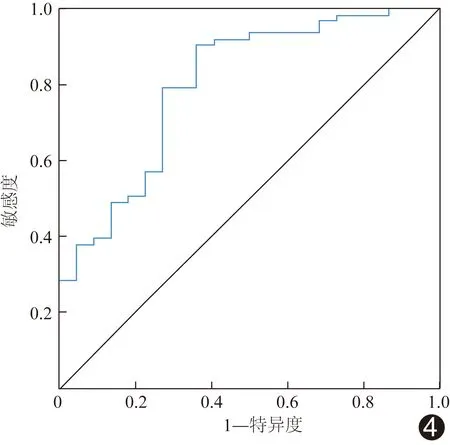
图4 ADC值预测ECCA患者存在LVI的ROC曲线
3 讨论
LVI是肿瘤发生局部或远处转移的危险因素或前期阶段,也是影响ECCA患者预后的重要因素[4,10]。早期发现及评估LVI有助于为ECCA患者选择个体化治疗方案。对于ECCA,目前最佳治疗方式是手术切除病灶,术前是否行辅助治疗与预后影响因素有关。对LVI阳性者,一般认为术前应行辅助治疗,以抑制肿瘤细胞侵犯淋巴管、血管;术中应行系统性淋巴结清扫术,术后行辅助化学治疗,以延缓肿瘤复发、转移。在无法评估淋巴结状态或淋巴结转移阴性情况下,判断LVI对于制定治疗方案显得尤其重要[4]。
本研究85例ECCA患者中,术后病理显示22例存在LVI、63例无LVI,肿瘤类型(PCCA和DCCA)与LVI无明显关系,提示对不同部位ECCA,评估LVI同等重要;且随着T分期增高,ECCA更易发生LVI,可能原因在于随着肿瘤侵犯范围扩大,其与淋巴血管的接触机会及接触面积均不断增加。淋巴管是肿瘤细胞向局部淋巴结转移的主要路径,肿瘤细胞浸润血管和/或淋巴管并在其内不断增殖而形成癌栓,经血管和淋巴管转移至区域淋巴结[11]。本研究中LVI阳性ECCA患者淋巴结转移率明显高于LVI阴性者。LI等[10]也认为LVI阳性对患者生存产生不利影响,使患者更易发生淋巴结转移。早期诊断LVI对ECCA分期和评估淋巴结状态具有一定临床意义。
目前MRI已用于诊断肝胆肿瘤及其临床分期和评估预后[6-7,12]。DWI可反映活体组织中水分子微观运动。作为DWI的重要定量参数,ADC值既可消除T2穿透效应的影响,又能准确反映肿瘤细胞的弥散特征,在一定程度上反映病灶的组织结构和生物学特点。水分子弥散受限时,DWI信号强度增高,ADC值降低[5]。 ECCA肿瘤细胞增殖致细胞数较多,细胞核/细胞质比值较大,使可供水分子自由活动的细胞内外间隙减小[5],限制水分子扩散,导致DWI示病灶信号增高。此外,部分肿瘤组织呈腺管状排列,并伴结缔组织增生[13-15],进一步限制水分子扩散,ADC值随之减低。本研究中ECCA病灶的实性成分在DWI上均呈不同程度高信号,与既往研究[8,14]结果一致;且LVI阳性组ADC值低于LVI阴性组。在ECCA发生LVI的过程中,相关基因异常表达及相关因子分泌促进肿瘤细胞增殖、分化,使细胞密度进一步增加,细胞外间隙中的水分子在细胞密度较高组织中的扩散进一步受限;加之LVI阳性肿瘤细胞具有更高侵袭性,肿瘤细胞和间质细胞分泌大量促淋巴管生长因子、血管内皮生长因子,使瘤内和瘤周淋巴血管密度增加,促进肿瘤细胞浸润至淋巴管、血管,导致细胞外间隙进一步缩小,水分子扩散受限更为明显[10]。ROC曲线结果显示,以ADC值预测LVI阳性的AUC为0.80,特异度为90.48%,提示ADC值评估LVI具有较高的特异度,有利于术前评估及制定个性化治疗方案,以改善患者生存及预后;但其敏感度偏低,可能与影响ADC值的因素偏多有关。
本研究存在一定局限性:仅于单一层面勾画ROI,难以全面反映肿瘤组织特征;为单中心研究,样本量较小,有待后续增加样本量进一步观察。
综上所述,根据ADC值能有效预测ECCA患者是否存在LVI,为术前无创、量化评估ECCA提供依据。
