复方地黄颗粒对帕金森病模型大鼠小胶质细胞激活及神经行为的干预研究
2022-01-24毕殿勇王利何竹青杨玉芳何建成
毕殿勇,王利,何竹青,杨玉芳,何建成
(上海中医药大学基础医学院,上海 201203)
帕金森病(Parkinson’s disease,PD)属中老年常见慢性、神经退行性疾病,其主要病理特征为黑质致密部多巴胺能神经元进行性丢失、大脑皮层神经元内α-突触核蛋白(α-synuclein,α-syn)聚集及路易小体(lewy bodies,LBs)形成,伴有黑质致密部酪氨酸羟化酶(tyrosine hydroxylase,TH)阳性神经元及神经纤维大量丢失[1-2]。
PD病因及发病机理尚不十分明确。相关研究发现,氧化应激、线粒体功能障碍及小胶质细胞过度激活所致的黑质致密部多巴胺能神经元内游离型铁离子过度沉积与PD发病密切相关[3-4]。本课题组长期临床实践证实,复方地黄颗粒在改善PD患者的抑郁、焦虑、睡眠障碍及开-关现象等方面疗效确切[5-6]。前期研究表明,复方地黄颗粒可通过抑制糖原合成酶激酶-3β(glycogen synthase kinase-3β,GSK-3β)基 因、蛋 白 表 达,促 进p-GSK-3β(phospho S9)蛋白表达等作用抑制因α-syn错误聚集所致的黑质多巴胺能神经元凋亡[7]。有研究证实,模型小鼠黑质致密部小胶质细胞可被脂多糖(lipopolysaccharide,LPS)大量激活,其激活标志物离子化钙结合适配分子1(ionized calcium binding adapter molecule 1,Iba1)及相关炎症因子IL-1β、TNF-α表达水平显著升高[8-9]。本研究分别制备LPS和6-羟基多巴胺(6-hydroxydopamine,6-OHDA)实验模型大鼠,探讨复方地黄颗粒对两种实验模型大鼠黑质纹状体小胶质细胞激活及神经行为学的干预作用。
1 材料与方法
1.1 材料
1.1.1 实验动物
100只8周龄雄性SPF级SD大鼠,体重(180±20)g,购自上海中医药大学实验动物中心【SCXK(沪)2018-0006】。以上动物均饲养于上海中医药大学实验动物中心实验室【SYXK(沪)2018-0008】。本实验研究已通过上海中医药大学实验动物伦理审查委员会批准(PZSHUTCM200911001)。饲养条件:湿度60%~65%,温度23~25℃,自动光-暗控制(LD12:12,即7:00~19:00),自由采食、饮水。实验操作地点:上海中医药大学实验动物中心。
1.1.2 药物
复方地黄颗粒由熟地黄、丹参、钩藤、石菖蒲、全蝎、杭白芍、珍珠母7味药物组方,委托国家中药工程技术研究中心制作,按照既定的工艺流程制备浸膏粉,置于阴冷通风处,药物避光包装。动物给药剂量折算标准参照孙瑞元《定量药理学》所述计算每只大鼠每日用药剂量,即每只标准体重大鼠每日灌胃剂量公式DB=DA×KB/KA。DA为标准体重常人用药剂量,KB为大鼠剂量折算系数(7),KA为标准体重成人剂量折算系数(388),即大鼠每日灌胃药量DB=DA×7/388。
1.1.3 主要试剂与仪器
大鼠脑立体定位仪(型号SN-3N,成茂公司,日本);10 μL微量上样器(上海高鸽);微型颅骨钻(上海奥尔科特生物科技有限公司);多功能酶标仪(型号DENLEY DRAGON Wellscan MK3,Thermo公司,美国);Western Blot电泳仪(型号043BR41664,Bio-Rad公司,美国)。
ELISA试剂盒IL-1β(Lot:JL20884,上海将来实业股份有限公司);ELISA试剂盒IL-10(Lot:ER0135,上海威奥生物科技有限公司);ELISA试剂盒TNF-α(Lot:JL13202,上海将来实业股份有限公司);NF-κ Bp65 antibody Rabit(Lot:D14E12,CST公司,美国);phospho-NF-κ Bp65 antibody Rabit(Lot:GR3204852-19,Abcam公司,英国);酪氨酸羟化酶(Tyrosine hydroxylase,TH)antibody Rabit(Lot:58844S,CST公司,美国);GAPDH Antibody(Lot:10011065,Proteintech公司);β-actin antibody(Lot:#0078629,Proteintech公司);辣根过氧化物酶标记山羊抗兔IgG(H+L)(Lot:D110058-0100,上海生工);辣根过氧化物酶标记山羊抗小鼠IgG(H+L)(Lot:D110087-0100,上海生工);离子钙接头蛋白抗体1(ionized calcium binding adapter molecule antibody 1 Rabit,Iba1 antibody Rabit)(Lot:PTE0556,WAKQ公司,日本);BCA Reagent A(Lot:#A4801 A,碧云天公司);BCA Reagent B(Lot:#A1101B,碧云天公司);SDS-PAGE凝胶配备试剂盒(Lot:#102919191106,碧云天公司);PVDF Transfer Membranes(0.22 μmol/L&0.45 μmol/L,Immobilon-p Millipore,Bedford,MA,美国);ECL化学发光液(Lot:#1907702,Immobilon-p Millipore,Bedford,MA,美国);戊巴比妥钠(Lot:WS20130112,上海中西药业股份有限公司);6-羟基多巴胺(6-OHDA)(Lot:#MKCD0817,Sigma公 司,美 国);LPS(Lot:#068M4067 V,Sigma公司,美国);阿扑吗啡(APO)(Lot:WKQ4315,WKQ公 司,日 本);抗 坏 血 酸(Vitamin C)(Lot:#311403,Selleck公司,美国)。
1.2 方法
所有实验大鼠术前适应性喂养1周,取无自发旋转行为的健康大鼠纳入研究范围。
1.2.1 LPS模型大鼠构建
采用黑质两点立体定位术将LPS(体积为每只2 μL,浓度为2.5 μg/μL,生理盐水配制,现配现用)注射于右侧黑质致密部制备LPS大鼠模型。
1.2.2 6-OHDA模型大鼠构建
采用黑质两点立体定位术将3 μL 6-OHDA溶液(浓度为2 μg/μL,0.2%的Vitamin C现配)注射于右侧黑质致密部,制备6-OHDA大鼠模型。
1.2.3 手术步骤
大鼠麻醉(1%戊巴比妥钠,40 mg/kg,腹腔注射),头部去毛备皮。将其头部牢固固定于脑立体定位仪,使颅骨前后位于同一水平面,碘伏常规消毒术野皮肤。切开皮肤,暴露前囟至两耳之间位置,仔细止血,剥离骨膜。
参照包新民主编《脑立体定位图谱》寻找、标记前囟中线位置。标记右侧黑质注射位点:(1)第一点坐标在前囟后5.2 mm,颅顶中线右侧1 mm,硬膜下9 mm;(2)第二点坐标在前囟后5.2 mm,颅顶中线右侧1.2 mm,硬膜下8.5 mm。
用颅骨钻轻轻钻透颅骨直至硬脑膜,微量上样器吸取适量造模药物,将其垂直固定于脑立体定位仪,缓慢匀速进针。当针头到达预定位置后以1 μL/min的速度匀速推注药物,注射完毕留针5 min,缓慢退针。假手术组大鼠按体重标准注射同体积生理盐水,术毕消毒并缝合皮肤切口,将大鼠放回笼具。
1.2.4 分组及药物干预
术后第2周,腹腔注射APO(0.5 mg/kg,0.1 mL/100 g)诱导、记录大鼠自发旋转行为,将旋转圈数大于每分钟7圈者视为为模型成功标志。
(1)LPS实验模型动物分组:随机数字表法将LPS实验模型大鼠分为2组:LPS模型组(简称LPS组),复方地黄颗粒干预组(简称DH+LPS组)。另纳入假手术组(简称sham组),每组大鼠8只。
(2)6-OHDA实验模型动物分组:随机数字表法将6-OHDA实验模型大鼠分为2组:6-OHDA模型组(简称6-OHDA组)、复方地黄颗粒干预组(简称DH+6-OHDA组),另纳入假手术组(sham组),每组大鼠8只。
(3)药物干预:假手术组、LPS、6-OHDA组模型大鼠用等量体积生理盐水灌胃,其余各组大鼠以复方地黄颗粒灌胃(浓度1 g/mL,剂量7 g/kg),每日1次,共计6周。
1.2.5 神经行为学检测及取材
分别于造模成功时(简称0周)和灌胃干预的第2、4、6周观察、记录APO诱导的大鼠自发旋转行为。取材前24 h大鼠禁食,不禁水,1%戊巴比妥钠麻醉并脱臼处死大鼠,在冰上迅速断头取脑,分离其黑质-纹状体,液氮保存,迅速移至-80℃冰箱。
1.2.6 ELISA法检测大鼠黑质纹状体组织匀浆液TNF-α、IL-1β、IL-10的含量表达
组织匀浆液制备:取100 mg黑质纹状体组织加入1 mL生理盐水内,低温超声震荡,4℃条件下以低温高速离心机(12 000 r/min)离心,取其上清液-80℃冰箱保存。ELISA具体实验操作步骤参照生产商说明书。
1.2.7 Western Blot技术检测各组大鼠黑质纹状体TH、NF-κ Bp65、p-NF-κ Bp65、Iba1的蛋白表达水平
RIPA法提取黑质纹状体组织蛋白,BCA法蛋白定量。根据分子量不同配置8%及10%的SDSPAGE凝胶。电泳、蛋白转膜及抗体孵育:电泳,80 V 30 min,110 V 90 min;转膜,200 mA,1 h;5% BSA封闭,室温,摇床2 h;一抗孵育:GAPDH Antibody(1∶1000);NF-κ Bp65 Antibody溶液配制(1∶1000);p-NF-κ Bp65 Antibody溶 液 配 制(1∶1000);tyrosine hydroxylase Antibody(1∶1000);ionized calcium bindingadaptor molecule-1 Antibody(1∶500);β-actin Antibody(1∶2000);抗体孵育:4℃摇床过夜,1×TBST洗涤3次,每次5 min;二抗孵育:HRP*Goat anti-Rabbit IgG(H+L)溶液配制(1∶5000):HRP*Goat anti-Mouse IgG(H+L)(1∶5000);室温,摇床2 h,1×TBST洗涤3次,每次5 min。
使用ECL化学发光剂于暗室内曝光显影,Imagej图像分析软件分析目的蛋白条带灰度值,取样本组织蛋白灰度值与GAPDH、β-actin灰度值比值作对比,求得样本组织蛋白相对含量。
1.3 统计学分析
GraphPad Prism 8软件处理所有实验数据,所有数据服均从正态分布,计量资料以平均值±标准差()表示。多组间实验数据比较采用单因素方差分析(One-Way ANOVA),组间两两比较采用LSD/Dunett/SNK法,统计结果以P值表示,P<0.05表示组间存在统计学差异,P<0.01表示组间存在显著性差异。
2 结果
2.1 神经行为学
2.1.1 复方地黄颗粒对LPS模型大鼠神经行为学的影响
由图1可见,与sham组比较,LPS模型大鼠造模后成功后(图1所示0周)出现APO诱导的首尾衔接自发旋转行为,组间有显著性差异(P<0.001);与LPS组比较,DH+LPS组大鼠在2、4、6周时的自发旋转圈数明显减少,组间有显著性差异(P<0.001)。
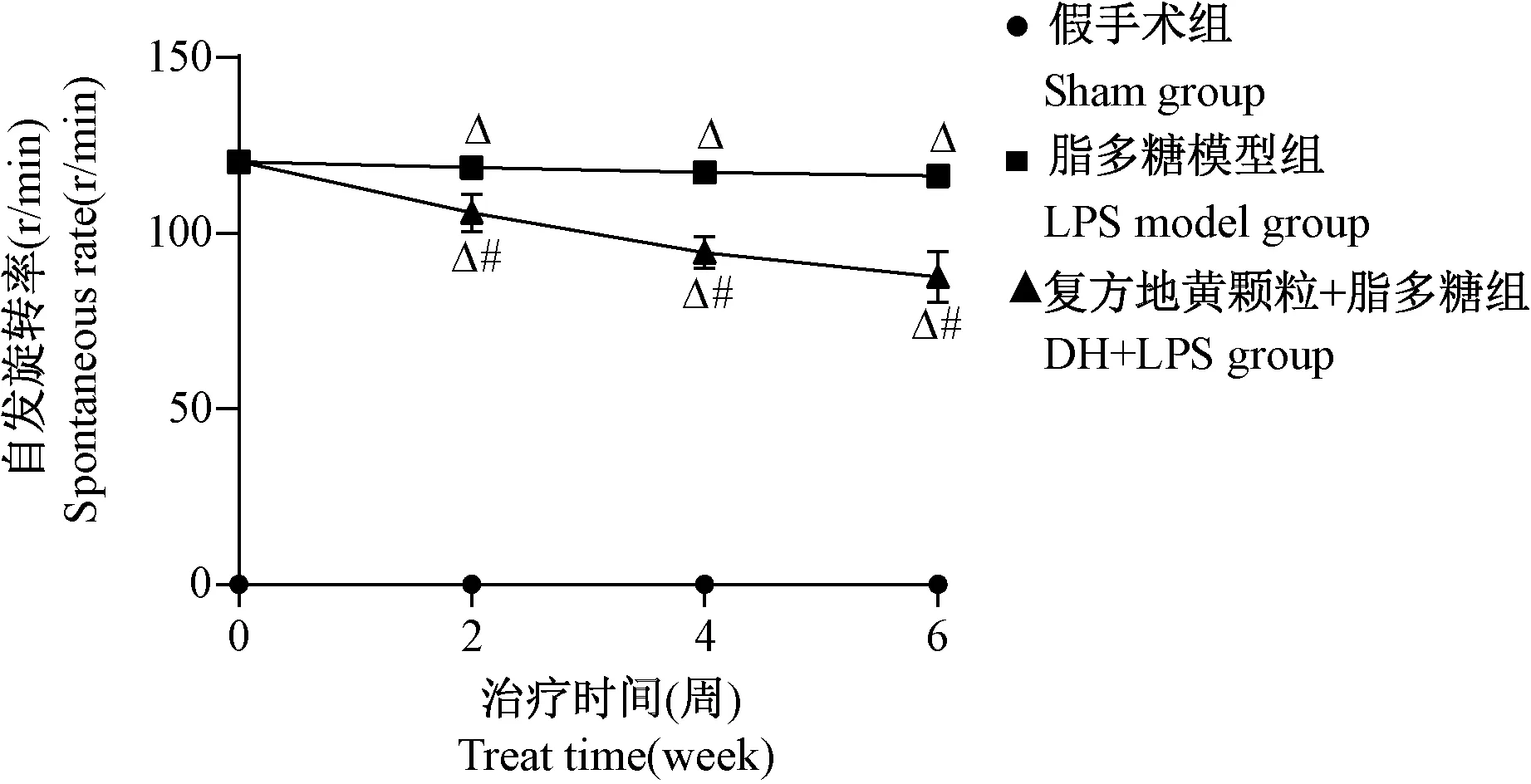
注:与 假 手 术 组 比 较,ΔP<0.001;与LPS模 型 组 比较,#P<0.001。图1 复方地黄颗粒对脂多糖模型大鼠神经行为学的影响Note.Compared with sham group,ΔP<0.001.Compared with LPS model group,#P<0.001.Figure 1 Effect of compound Rehmannia granules on neurobehavior of lipopolysaccharide model rats
2.1.2 复方地黄颗粒对6-OHDA模型大鼠神经行为学的影响
由图2可见,与sham组比较,6-OHDA模型大鼠造模成功后(图2所示0周)出现APO诱导的首尾衔接自发旋转行为,组间有显著性差异(P<0.001);与6-OHDA组比较,DH+6-OHDA组在2、4、6周时的自发旋转圈数明显减少,组间有显著性差异(P<0.05或P<0.001)。

注:与 假 手 术 组 相 比,ΔP<0.001;与6-OHDA模 型 组 相比,▲P<0.05,#P<0.001。图2 复方地黄颗粒对6-羟基多巴胺模型大鼠神经行为学的影响Note.Compared with sham group,ΔP<0.001.Compared with 6-OHDA model group,▲P<0.05,#P<0.001.Figure 2 Effect of compound Rehmannia granules on neurobehavior of 6-hydroxydopamine model rats
2.2 复方地黄颗粒对各组大鼠黑质纹状体炎症因子TNF-α、IL-1β、IL-10含量表达的影响
2.2.1 复方地黄颗粒对LPS模型大鼠黑质纹状体炎症因子含量表达的影响
由表1可见,与sham组比较,LPS组IL-1β、TNF-α表达水平显著升高,IL-10表达水平显著降低,组间有显著性差异(P<0.001);与LPS组比较,DH+LPS组IL-1β、TNF-α表达水平显著降低,IL-10的表达水平显著升高,组间有显著性差异(P<0.01或P<0.001)。
表1 复方地黄颗粒对LPS模型大鼠黑质纹状体炎症因子含量表达的影响(,n=8)Table 1 Effect of compound Rehmannia granule on expression of inflammatory factors in substantia nigra and striatum of LPS model rats(,n=8)

表1 复方地黄颗粒对LPS模型大鼠黑质纹状体炎症因子含量表达的影响(,n=8)Table 1 Effect of compound Rehmannia granule on expression of inflammatory factors in substantia nigra and striatum of LPS model rats(,n=8)
注:与假手术组相比,ΔP<0.001;与LPS模型组相比,▲P<0.01,▲▲P<0.001。(下表同)Note.Compared with sham group,ΔP<0.001.Compared with LPS model group,▲P<0.01,▲▲P<0.001.(The same in the following tables)
组别Groups IL-1β(pg/mL) TNF-α(pg/mL) IL-10(pg/mL)假手术组Sham group 177.48±7.38 845.58±7.12 467.33±6.57脂多糖模型组LPS model group 212.06±4.58Δ 893.34±5.02Δ 374.31±9.17Δ复方地黄颗粒+脂多糖组DH+LPS group 197.79±10.11▲ 858.02±8.80▲▲ 453.87±13.45▲▲
2.2.2 复方地黄颗粒对6-OHDA模型大鼠黑质纹状体炎症因子含量表达的影响
由表2可见,与sham组比较,6-OHDA组IL-1β、TNF-α表达量显著升高,IL-10表达水平显著降低,组间有显著性差异(P<0.001);与6-OHDA组比,DH+6-OHDA组IL-1β、TNF-α显著降低,IL-10表达水平显著升高,组间有显著性差异(P<0.001)。
表2 复方地黄颗粒对6-OHDA模型大鼠黑质纹状体炎症因子含量表达的影响(n=8)Table 2 Effect of compound Rehmannia granule on the expression of inflammatory factors in substantia nigra and striatum of 6-OHDA model rats(,n=8)

表2 复方地黄颗粒对6-OHDA模型大鼠黑质纹状体炎症因子含量表达的影响(n=8)Table 2 Effect of compound Rehmannia granule on the expression of inflammatory factors in substantia nigra and striatum of 6-OHDA model rats(,n=8)
组别Groups IL-1β(pg/mL) TNF-α(pg/mL) IL-10(pg/mL)假手术组Sham group 187.80±7.74 793.40±11.62 438.32±13.56 6-羟基多巴胺模型组6-OHDA model group 223.21±8.62Δ 981.80±6.33Δ 375.94±10.76Δ复方地黄颗粒+6-羟基多巴胺组DH+6-OHDA group 203.02±1.55▲▲ 862.35±12.74▲▲ 403.13±7.78▲▲
2.3 复方地黄颗粒对模型大鼠黑质纹状NF-κ Bp65、p-NF-κ Bp65蛋白表达的影响
由表3、图3见,与sham组比较,6-OHDA组及LPS组大鼠NF-κ Bp65、p-NF-κ Bp65表达水平显著升高,组间有显著性差异(P<0.05,P<0.001);与6-OHDA组及LPS组相比较,DH+6-OHDA及DH+LPS组NF-κ Bp65、p-NF-κ Bp65表达水平显著降低,组间有显著性差异(P<0.05,P<0.001)。

图3 复方地黄颗粒对模型大鼠黑质纹状体NF-κ Bp65和p-NF-κ Bp65蛋白表达的影响Figure 3 Effect of compound Rehmannia granule on NF-κ Bp65 and p-NF-κ Bp65 protein expression in substantia nigra and striatum of model rats
表3 复方地黄颗粒大鼠黑质纹状体NF-κ Bp65、p-NF-κ Bp65蛋白表达的影响(,n=8)Table 3 Effect of compound Rehmannia granule on NF-κ Bp65 and p-NF-κ Bp65 protein expression in substantia nigra and striatum of model rats(,n=8)

表3 复方地黄颗粒大鼠黑质纹状体NF-κ Bp65、p-NF-κ Bp65蛋白表达的影响(,n=8)Table 3 Effect of compound Rehmannia granule on NF-κ Bp65 and p-NF-κ Bp65 protein expression in substantia nigra and striatum of model rats(,n=8)
注:与假手术组比较,▲P<0.05,▲▲P<0.001;与LPS模型组比较,ΔΔP<0.001;与6-OHDA模型组比较,■P<0.05,■■P<0.001。(下表同)Note.Compared with sham group,▲P<0.05,▲▲P<0.001.Compared with LPS model group,ΔΔP<0.001.Compared with 6-OHDA model group,■P<0.05,■■P<0.001.(The same in the following tables)
组别Groups NF-κ Bp65 p-NF-κ Bp65假手术组Sham group 0.53±0.16 0.29±0.11 6-羟基多巴胺模型组6-OHDA model group 1.44±0.15▲▲ 0.54±0.04▲复方地黄颗粒+6-羟基多巴胺组DH+6-OHDA group 0.64±0.13■■ 0.30±0.10■脂多糖模型组LPS model group 1.21±0.14▲▲ 0.74±0.25▲▲复方地黄颗粒+脂多糖组DH+LPS group 0.69±0.13ΔΔ 0.28±0.02ΔΔ
2.4 复方地黄颗粒对模型大鼠黑质纹状体TH、Iba1蛋白表达的影响
由表4、图4可见,与sham组比较,LPS组及6-OHDA组Iba1表达水平显著升高,TH表达水平显著降低,组间有显著性差异(P<0.05,P<0.001);与6-OHDA组及LPS组相比较,DH+6-OHDA组及DH+LPS组Iba1表达水平显著降低,TH表达水平显著升高,组间有显著性差异(P<0.05,P<0.001)。

图4 复方地黄颗粒对模型大鼠黑质纹状体Iba1和TH蛋白表达的影响Figure 4 Effect of compound Rehmanniagranule on Iba1 and TH protein expression in substantia nigra and striatum of model rats
表4 复方地黄颗粒对模型大鼠黑质纹状体TH、Iba1蛋白表达的影响(,n=8)Table 4 Effect of compound Rehmannia granule on TH and Iba1 protein expression in substantia nigra and striatum of model rats(n=8)

表4 复方地黄颗粒对模型大鼠黑质纹状体TH、Iba1蛋白表达的影响(,n=8)Table 4 Effect of compound Rehmannia granule on TH and Iba1 protein expression in substantia nigra and striatum of model rats(n=8)
组别Groups Iba1 TH假手术组Sham group 0.64±0.09 0.85±0.06 6-羟基多巴胺模型组6-OHDA model group 0.96±0.10▲ 0.50±0.06▲▲复方地黄颗粒+6-羟基多巴胺组DH+6-OHDA group 0.42±0.28■■ 0.64±0.05■脂多糖模型组LPS model group 0.86±0.06▲▲ 0.61±0.08▲▲复方地黄颗粒+脂多糖组DH+LPS group 0.49±0.07ΔΔ 0.89±0.13ΔΔ
3 讨论
PD属中医学“颤振”“振掉”范畴。现代医学研究表明[10-12],PD发病是衰老、基因突变、环境神经毒素(重金属及杀虫剂)及脑外伤等多重因素共同作用的结果。实验研究表明,复方地黄颗粒可通过抑制氧化应激、调控黑质多巴胺能神经元凋亡等机制发挥神经保护作用[13-14],但复方地黄颗粒的神经保护作用是否与抗炎作用相关尚待进一步研究证实。
小胶质细胞属中枢神经系统固有免疫监视细胞,参与神经元的发育及神经突触的重塑等多种病理、生理过程[15]。有研究表明,过度激活的小胶质细胞可释放多种致炎因子或细胞毒性因子导致神经元损伤,诱发或加速PD、阿尔茨海默病(Alzheimer disease,AD)等神经退行性疾病的病变进程[16]。
LPS为革兰氏阴性菌胞壁的主要成分,广泛应用于炎症相关PD动物模型的制备[17]。LPS用于制备PD模型动物多采用腹腔注射方式,其不足之处为不能通过血脑屏障,且外周给药其刺激作用持续时间较短,故不宜于长期实验动物模型的研究。本研究采用黑质立体定位注射术将LPS直接注射于中脑黑质部,药物直接透过血脑屏障被注入黑质致密部。实验结果显示,该造模方法具有造模成功率高、症状持续较为持久的特征。
6-OHDA为儿茶酚胺类神经递质多巴胺的羟基化衍生物,采用脑立体定位注射术可透过血脑屏障直接将其注射于中脑黑质区,在多巴胺转运体(dopamine transporter,DAT)作用下进入多巴胺能神经元,在神经元内被氧化产生过氧化氢、羟自由基等神经毒性物质,诱导氧化应激及线粒体功能障碍,加速黑质致密部多巴胺能神经元变性、丢失[18],该造模方法多用于长期慢性PD实验动物模型的研究。本研究采用LPS、6-OHDA动物模型为研究对象,深入探讨复方地黄颗粒对模型大鼠小胶质细胞激活、炎症因子表达及神经行为学的干预作用。
NF-κ B信号通路由NF-κ B1(p50)、NF-κ B(p52)、RelA(p65)、Rel B和Rel(c-Re1)5种家族成员构成[19]。生理状态下,该蛋白家族成员以异二聚体的形式(以p65/p50异二聚体为主)与其抑制因子Iκ B(inhibitors of NF-κB)结合呈稳态形式存在于胞浆中。病理状态下,激活的NF-κ B信号通路通过正负反馈机制参与机体免疫炎症反应、细胞增殖及凋亡等病理生理过程[20]。Muhammad等[21]研究表明,LPS预处理的C57BL/6小鼠海马区细胞及BV2模型细胞其激活标志物Iba1及p-NF-κ B及IL-1β等炎性因子表达水平显著升高,故抑制小胶质细胞NF-κ B信号通路激活及促炎因子过度表达将有助于PD的临床治疗。
复方地黄颗粒由熟地黄、丹参、钩藤、石菖蒲、全蝎、杭白芍、珍珠母7味药物组成。熟地黄味甘微温,入肝、肾经,长于滋阴养血、补肾填精。《长沙药解》曰其可“凉肝滋血,清风润木,……滋风木……,血脱甚良”。丹参味苦,微寒,归心、肝经,长于活血祛瘀,通络止痛。全蝎,味辛性平,入肝经,长于息风通络,解毒散结,镇惊止痛。《医宗必读卷十·痹》曰:“治风先治血,血行风自灭”,临床实践证实,丹参、全蝎合用共奏活血通络、养血息风之效,二药合用则息风之力倍增[22]。石菖蒲味辛苦,性温,归心、胃经,长于化湿开胃、豁痰开窍、醒神益智。《本草备要》曰其可主“补肝益心,去湿逐风,……,风痹惊痫。”诸疾。钩藤甘苦,微寒,归肝、心包经,长于清热平肝,息风定惊。白芍味苦,性平,归肝、脾经,长于补血调经药,《神农本草经》曰:“主邪气腹痛,除血痹,……,利小便,益气”。钩藤、合用白芍共奏养血柔肝、息风止颤之功。珍珠母,咸、寒,归心,肝经,长于平肝潜阳,息风定惊。临床实践表明,复方地黄颗粒功效以补益肝肾,祛瘀通络、息风见长,该方对PD患者失眠、抑郁及便秘等非运动症状有显著改善。
现代药理研究证实,熟地黄含有毛蕊花糖苷、玉叶金花苷酸、海胆苷等13种抗氧化活性成分[23]。周艳等[24]等研究表明,熟地黄多糖可提高亚急性衰老模型大鼠血肝、脑、肾脏器指数,降低肝、脑、肾组织丙二醛(MDA)含量表达。刘培建等[25]研究表明,中、高剂量熟地黄多糖能够促进气血亏虚模型小鼠血清粒-巨噬细胞集落集落刺激因子含量,提升小鼠红细胞及血红蛋白表达水平。全蝎含有蝎毒、多糖、氨基酸及三甲胺、甜菜碱等活性成分,相关研究表明,全蝎对肿瘤、心脑血管疾病等临床各科疾病疗效显著[26]。现代医学研究表明,丹参所含丹参酮、丹参酚酸等主要成分可通过多靶点、多途径显著改善微循环功能障碍,调节由抗动脉粥样硬化所致的心脑血管功能障碍,保护器官免受炎症损[27-28]。现代药理研究表明,石菖蒲含α-细辛醚(α-Asarone)、β-细 辛 醚(β-Asarone)、丁 香 烯(caryophyllene)等药理活性挥发油,通过抗炎、调节免疫等药理作用对中枢神经系统功能发挥正、负双向调节作用,调节血脑屏障通透功能,抑制大脑神经元凋亡[29-30]。现代药理研究证实,钩藤含黄酮、萜类、皂苷异、去氢钩藤碱(isocorynoxeine)等药理成分,具有抗炎、降压、神经保护及平喘等功效[31]。白芍含没食子酸、儿茶素、芍药苷、芍药内酯苷等药理活性成分,现代药理研究证实,白芍具有抗炎、抗氧化、养血保肝及神经保护等功效[32]。王成龙[33]研究证实,芍药苷、芍药内酯苷通过调控脑组织cAMP/PKA信号通路环磷酸腺苷(cyclic adenosine monophosphate,cAMP)、蛋白激酶A(protein kinase A,PKA)含量发挥养血柔肝作用。珍珠母含大量碳酸钙、碳酸镁及丝氨酸等有机或无机成分,现代研究表明,其功效以镇静、抗炎、抗氧化应激等为主[34]。临床研究表明,珍珠母对心脑血管、胃肠消化系统及精神类疾病均显示出较佳的疗效[35-37]。
实验研究结果表明,6-OHDA、LPS模型大鼠在造模后第2周经腹腔注射阿扑吗啡诱导出自患侧向健侧发起的首尾衔接的持续的自发性旋转行为,其证候表现与相关文献报道相符。与6-OHDA及LPS组比较,复方地黄颗粒灌胃后DH+6-OHDA组及DH+LPS组大鼠黑质纹状体IL-1β、TNF-α含量表达显著降低,IL-10含量表达显著升高,复方地黄颗粒对模型大鼠神经行为学的干预作用与其抑制模型大鼠黑质纹状体促炎因子含量表达相关。
实验结果显示,与sham组比较,6-OHDA、LPS模型组大鼠黑质纹状体Iba1、NF-κ Bp65、p-NF-κ Bp65表达水平显著升高,TH表达水平显著降低。复方地黄颗粒灌胃后大鼠黑质纹状体Iba1、NF-κ Bp65、p-NF-κ Bp65表达水平显著降低,TH表达水平显著升高。复方地黄颗粒通过抑制黑质纹状体小胶质细胞NF-κ B信号通路激活,下调IL-1β、TNF-α等炎症因子表达,显著改善模型大鼠神经行为学障碍。
综上所述,小胶质细胞激活及促炎因子高水平表达与PD的发病密切相关。复方地黄颗粒通过抑制模型大鼠黑质纹状体小胶质细胞激活,下调炎症因子TNF-α、IL-1β含量表达调节模型大鼠神经行为学障碍。复方地黄颗粒对PD模型大鼠神经行为学异常的干预作用与其抗炎机制相关,本研究进一步丰富了复方地黄颗粒治疗PD的理论基础。
