自发性高血压大鼠心肌纤维化时序动态变化
2022-01-24赵健清丁露曾俊义应国秋文渊聂俊刚易达松
赵健清,丁露,曾俊义,应国秋,文渊,聂俊刚,易达松
(1.南昌大学第一附属医院心血管内科,南昌 330006;2.南昌大学第一附属医院高血压病研究所,南昌 330006)
高血压是当前临床患病率最高的心血管疾病之一,我国成人高血压患者已达2.45亿,且随着年龄的增加患病率逐渐升高[1]。高血压患者可出现左心室肥厚、心肌纤维化、心肌细胞凋亡等病理性改变,继而导致心室重构、心律失常和心力衰竭,其中心肌纤维化是高血压导致心肌损伤和结构重塑的重要病理特征[2]。心肌纤维化(myocardial fibrosis,MF)是指心肌成纤维细胞在高血压等因素影响下出现过度增殖,引起Ⅰ型和Ⅲ型胶原为主的细胞外基质比例失调、过度沉积和排列紊乱,从而导致心肌纤维化、心脏顺应性降低、心脏功能障碍,最终引发恶性心律失常及心力衰竭的一系列病理性改变过程[3]。因此,积极探索高血压心肌纤维化发生机制,寻找延缓甚或逆转纤维化进展的治疗方法对于高血压防治具有重要意义。SHR是最接近人类原发性高血压病理生理的遗传性动物模型,是高血压心肌纤维化研究较为理想的实验动物。本研究以SHR为对象,通过多时点观测4~42周SHR血压水平、心脏结构与功能、心肌纤维化组织病理及纤维化相关基因表达的动态变化,多时点多维度呈现SHR心肌纤维化伴随鼠龄及血压改变的特征性时序动态变化,可为高血压心肌纤维化相关研究提供参考。
1 材料与方法
1.1 材料
1.1.1 实验动物
4周龄SPF级雄性SHR大鼠45只,体重(62.8±5.7)g、WKY大鼠35只,体重(68.5±6.2)g,购于北京维通利华实验动物技术有限公司【SCXK(京)2016-0006】,饲养于南昌大学第一附属医院动物实验室【SYXK(赣)2021-0003】,随机分笼饲养,24 h自由饮水和进食,饲养至42周,分别于预设时点检测大鼠各项指标。饲养环境:昼夜各半循环照明,湿度恒定,温度控制在22~25℃。所有操作均符合南昌大学第一附属医院科学实验伦理学要求(审批号:(2021)医研伦审第(5-075))。
1.1.2 主要试剂与仪器
大小鼠智能无创血压计BP-2010A(北京软隆生物技术有限公司);Vevo 2100超高分辨率小动物超声成像系统(加拿大VisualSonics公司);荧光定量PCR仪(美国Applied Biosystems公司);正置荧光显微镜BX51(日本Olympus公司)。Masson染色试剂盒(北京索莱宝科技有限公司);TRNzol Universal Reagent(天根生化科技(北京)有限公司);FastQuant RT Kit(with gDNase)(天根生化科技(北京)有限公司);SuperReal PreMix Plus(SYBR Green)(天根生化科技(北京)有限公司);大鼠TGF-β1、Ⅰ型胶原、Ⅲ型胶原、GAPDH引物(深圳华大基因股份有限公司)。
1.2 方法
1.2.1 鼠尾无创血压监测大鼠血压
分别于6、8、12、18、24、32、42周测量SHR及WKY收缩压,血压测量釆用大小鼠智能无创血压计以间接测量法(尾套法)进行,每次血压测量时段相对固定(14:00~18:00)。间隔1 min,重复测量5次,舍去最高和最低值,取其他3个数值均数作为血压测量值。每次血压测量保持可重复的实验环境,确保血压测量数据的可对照性。
1.2.2 超声心动图监测大鼠心脏结构及功能
采用超高分辨率小动物超声成像系统,分别于6、8、12、18、24、32、42周进行大鼠心脏超声心动图检测。测量如下参数:舒张期室间隔厚度(interventricular septal thickness at diastole,IVST)、左心室舒张期末后壁厚度(left ventricular posterior wall thickness at end diastole,LVPWT),左心室射血分数(left ventricular ejection fraction,LVEF)由超声系统软件自动测算。各参数检测值取5个心动周期平均值。
1.2.3 大鼠左室心肌组织病理形态检测
分别于6、8、12、18、24、32、42周进行腹腔注射麻醉,迅速剖胸取出心脏,沿房室环剪去心房及右心室游离壁,保留室间隔和左心室游离壁,测量左室质量,计算左室质量指数(left ventricular mass index,LVMI);大鼠左心室组织进行Masson染色,计算胶原容积分数(Collagen Volume Fraction,CVF)。正置显微镜下观察心肌组织形态并拍照,采用Image J软件进行图片分析,高倍视野下计算出心肌组织胶原纤维面积占整个组织面积的百分比,即胶原容积分数=胶原面积/总面积,每个标本均随机取3个视野测量,计算其均值。
1.2.4 qRT-PCR检测大鼠心肌纤维化基因TGFβ1、Ⅰ型胶原、Ⅲ型胶原
分别于6、8、12、18、24、32、42周获取大鼠左心室组织,依次进行总RNA提取、cDNA合成及qPCR反应,分别按试剂说明书进行。TGF-β1:上游引物5’-GGCTACCATGCCAACTTCTG-3’,下游引物5’-CGTAGTAGACGATGGGCAGT-3’;CollagenⅠ:上游引物5’-CCCTGCTGGAGAAGAAGGAA-3’,下游引物5’-AGGAGAACCTTTGGGACCAG-3’;CollagenⅢ:上游引物5’-ACTGGTGAACGTGGCTCTAA-3’,下 游 引 物5’-GGACCTGGATGTCCACTTGA-3’;GAPDH:上 游 引 物5’-CAAGTTCAACGGCACA GTCAAG-3’,下 游 引 物5’-ACATACTCAGCAC CAGCATCAC-3’。以GAPDH为内参,2-△△CT计算TGF-β1、CollagenⅠ及CollagenⅢ基因相对表达量。
1.3 统计学分析
2 结果
2.1 鼠尾无创血压监测大鼠血压
两组间相比,6周时WKY与SHR血压处于同一水平,8周时SHR血压较WKY显著升高,8周至18周SHR与WKY血压差距持续扩大,此后随周龄增长,SHR与WKY血压差距持续存在(见表1)。
2.2 超声心动图监测大鼠心脏结构及功能
6周时两组大鼠IVST、LVPWT均相近;12周时SHR组IVST较WKY显著增加,此后IVST差异在同周龄两组大鼠间持续扩大,并于32周时达到最大,32周后两组间IVST差异有所回落;8周时SHR组LVPWT即较WKY显著增加,此后LVPWT差异同样在同周龄两组大鼠间持续扩大,于32周时达到最大,32周后两组间LVPWT差异有所减小。LVEF在不同周龄SHR或WKY间无显著变化,同周龄两组大鼠间亦无明显差异(见表2)。
2.3 大鼠心肌组织病理形态改变
除8周时两组大鼠LVMI相接近,余同周龄SHR组LVMI均显著高于WKY(见表3)。Masson染色显示,相较于WKY,SHR心肌肌束间隙随鼠龄增加不同程度增大,心肌细胞间质和血管周围可见明显的纤维化改变,并伴有胶原沉积(见图1);6周时两组大鼠CVF相近,12周SHR组CVF较WKY显著增加,此后CVF差异在同周龄两组大鼠间持续扩大(见表3)。
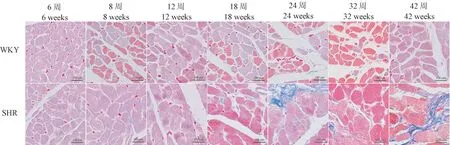
图1 不同周龄大鼠左室心肌masson染色Figure 1 Masson staining of left ventricular myocardium in rats at different ages

周龄Age WKY血压(mmHg)SBP of WKY(mmHg) SHR血压(mmHg)SBP of SHR(mmHg)6周6 weeks 84.83±3.82△▽ 85.39±4.47△▽8周8 weeks 108.49±6.12#▽ 126.97±13.35*#▽12周12 weeks 133.63±10.33#△ 174.15±4.09*#△18周18 weeks 134.52±5.31#△ 184.90±5.23*#△24周24 weeks 128.40±16.43#△ 179.13±5.45*#△32周32 weeks 129.04±7.99#△ 187.32±13.46*#△42周42 weeks 115.05±8.95#▽ 184.61±5.29*#△
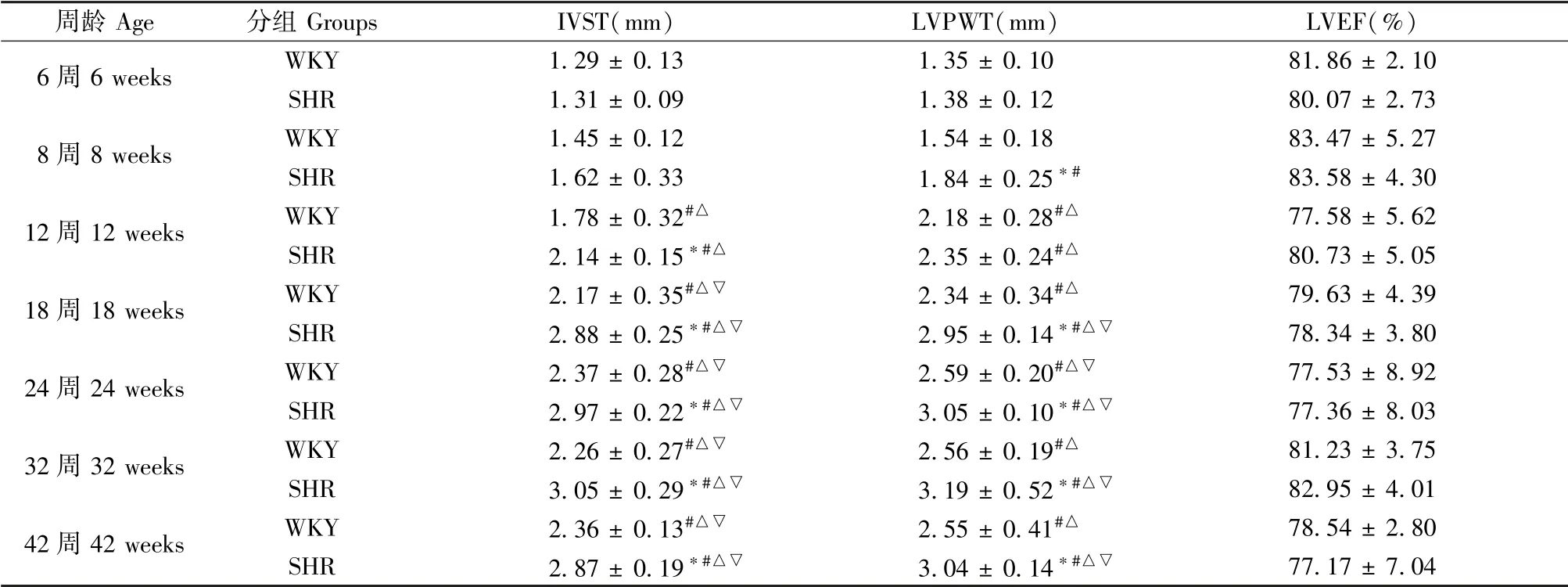
周龄Age 分组Groups IVST(mm) LVPWT(mm) LVEF(%)6周6 weeks WKY 1.29±0.13 1.35±0.10 81.86±2.10 SHR 1.31±0.09 1.38±0.12 80.07±2.73 8周8 weeks WKY 1.45±0.12 1.54±0.18 83.47±5.27 SHR 1.62±0.33 1.84±0.25*# 83.58±4.30 12周12 weeks WKY 1.78±0.32#△ 2.18±0.28#△ 77.58±5.62 SHR 2.14±0.15*#△ 2.35±0.24#△ 80.73±5.05 18周18 weeks WKY 2.17±0.35#△▽ 2.34±0.34#△ 79.63±4.39 SHR 2.88±0.25*#△▽ 2.95±0.14*#△▽ 78.34±3.80 24周24 weeks WKY 2.37±0.28#△▽ 2.59±0.20#△▽ 77.53±8.92 SHR 2.97±0.22*#△▽ 3.05±0.10*#△▽ 77.36±8.03 32周32 weeks WKY 2.26±0.27#△▽ 2.56±0.19#△ 81.23±3.75 SHR 3.05±0.29*#△▽ 3.19±0.52*#△▽ 82.95±4.01 42周42 weeks WKY 2.36±0.13#△▽ 2.55±0.41#△ 78.54±2.80 SHR 2.87±0.19*#△▽ 3.04±0.14*#△▽ 77.17±7.04
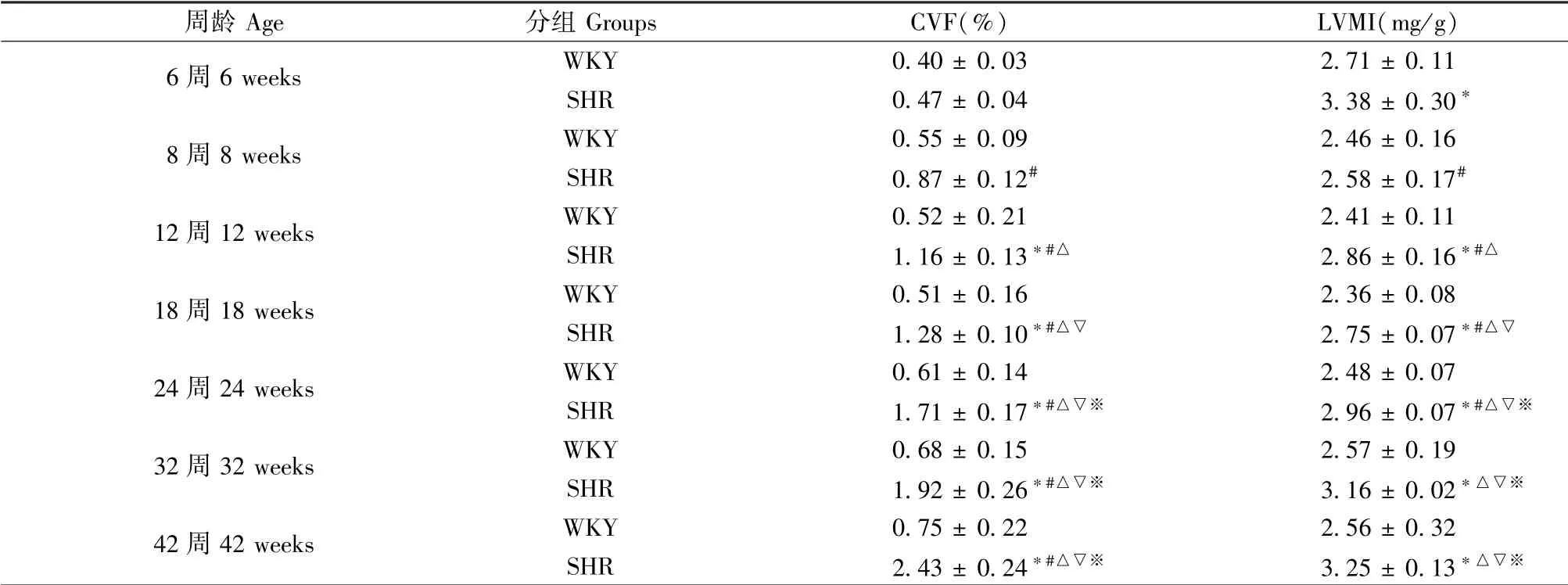
周龄Age 分组Groups CVF(%) LVMI(mg/g)6周6 weeks WKY 0.40±0.03 2.71±0.11 SHR 0.47±0.04 3.38±0.30*8周8 weeks WKY 0.55±0.09 2.46±0.16 SHR 0.87±0.12# 2.58±0.17#12周12 weeks WKY 0.52±0.21 2.41±0.11 SHR 1.16±0.13*#△ 2.86±0.16*#△18周18 weeks WKY 0.51±0.16 2.36±0.08 SHR 1.28±0.10*#△▽ 2.75±0.07*#△▽24周24 weeks WKY 0.61±0.14 2.48±0.07 SHR 1.71±0.17*#△▽※ 2.96±0.07*#△▽※32周32 weeks WKY 0.68±0.15 2.57±0.19 SHR 1.92±0.26*#△▽※ 3.16±0.02*△▽※42周42 weeks WKY 0.75±0.22 2.56±0.32 SHR 2.43±0.24*#△▽※ 3.25±0.13*△▽※
2.4 大鼠心肌纤维化基因TGF-β1、I型胶原、Ⅲ型胶原表达变化
6周时SHR较WKY左室心肌TGF-β1表达明显上调,此后两组间表达差异逐渐缩小,到32周时表达接近,随后SHR表达再次上升,42周时SHR较WKY表达显著上调(见图2)。
6周至24周两组大鼠Ⅰ型胶原表达相近,24周后SHR左室心肌Ⅰ型胶原表达明显上升,42周时SHR较WKY表达显著上调(见图3)。
6周至24周两组大鼠Ⅲ型胶原表达相近,32周时SHR较WKY表达明显上调,至42周时表达差异进一步扩大(见图4)。
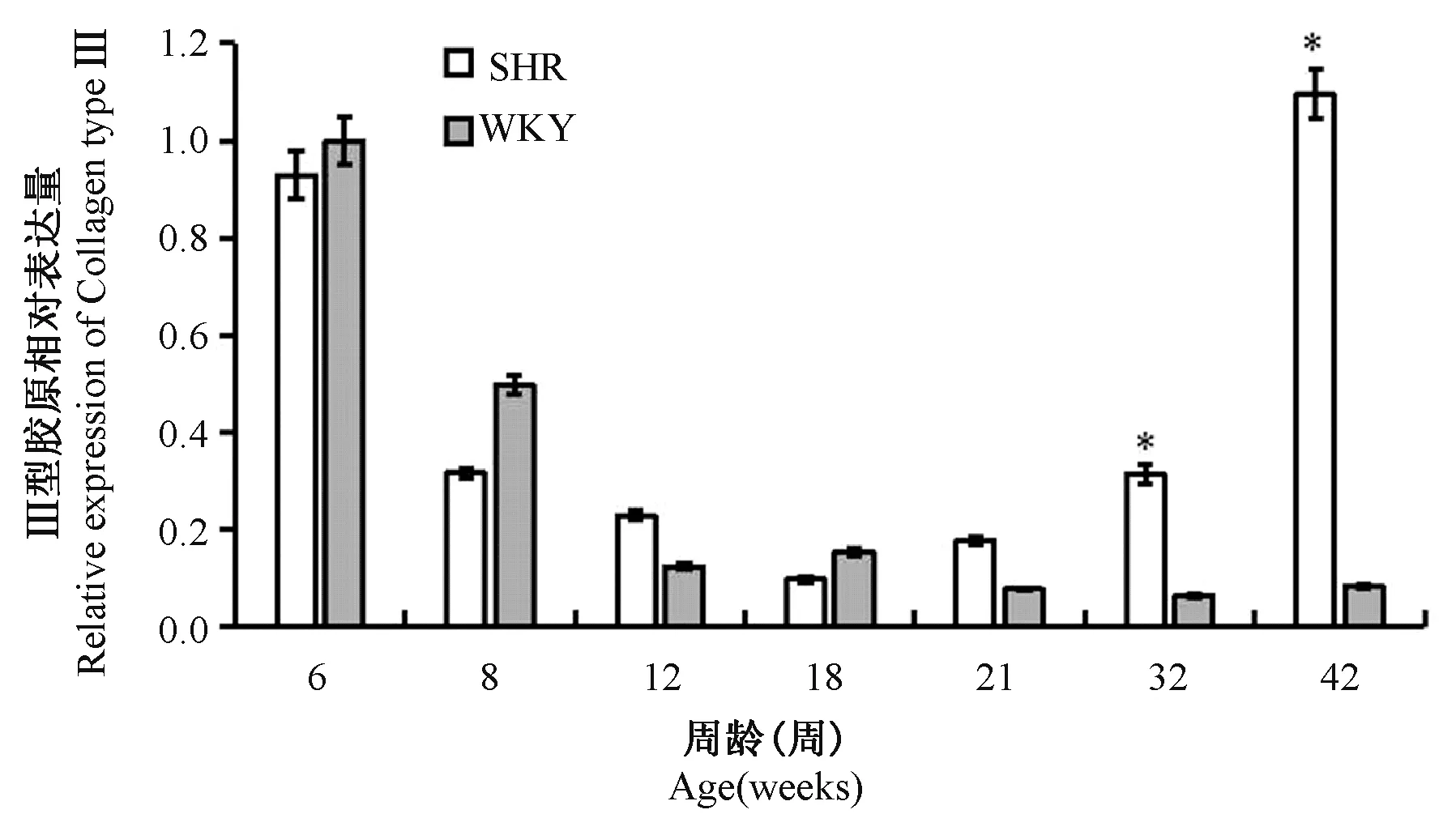
图4 不同周龄大鼠左室心肌Ⅲ型胶原基因动态表达Figure 4 Dynamic expression of CollagenⅢin left ventricular myocardium of rats at different ages
3 讨论
高血压心肌纤维化是一个众多体液因子参与调节的病理过程,可引起心力衰竭、心律失常和心源性猝死等严重并发症,对公众健康构成严重危害[4-5]。因此,积极探索高血压心肌纤维化相关发生机制,对于预防或者逆转心肌纤维化的发生具有重要意义。相较于遗传性高血压大鼠(GHR)和Dahl盐敏感性大鼠(DSR),SHR是国际上公认的、应用最广泛的、最接近人类原发性高血压的动物模型。SHR模型在自然培育条件下产生高血压以及心肌纤维化,避免了人工干预造成的创伤,可以作为高血压致心肌纤维化的理想动物模型[6]。有别于既往相关研究,本研究选择4~42周SHR为观测对象,共设7个观测时点,从血压水平、心脏结构功能、心肌组织病理、纤维化相关基因表达等多个维度评估SHR心肌纤维化的动态演变,评价体系更为连续多元,可为高血压心肌纤维化的相关研究提供坚实有益的参考。
本研究结果显示,6~12周SHR血压持续快速升高,之后趋于平稳并维持高位波动,呈现了SHR血压时序变化特征[7-8]。伴随血压升高并高位维持,心脏后负荷逐渐增大,SHR心脏出现时序性肥厚改变。Iliev等[9]研究发现,伴随SHR鼠龄增加,心肌细胞逐渐肥大,心肌纤维化增加。CVF作为一个可量化弥散性心肌纤维化指标,随SHR鼠龄增长逐渐增加,提示SHR心肌纤维化呈鼠龄依赖性动态改变。值得关注的是,LVEF在不同周龄SHR或WKY间无显著变化,同周龄两组大鼠间亦无明显差异,与陈建桥等[10]的研究一致,心肌纤维化在HFpEF患者临床症状出现之前即已存在,病程早期LVEF不会随着心肌纤维化而发生显著改变。纵观SHR血压与心脏重构相关指标动态变化,SHR心肌纤维化相较血压存在一定的迟滞性,符合高血压心肌纤维化大体宏观演变过程。
相关研究表明,TGF-β1、Ⅰ型胶原和Ⅲ型胶原等指标可以从不同层面反映心肌纤维化的演变,可作为心肌纤维化的动态观测指标[11-13]。本研究显示,32周前SHR和WKY左室心肌TGF-β1表达均随鼠龄增加呈下调趋势,32周后SHR左室心肌TGF-β1表达逐渐上升,42周时较WKY表达显著上调,与SHR心肌纤维化前期处于较低水平而后期迅速发展相符。TGF-β1介导的信号通路是多种疾病导致心肌纤维化的共同途径,可通过促进心肌成纤维细胞向成肌纤维细胞表型转化以及上调结缔组织生长因子等细胞因子表达,诱导纤维细胞增殖,进而促进心肌纤维化[14]。高血压相关临床研究表明,高血压患者血浆中总TGF-β1及活化TGF-β1水平均较正常血压者显著升高,与高血压引发的心、肾纤维化等靶器官损害有关[15]。在心肌组织的胶原网络中,Ⅰ、Ⅲ型胶原的表达水平及比例变化决定了心肌纤维化的发生发展[16-17]。本研究中Ⅰ型胶原与Ⅲ型胶原表达均呈现先降后升的趋势,与TGF-β1表达呈现时空一致性,再次印证SHR心肌纤维化的时序动态变化特征。有报道显示,TGF-β1作为胶原合成的驱动因子,可通过旁分泌和自分泌方式刺激成纤维细胞增生,促使合成胶原增加,表明TGF-β1、Ⅰ型胶原和Ⅲ型胶原可指示心肌纤维化的发生发展[18]。
通过对SHR中长期的持续观测,证实伴随SHR的鼠龄及血压改变,其心肌纤维化不断演变发展,并从宏观入微观呈现出时序改变的特征,充分展现SHR作为高血压心肌纤维化动物模型的独特价值,有助于高血压心肌纤维化的相关研究的开展。
