参白解毒方对溃疡性结肠炎肠黏膜上皮细胞保护作用机制研究
2022-01-24徐长亮沈卫星程海波
江 东,徐长亮,沈卫星,程海波
(1.南京中医药大学第一临床医学院,江苏 南京 210023;2.江苏省中医药防治肿瘤协同创新中心 国家中医药管理局名医验方评价与转化重点实验室,江苏 南京 210023)
溃疡性结肠炎(Ulcerative colitis,UC)是一种高发于30~40岁年龄的慢性、特发性的炎症性肠病,可导致直肠并蔓延至结肠的黏膜炎症甚至溃疡,其发病率在全球范围呈上升趋势[1-2]。UC具有高复发、高致残率的特点,虽然炎症有一定的自限性,但慢性炎性可引起细胞DNA损伤及修复程序的错乱,导致正常细胞向恶性转化,最终导致癌变[3-4]。因此,UC被认为是结直肠癌(Colorectal cancer,CRC)重要的癌前病变,随着UC患病时间的积累,大肠癌的风险也逐渐增加,30年病程引发大肠癌风险高达18%[5]。现代医学治疗UC的主要药物治疗有5-ASA化合物、类固醇类、硫唑嘌呤、巯基嘌呤、英夫利昔单抗等,约20%~30%患者甚至需要手术治疗[6-7],尽管积极治疗仍易反复发作,且有明显的不良反应和局限性[8]。中医药包含丰富的药物资源,研究发现大量中药及相关化合物可发挥防治溃疡性结肠炎的作用,且不良反应极少,有望成为替代治疗[9-10]。本团队在国医大师周仲瑛教授倡导的“癌毒病机”理论指导下,提炼拟定了防治结直肠癌癌前病变的中药复方——参白解毒方(Shenbai Jiedu decoction,SBJDF),并已在临床开展大样本多中心的疗效评价研究。在前期临床研究基础上,参白解毒方对炎症性肠病具有显著疗效,本研究主要从细胞周期的角度探讨参白解毒方对溃疡性结肠炎肠黏膜上皮细胞的保护作用机制。
1 材料和方法
1.1 实验材料
1.1.1 药物与制备:参白解毒方由苦参、白花蛇舌草、党参、白术等药物组成,中药饮片均购于江苏亚邦中药材饮片有限公司,经南京中医药大学邹立思教授鉴定为道地药材。制备方法:中药浸泡后10倍水煎煮第1次,8倍水煎煮第2次,各2 h,减压浓缩至适当体积最终成1.2 g/ml浓度的滤液,醇沉后抽滤,旋去乙醇,抽滤浓缩至2 mg/ml,-80 ℃冰箱冷冻1 d,冻干1~2 d,常温保存备用,放入带有无水硅胶的干燥器中备用。
1.1.2 主要试剂与仪器:Dextran sulfate sodium salt(MP公司,批号:02160110-CF);胎牛血清(Gibco公司,批号:10099-141C);DMEM培养基(上海源培生物科技有限公司,批号:B200705);细胞分裂液(Biosharp公司,批号:3227440);MTT(Sigma公司,批号:MKCK3153);CyclinA2(abcam公司,批号:GR11520-18);CDK1(abcam公司,批号GR304868-3);GAPDH抗体(美国CST公司,批号:5174);细胞周期与凋亡试剂盒(Invitrogen公司,批号:1999470);kFluor488-EdU法细胞增殖检测试剂盒(江苏凯基生物技术股份有限公司)。XB224型电子天平(上海精密仪器仪表有限公司);全自动细胞计数器(Countstar公司);SL16型低速离心机(赛默飞世尔公司);HERAcell 150i型二氧化碳培养箱(赛默飞世尔公司);PowerPacTMBasic型电泳仪(Bio-Rad公司);化学发光成像系统(Tanon公司);TS-317型3D脱色摇床(其林贝尔仪器制造有限公司);CytoFlex型流式细胞仪(BECKMAN公司);SPARK 10M型酶标仪(TECAN公司);涡旋混合器(WiseMix公司);Ti型倒置荧光显微镜(尼康公司)。
1.1.3 细胞株:人正常结直肠黏膜上皮细胞(Normal human fetal colonic mucosa cells,FHC)由名医验方评价与转化重点实验室提供。
1.2 实验方法
1.2.1 细胞培养:将FHC细胞培养在含有10% FBS、100 U/ml青霉素、100 U/ml链霉素的DMEM培养基中,培养环境为饱和湿度、37 ℃、5% CO2的细胞培养箱。在倒置显微镜下观察细胞生长状态,细胞处于对数生长期时进行下一步实验。
1.2.2 MTT检测细胞增殖:收集FHC人正常结直肠黏膜上皮细胞并计数,细胞以5×104ml密度接种于96孔板,每孔100 μl,置于5% CO2孵化箱中培养24 h。取细胞弃去细胞上清,分别设立:空白组、1.0%、1.5%、2.0%使用葡聚糖硫酸钠(Dextran sulfate sodium salt,DSS)造模组,给药后造模组培养基中DSS溶液终浓度分别为1.0%、1.5%、2.0%,继续培养48 h。实验过程中注意去上清应尽快加样,避免细胞干燥死亡,各时间点结束后每孔加入20 μl MTT溶液,继续5% CO2孵化箱中培养4 h。取出细胞,吸去上清,加入200 μl DMSO,摇床振荡10 min充分溶解结晶,酶标仪检测490 nm处吸光度值,分析结果。
1.2.3 细胞形态观察: 取对数生长期的FHC细胞,PBS小心漂洗细胞,加入胰酶后置于37 ℃孵箱消化,待消化完成加入培养基并离心,去上清,加入培养基接种在培养皿。分别设空白组、模型组(2% DSS)、参白解毒方低剂量组(2% DSS和0.4 mg/ml SBJDF)、参白解毒方中剂量组(2% DSS 和 0.8 mg/ml SBJDF)、参白解毒方高剂量组(2%DSS和1.2 mg/ml SBJDF)。按分组给药后5% CO2孵化箱中培养48 h,取出细胞在倒置显微镜下观察各组细胞形态变化。
1.2.4 5-乙炔基-2’-脱氧尿苷(5-ethynyl-2’-deoxyuridine,EdU)检测FHC细胞增殖能力:取对数生长期FHC细胞,以适宜密度接种于48孔板,分组同1.2.3,给药后培养48 h。取细胞给10 μmol 的EdU荧光探针,37 ℃敷育2 h,去除培养基,加入PBS清洗3次,每次3 min,加入4%的多聚甲醛室温固定20~30 min,PBS洗3次,每次3 min,加入Triton通透15 min,PBS洗3次,每次3 min,加入Click-iT反应工作液避光敷育20 min,PBS洗3次,每次3 min,DNA复染,倒置荧光显微镜观察并拍照。
1.2.5 Western blot:取对数生长期的FHC细胞,分组同1.2.3,给药后培养48 h,RIPA蛋白裂解法提取各组细胞蛋白,冰上裂解10 min,裂解置于4 ℃离心机12000 r/min 离心15 min,收集上清液,BCA法测定蛋白浓度。调整各组蛋白样本为相同浓度后,加入loading buffer并置于95 ℃金属浴锅蛋白变性10 min,分别加入SDS-PAGE胶泳道,以恒压80 V,30 min,再以120 V电泳至指示剂脱离分离胶底部,以恒流300 mA,90 min将蛋白转移至PVDF膜上,取出PVDF膜用5%的脱脂奶粉4 ℃隔夜封闭,PBST清洗后加入一抗,4 ℃孵育过夜,PBST洗膜后加室温孵育二抗2 h,PBST清洗后显色曝光,结果使用Image J计算条带灰度值。
1.2.6 流式细胞技术检测细胞周期:将对数生长期的FHC细胞以3×105ml培养在6孔板中,每孔2 ml,待细胞合适密度时,同1.2.3分组给药后继续培养48 h。胰酶消化细胞,以2000 r/min,1 min收集细胞,弃上清,PBS洗涤两次,用预冷的70%乙醇重悬细胞后4 ℃过夜,次日在4 ℃离心机中以2000 r/min,2 min去除乙醇,PBS洗涤后加入0.5 ml FxCycle PI/RNase染液体,充分混匀,避光染色30 min 后,用流式细胞仪检测细胞周期。
1.3 统计学方法 本实验数据通过SPSS 23.0统计学软件进行处理,参数值用均数±标准差表示,采用方差分析和t检验比较组间差异,P<0.05表示差异具有统计学意义。
2 结 果
2.1 经DSS处理后FHC细胞活力的影响 MTT实验结果,见表1。经1.0%、1.5%、2.0%DSS刺激48 h后,FHC人正常结直肠黏膜上皮细胞的细胞活力随着DSS浓度的增加而下降,呈浓度依赖性。其中2% DSS处理后48 h细胞活力抑制率为(52.34±5.31)%。

表1 DSS溶液对FHC细胞活力的影响(n=5)
2.2 DSS对FHC细胞周期分布的影响 通过流式细胞术检测结果显示(图1):与A组比,随着刺激FHC细胞的DSS浓度增加,G0/G1期细胞数逐渐增多,其中2% DSS造模组与空白组相比,G0/G1期细胞明显增加,S期减少,具有统计学差异(P<0.01)。提示DSS干预下能诱导FHC细胞形成G0/G1期阻滞,因此选择2% DSS进行下一步实验。
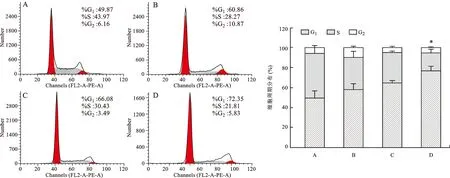
A :空白组;B:1.0% DSS造模组;C:1.5% DSS造模组;D: 2.0% DSS造模组。与空白组比较,*P<0.01
2.3 参白解毒方对FHC细胞形态学的影响 结果显示(图2):空白组细胞数量最多,排列有序,形状正常,贴壁良好;模型组FHC细胞出现排列疏松、形状不规则、细胞数量明显减少,胞膜皱缩并脱落;与模型组相比,随着参白解毒方的浓度逐步增加,细胞数量增加,形态异常情况减少。

图2 参白解毒方对经DSS处理后FHC细胞形态影响(EdU染色,×100)
2.4 参白解毒方对经DSS处理后FHC细胞增殖的影响 EdU与胸腺嘧啶脱氧核糖苷类似,可以掺入细胞新合成的DNA中,其与相关试剂反应,通过发出的荧光检测掺入DNA的EdU。EdU实验可检测细胞DNA损伤修复、细胞周期、细胞分化、细胞增殖等。实验结果显示(图3):与空白组相比,模型组细胞EdU阳性细胞率明显下降,具有统计学差异(P<0.01),与DSS阻滞细胞周期结果相符;参白解毒方给药后,随着参白解毒方浓度增加,EdU阳性细胞数量逐渐增加,呈浓度依赖性;与模型组相比,参白解毒方中剂量组、高剂量组百分比上升,具有统计学差异(P<0.01),表明参白解毒方可以减轻DSS细胞毒性,恢复细胞增殖能力。
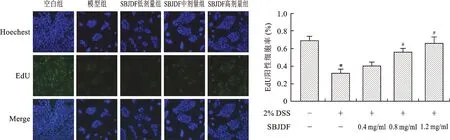
与空白组比较,*P<0.01;与造模组比较,#P<0.01
2.5 参白解毒方对经DSS处理后FHC细胞周期的影响 通过流式细胞计数仪检测结果显示(图4):与空白组相比,模型组G0/G1期细胞明显增加,S期减少,有统计学差异(P<0.01);在2% DSS刺激细胞同时给予参白解毒方,G0/G1期细胞明显减少,S期增加,呈浓度依赖性,参白解毒方高剂量组与模型组相比,差异有统计学意义(P<0.05)。提示参白解毒方减少了DSS诱导FHC细胞形成的G0/G1期阻滞。
Western blot实验结果显示(图5):与空白组相比,模型组细胞周期蛋白Cyclin A2、CDK1表达降低,差异有统计学意义(P<0.05);参白解毒方给药后,经DSS刺激的FHC细胞周期蛋白Cyclin A2、CDK1表达上调,并呈浓度依赖性,其中参白解毒方高剂量组与模型组相比,差异有统计学意义(P<0.05)。提示参白解毒方可能通过调控细胞周期减轻DSS诱导的FHC细胞损伤。
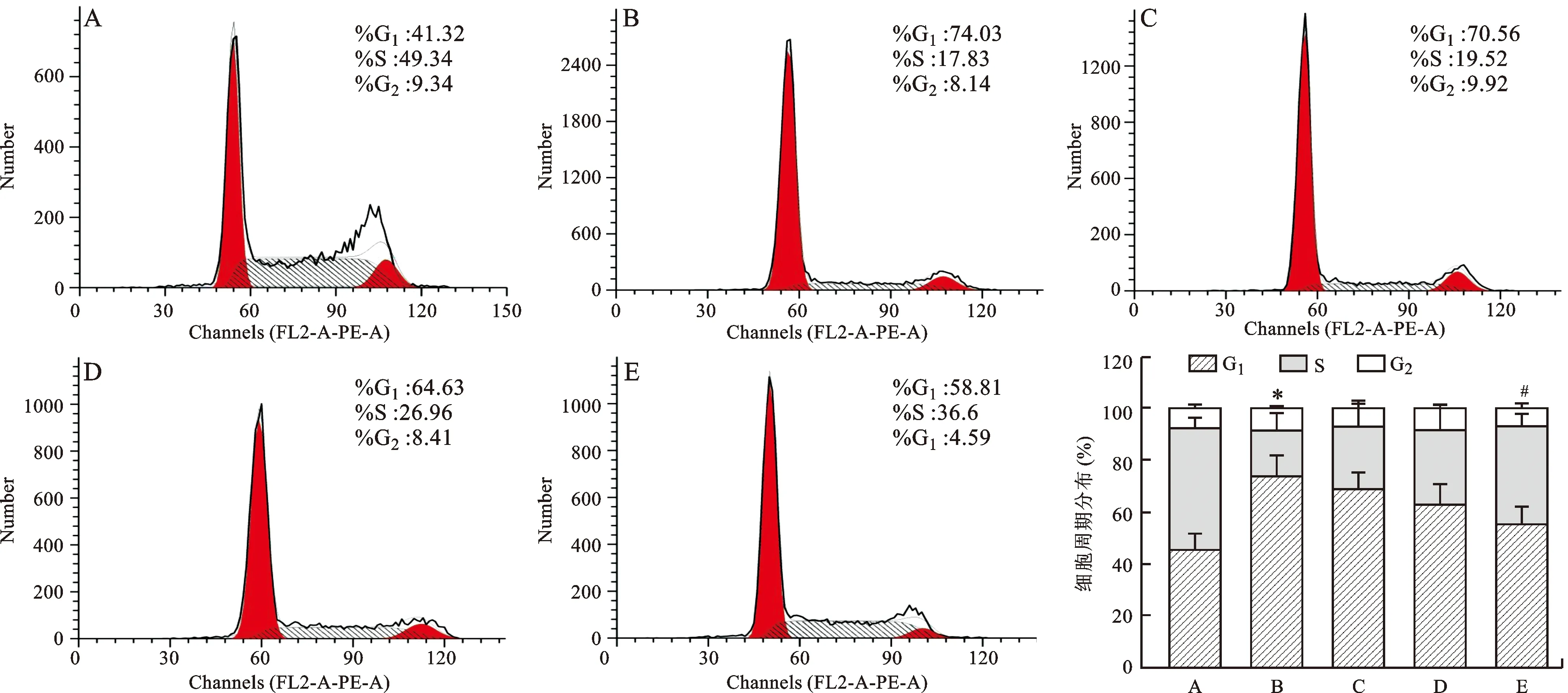
A:空白组;B:模型组;C:SBJDF低剂量组;D:SBJDF中剂量组;E:SBJDF高剂量组。与空白组比较,*P<0.01;与模型组比较,#P<0.05

与空白组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05
3 讨 论
溃疡性结肠炎属于中医学肠澼、痢疾、便血等范畴,病位在肠,与脾、肾、肝、肺脏腑相关。初起可因情志不畅、脾胃虚弱、饮食不节、感受外邪等病因引起脾胃损伤[11-12];日久则湿热毒邪内蕴,逐渐气血凝滞,壅而化脓,下迫肠道,引起脓血便,甚或反复发作、迁延不愈而形成癌毒,最终发展为肠蕈。中医药治疗UC具有减轻患者痛苦、减少复发及不良反应等优势,运用中医药治UC成为当前医学研究的重点[13-14]。本团队以“癌毒病机”为理论核心,中医“治未病”思维为指导,拟定了预防结直肠癌癌前病变的中药复方——参白解毒方。
DSS具有破坏正常肠黏膜屏障,增强肠黏膜通透性的作用,诱导上皮细胞炎症,常用来建立溃疡性结肠炎的体内、体外模型[15-16]。本研究中,通过MTT实验发现2% DSS具有明显的细胞毒性,降低了FHC细胞的活力。EdU与腺苷结构类似,在S期细胞DNA开始复制时掺入DNA序列中,从而检测细胞增殖能力。实验结果显示DSS减少FHC细胞中的EdU阳性细胞数,而在参白解毒方干预后,EdU阳性数量增加,参白解毒方给药后减轻了DSS的细胞毒性,提高细胞增殖能力,表明参白解毒方对溃疡性结直肠炎肠黏膜上皮细胞具有保护作用。
细胞周期包括四个阶段,分别为G0/G1期、S期、G2期、M期,与细胞增殖和凋亡相关[17]。细胞周期蛋白依赖性激酶(Cyclin-dependent kinases,CDKs)通过与细胞周期蛋白(Cyclin)结合而激活,发挥调控细胞周期作用[18]。研究发现CyclinA2能够与CDK2和CDK1结合,增加S期DNA复制,促进细胞越过G1/S与G2/M期转折点[19-20]。通过流式细胞仪检测发现DSS诱导FHC细胞发生G0/G1期阻滞,进而抑制细胞增殖;参白解毒方干预后,逆转了FHC细胞的周期阻滞;蛋白印迹实验结果显示DSS刺激后下调细胞CDK1、CyclinA2周期蛋白表达,参白解毒方可逆转上述趋势。
综上所述,参白解毒方可以通过维持细胞周期稳态发挥保护溃疡性结直肠炎黏膜细胞的作用,但其对正常结直肠黏膜上皮细胞周期的具体作用机制尚不清楚,还需进一步研究。
