lncRNA TUG1靶向调控miR-199a-3p对高糖诱导的足细胞损伤的作用与机制研究*
2022-01-24卢发菊陈永建
卢发菊,王 丽,陈永建
(青海省第五人民医院 1.肾脏内科;2.内分泌科,西宁 810000)
糖尿病肾病是糖尿病常见的严重并发症,导致终末期肾病[1]。糖尿病肾病早期临床表现为肾小球超滤和尿白蛋白排泄率增加[2]。其中,足细胞凋亡在糖尿病肾病肾小球硬化和蛋白尿的发病机制中起着关键作用[3]。当发生足细胞损伤时,肾小球滤过屏障无法维持,从而导致蛋白尿[4]。长非编码RNA(long noncoding RNA,lncRNA)牛磺酸上调基因1(taurine upregulated gene 1,TUG1)是人类癌症、心血管疾病等中广泛表达的lncRNA,Lei 等[5]报道了糖尿病肾病大鼠和高葡萄糖处理的MPC5 细胞中,TUG1 的表达下调,Duan 等[6]揭示TUG1 通过介导miR-377 减轻糖尿病肾病的细胞外基质积累。miR-199a-3p 在糖尿病性神经病患者的表达明显高于正常对照[7]。本研究的生物信息学预测显示,TUG1和miR-199a-3p存在靶向结合位点。因此,本研究探讨TUG1 是否通过靶向miR-199a-3p 影响高糖环境下MPC5细胞的增殖、凋亡、炎症、氧化应激,并在高糖诱导的小鼠肾足细胞MPC5损伤模型中进行验证。
1 材料与方法
1.1 细胞与试剂 小鼠肾足细胞MPC5 购自美国典型培养物保藏中心,Podocin 抗体购自美国Thermo Fisher Scientific,酶联免疫吸附测定法(enzymelinked immunosorbent assay,ELISA)白介素(IL)-1β试剂盒、肿瘤坏死因子α(TNF-α)试剂盒购自美国R&D Systems,CCK-8、丙二醛(MDA)试剂盒、乳酸脱氢酸(LDH)试剂盒、膜联蛋白V(Annexin V)-FITC细胞凋亡检测试剂盒购自上海碧云天,抗细胞周期蛋白D1(CyclinD1)、p21、天冬氨酸特异性半胱氨酸蛋白酶-3(Caspase-3)、Bcl-2 相关X 蛋白(Bcl-2 associated x protein,Bax)、Nephrin抗体购自Proteintech。
1.2 细胞培养与分组 MPC5 细胞在补充10%FBS 和抗生素(100 U/mL 青霉素和100 μg/mL 链霉素)的RPMI 1640培养基中,在37 ℃和5%CO2条件下进行培养。将MPC5细胞分为NG组(正常对照,5.3 mmol/L葡萄糖)、HG组(高糖,30.0 mmol/L葡萄糖[8])、HG+pcDNA-NC 组、HG+pcDNA-lncRNA TUG1 组、HG+anti-miR-NC 组、HG+anti-miR-199a-3p组、HG+pcDNA-lncRNA TUG1+miR-NC组、HG+pcDNA-lncRNA TUG1+miR-199a-3p 组。HG 作用时间均为48 h。将MPC5 细胞以每孔6×104的密度铺在6 孔板中,使用Lipofectamine 2000,按照制造商的协议进行pcDNA-NC、pcDNA-TUG1、anti-miRNC、miR-199a-3p inhibitor(anti-miR-199a-3p)、miRNC 和miR-199a-3p mimic 的转染,转染6 h 后进行30.0 mmol/L 葡萄糖损伤。48 h 后测定TUG1、miR-199a-3p 的表达。后续分析lncRNA TUG1 对miR-199a-3p 表达的调控时,将MPC5 细胞分为pcDNANC 组(转染pcDNA-NC)、pcDNA-lncRNA TUG1 组(pcDNA-TUG1)、si-NC 组(si-NC)和si-lncRNA TUG1 组(si-TUG1),48 h 后测定TUG1、miR-199a-3p的表达。
1.3 实时荧光定量PCR(RT-qPCR)
利用Trizol试剂从MPC5细胞中提取RNA。然后使用PrimeScript™RT-PCR 试剂盒将RNA 反转录和Master Mix SYBR-Green PCR 试剂盒进行RTqPCR。U6 和GAPDH 用作内参。反应条件如下:95 ℃变性15 s,55 ℃退火30 s,72 ℃延伸30 s,共进行45 个循环。使用2-ΔΔCt方法计算相对lncRNA 和miRNA表达水平。
1.4 CCK-8 法 MPC5 细胞根据“1.2 项”分组进行不同处理,48 h 后,以10 μL CCK-8 溶液孵育细胞1 h,于酶标仪记录450 nm 的OD450nm值。细胞增殖率=OD实验组/OD对照组。
1.5 Western blotting MPC5 细胞 用RIPA 裂解缓冲液裂解。通过十二烷基硫酸钠—聚丙烯酰胺凝胶电泳分离蛋白质,并转膜。膜与一抗CyclinD1抗体(1∶2 000)、p21(1∶1 000)、Caspase-3(1∶3 000)、Bax(1∶5 000)、Podocin(1∶1 000)、Nephrin(1∶5 000)、内参β 肌动蛋白(β-actin)(1∶2 000)在4 ℃孵育过夜、与二抗IgG(1∶3 000)在37 ℃下孵育1 h。将膜浸入增强的化学发光反应溶液。通过ImageJ2x软件分析图像。
1.6 流式细胞术 按照Annexin V-FITC/PI 试剂盒说明检测MPC5细胞凋亡。凋亡率为细胞在早期和晚期凋亡阶段的百分比。
1.7 试剂盒测定炎性因子IL-1β、TNF-α、氧化应激因子MDA、LDH 水平 MPC5 细胞经“1.2 项”分组处理后,收集上清液,分别用IL-1β、TNF-α ELISA试剂盒测定炎性因子IL-1β、TNF-α 水平,用MDA、LDH 测定试剂盒检测氧化应激因子MDA、LDH 水平。
1.8 双荧光素酶报告实验 将含miR-199a-3p预测互补位点的TUG1野生型(WT)和突变型(MUT)序列插入pGL3 对照载体,分别记为WT-lncRNA TUG1 和MUT-lncRNA TUG1。用WT-lncRNA TUG1 或MUT-lncRNA TUG1 荧光素酶报告载体共转染miR-NC 或miR-199a-3p mimic,24 h 以荧光素酶报告试剂盒测定各组荧光素酶活性。
1.9 统计学方法 采用SPSS 22.0软件进行统计分析,数据以均数±标准差()表示。组间差异比较通过t检验、单因素方差分析或SNK-q检测进行,P<0.05为差异具有统计学意义。
2 结果
2.1 高糖对MPC5细胞TUG1、miR-199a-3p及细胞损伤的影响 与NG 组相比,HG 组MPC5 细胞中TUG1 表达量减少,miR-199a-3p 表达量增加,细胞增殖率、增殖蛋白CyclinD1、特异性蛋白Podocin 及Nephrin 表达量降低,miR-199a-3p、凋亡蛋白Caspase-3、Bax 及p21 表达量升高,同时IL-1β、TNF-α、MDA、LDH水平升高(P<0.05),见图1。
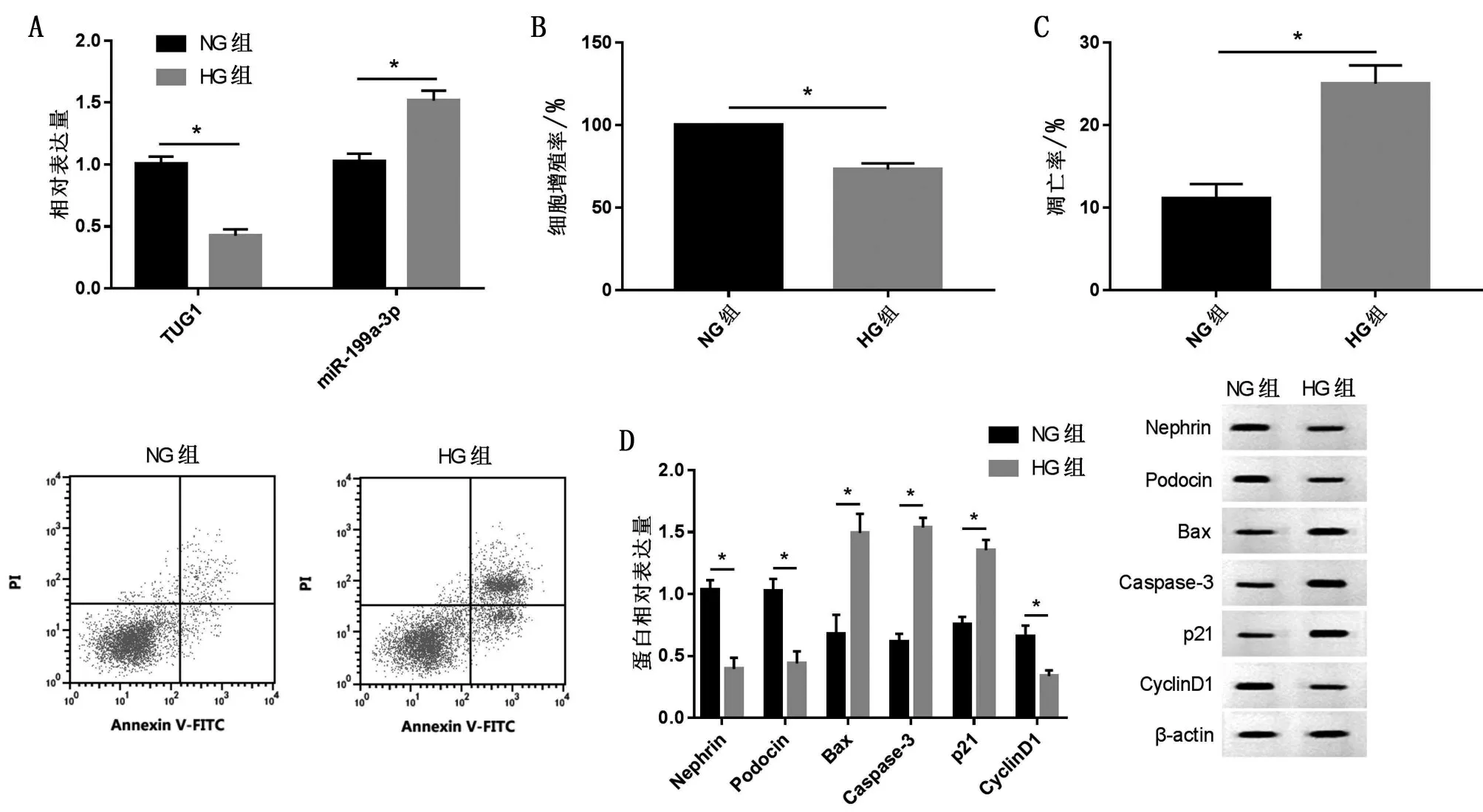
图1 高糖对MPC5细胞TUG1、miR-199a-3p及细胞损伤的影响(,n=9)
2.2 过表达TUG1 对细胞损伤的影响 相比于HG+pcDNA-NC 组,HG+pcDNA-lncRNA TUG1 组MPC5 细胞中TUG1 表达量、细胞增殖率增加,CyclinD1、Podocin 及Nephrin 表达量升高,凋亡率、Caspase-3、Bax 表达量及p21 表达量减少,以及IL-1β、TNF-α、MDA及LDH水平降低(P<0.05),见图2。2.3 TUG1 靶向调控miR-199a-3p 的表达 如图3所示,TUG1 与miR-199a-3p 具有结合位点。miR-199a-3p 组WT-lncRNA TUG1 荧光活性低于miRNC组(P<0.05)。TUG1负调控miR-199a-3p的表达。
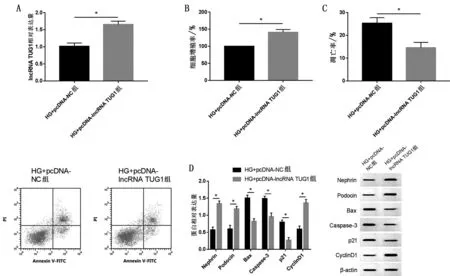
图2 过表达lncRNA TUG1对细胞损伤的影响(,n=9)
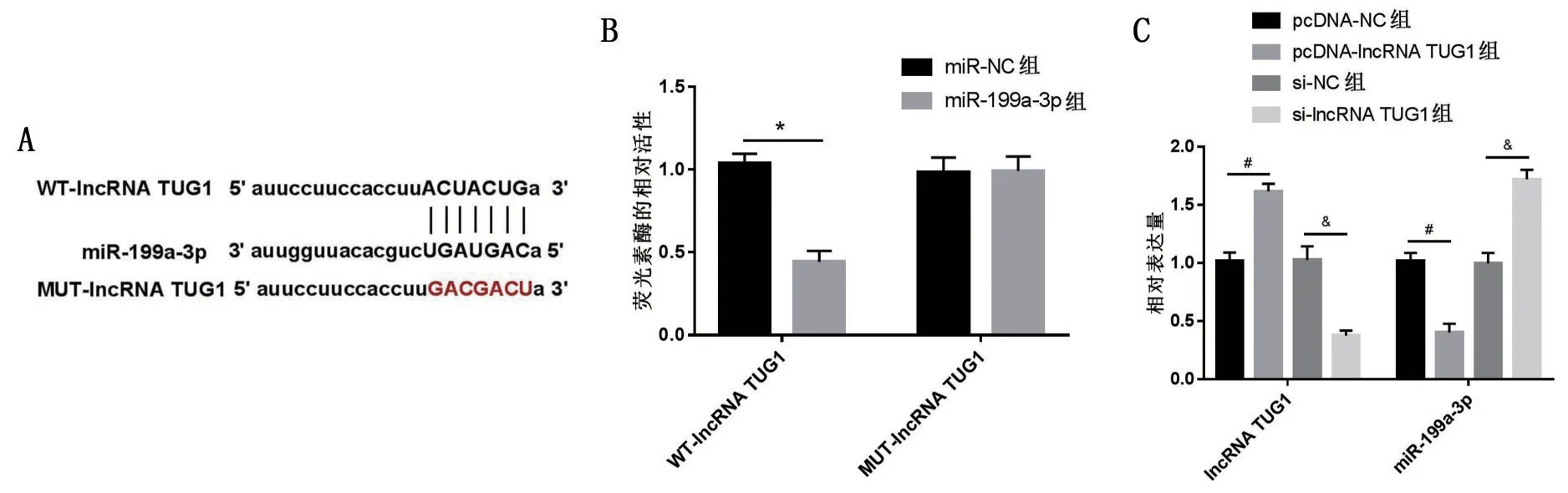
图3 TUG1靶向调控miR-199a-3p的表达(,n=9)
2.4 抑制miR-199a-3p表达对MPC5细胞损伤的影响 与HG+anti-miR-NC 组比较,HG+anti-miR-199a-3p 组miR-199a-3p、p21 表达量、凋亡率、Caspase-3及Bax表达量降低,细胞增殖率、CyclinD1表达量,Podocin、Nephrin 表达量升高,并且IL-1β、TNF-α、MDA及LDH水平降低(P<0.05),见图4。
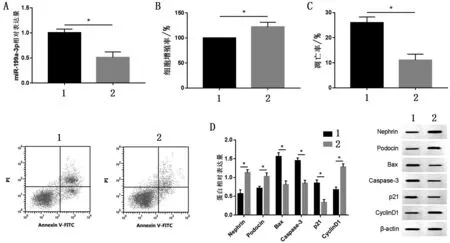
图4 抑制miR-199a-3p表达对MPC5细胞损伤的影响(,n=9)
2.5 过表达miR-199a-3p能逆转TUG1过表达对细胞损伤的影响 与HG+pcDNA-lncRNA TUG1+miR-NC 组相比,HG+pcDNA-lncRNA TUG1+miR-199a-3p 组MPC5 细胞中凋亡率、miR-199a-3p、p21、凋亡蛋白Caspase-3、Bax 表达量升高,细胞增殖率、CyclinD1、Podocin及Nephrin表达量降低,同时提高IL-1β、TNF-α、MDA 及LDH 水平(P<0.05),见图5。
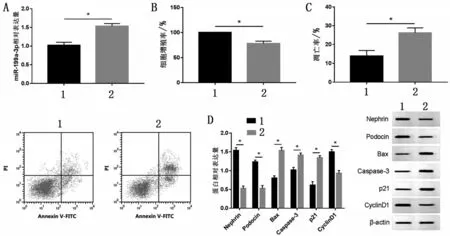
图5 过表达miR-199a-3p能逆转TUG1过表达对细胞损伤的影响(,n=9)
3 讨论
lncRNA 可以调节糖尿病肾病中足细胞的损伤过程[9-10]。根据报道,TUG1 在糖尿病小鼠的足细胞中表达减少,而TUG1 在足细胞中过表达减少了糖尿病引起的活性氧形成和蛋白尿[11-12]。糖尿病大鼠和高糖诱导的肾小球系膜细胞中TUG1 表达下调,其过表达可以抑制系膜细胞的增殖[13]。本研究检测到,高糖减少MPC5 细胞中TUG1 表达,过表达TUG1 显著提高MPC5 细胞增殖率、Podocin、Nephrin表达,抑制细胞凋亡和炎性因子、氧化应激,表明过表达TUG1具有保护高糖损伤足细胞的作用。
研究显示TUG1可以通过调节靶向miR-377来调节糖尿病肾病的细胞外基质积累[6]。本研究发现,TUG1 靶向调控miR-199a-3p 的表达,提示靶向miR-199a-3p 可能是TUG1 参与糖尿病肾病的新途径。资料显示,miR-199a 在2 型糖尿病患者血浆中的表达增高[14]。本研究中,高糖诱导miR-199a-3p水平的增加,抑制miR-199a-3p表达显著降低MPC5细胞的凋亡、炎性因子表达和氧化应激,并提高细胞增殖率和Podocin、Nephrin 表达,说明抑制miR-199a-3p的表达可保护足细胞,减少其凋亡及炎症反应。此外,过表达miR-199a-3p 后,过表达TUG1 保护高糖诱导的足细胞损伤的功能被逆转,表明TUG1可能通过靶向miR-199a-3p来保护足细胞,减少高糖诱导的损伤。
综上,TUG1促进高糖诱导的足细胞的增殖,抑制其凋亡、炎性因子表达和氧化应激水平,机制可能与靶向miR-199a-3p有关。这为更好了解糖尿病肾病各种水平的调节机制提供了理论基础,为糖尿病肾病的治疗提供新思路。
