Let-7b-5p靶向ETFA减轻高磷诱导的血管平滑肌细胞钙化的机制研究*
2022-01-24陈传珍卢海林
陈传珍,卢海林,覃 晓
(广西医科大学第一附属医院血管外科,南宁 530021)
血管钙化是指钙盐沉积在动脉壁组织的一种病理改变,可导致血管弹性的丧失和血管僵硬,是心血管疾病发展的病理基础[1-3]。据报道,在65岁以上的人群中,约40%的死亡是由心血管疾病引起的[4]。血管钙化既往被认为是一个被动的、不可避免的病理过程。然而,最近的研究结果表明,从血管平滑肌细胞(VSMCs)表型到成骨细胞表型的转变是血管钙化发生的主要原因[5],血管钙化是一个主动的、受调控的过程,与骨和软骨形成类似[6-7]。尽管血管钙化的分子机制已经有很多研究,但仍缺乏有效的预防和治疗方法。因此,迫切需要进一步探寻血管钙化的分子机制和治疗靶点。
MicroRNA(miRNA)是一类由内源基因编码的长度约为22 个核苷酸的非编码单链RNA,主要参与转录后基因表达的调控。miRNA 主要通过与靶基因的3’UTR 结合后抑制其表达[8],在细胞内发挥多种重要的调节作用,可以作为潜在的治疗目标和诊断生物标志物[9-10]。大量miRNAs 在血管疾病中发挥着重要作用。miR-204/miR-211 通过调节BMP2 减轻血管钙化[11]。miR-34a 通过调节SIRT1促进血管钙化[12]。同时,在动脉粥样硬化的血管内皮细胞中发现了低表达的Let-7b-5p[13]。有研究表明,在平滑肌细胞中通过抑制Let-7b-5p通过上调电子转移黄素蛋白A(ETFA)表达促进维生素D 受体的积累,从而阻止多裂肌功能障碍的发展[14],维生素D介导的成骨细胞因子Runx2表达调控是血管钙化的必需条件[15-16]。但Let-7b-5p是否能够逆转VSMCs表型转化,减少钙磷沉淀而抑制血管钙化进展目前国内外尚无文献报道。因此,本研究通过高磷诱导VSMCs 钙化,观察Let-7b-5p 对VSMCs 钙化程度和表型转化相关蛋白的影响,并探讨Let-7b-5p 对ETFA的靶向调控作用。
1 材料与方法
1.1 细胞培养 VSMCs购自中国科学院昆明细胞库。VSMCs 用含有10%胎牛血清和1%青霉素/链霉素的DMEM培养基,置于37 ℃、5%CO2的细胞培养箱中培养,每2 d更换一次培养基。
1.2 分组、钙化模型的建立及转染 将VSMCs 分为8 组:正常对照组、钙化组、Let-7b-5p mimic 组、mimic control 组、Let-7b-5p inhibitor 组、inhibitor control 组、ETFA-siRNA 组和siRNA-Control 组。正常对照组用普通DMEM 培养基培养,不予任何干预,其他各组用含有10 mmol/L β-甘油磷酸钠(β-GP)的DMEM培养基培养VSMCs 14 d诱导细胞钙化。造模14 d 后,按照转染试剂Lipo 8000(上海碧云天公司)说明书的步骤,分别转染Let-7b-5p mimic、let-7b-5p inhibitor、ETFA siRNA 及相应的阴性对照(广州瑞博公司)。
1.3 茜素红染色检测VSMCs钙化情况 取对数生长期的VSMCs 按1×105个/mL 密度接种于6 孔板中,PBS 洗涤后,加入4%多聚甲醛室温下固定10 min;弃去多聚甲醛溶液,用PBS 洗涤细胞,加入1%茜素红溶液(pH=4.2)对细胞进行染色10 min,倒置显微镜下观察钙盐沉积情况(钙沉积阳性细胞呈紫红色),拍照,用Image J软件分析阳性染色面积所占百分比。
1.4 碱性磷酸酶(ALP)染色观察VSMCs成骨分化取对数生长期的VSMCs按1×105个/mL密度接种于6 孔板中,PBS 洗涤后,加入4%多聚甲醛室温下固定10 min;弃去多聚甲醛溶液,PBS 洗涤3 次,加入适量ALP 染色液(碧云天),染色30 min 后,在光学显微镜下观察VSMCs 成骨分化情况(阳性结果为胞质内出现灰褐色至深黑色颗粒状或片状沉淀)、拍照,Image J软件分析阳性染色面积所占百分比。
1.5 细胞ALP活性检测 取对数生长期的VSMCs按1×105个/mL密度接种于6孔板中,PBS清洗3次,加入100 μL 细胞裂解液进行细胞裂解,离心,取上清;加入ALP 检测试剂盒工作液,用枪头轻轻吹打混匀,37 ℃孵育10 min,用酶标仪检测405 nm 波长处的吸光度值。
1.6 RT-qPCR法检测Let-7b-5p、Runx2、ETFAmRNA相对表达量 转染48 h后,用NucleoZOL RNA提取试剂提取细胞总RNA,逆转录为cDNA,使用ABI 7500型PCR仪进行PCR反应,反应条件:95 ℃预变性2 min;95 ℃变性10 s,60 ℃退火、延伸30 s,共40 个循环。引物由广州复能基因公司设计并合成。引物序列如下:Runx2 上游:5’-CATGGCCGGGAATGATGAG-3’,下游:5’-TGTGAAGACCGTTA-TGGTCAAAGTG-3’;ETFA 上游:5’-CAGCAGCAAGTGGAGGTAGT-3’,下游:5’-CCAGTTAGCTCTGGTCGGTC-3’;β-actin 上游:5’-GGAGATTACTGCCCTGGCTCCTA-3’,下游:5’-GACTCATCGTACTCCTGCTTGCTG-3’;Let-7b-5p 上游:5’-ATCCAGTGCGTGTCGTG-3’,下游:5’-TGCTTGAGGTAGTAGGTTG-3’。ETFA 和Runx2 的表达以β-actin 为内参,Let-7b-5p 的表达以U6 为内参,用2-ΔΔCt法计算目的基因相对表达量。
1.7 Western blotting 法检测Runx2 和ETFA 蛋白表达量 使用RIPA 裂解液裂解VSMCs,提取细胞蛋白,BCA 法测定蛋白浓度;每组取20 μg 蛋白进行SDS-PAGE凝胶电泳,将蛋白转移至PVDF膜;室温封闭1 h,加入一抗Runx2(Abcom-236639,1∶5 000)、ETFA(Proteintech-12262-1-AP,1∶1 000)、GAPDH(Proteintech-13937-1-AP,1∶1 000)4 ℃孵育过夜,PBST 洗膜;加入相应的二抗(Proteintech-SA00001-2,1∶5 000)室温孵育1 h,PBST洗膜;ECL发光液显色、曝光。用Image J软件分析蛋白条带灰度值。以目的蛋白条带灰度值与内参GAPDH条带灰度值的比值表示目的蛋白表达量。
1.8 双荧光素酶实验 利用在线公共数据库RNA22(https://cm.jefferson.edu/rna22/)检索Let-7b-5p与ETFA结合位点。为了确定Let-7b-5p与ETFA之间的靶向关系,在HEK293T 细胞中转染野生型(WT)ETFA 3’-UTR或突变型(MUT)ETFA 3’-UTR和Let-7b-5p mimic 或相应阴性对照(NC)。使用荧光素酶活性检测试剂盒测定细胞萤火虫荧光素酶的活性,以海肾荧光素酶的荧光值为标准。
1.9 统计学方法 采用Graph Pad 软件分析数据,计量资料以均数±标准差()表示。多组间比较采用方差分析,组间两两比较采用LSD-t检验;Pearson相关分析法分析ETFA 与Let-7b-5p、Runx2 表达的相关关系,以P<0.05为差异有统计学意义。
2 结果
2.1 VSMCs 钙化情况 与正常对照组比较,钙化组VSMCs 出现大量的紫红色钙结节及大量的蓝黑色硫化钴沉淀(P<0.001),即钙化程度和成骨分化程度增加,见图1。

图1 VSMCs茜素红染色(A)和ALP染色(B)结果
2.2 Let-7b-5p 和ETFA 参与VSMCs 的钙化 与正常对照组比较,钙化组Runx2 和ETFA mRNA 相对表达量显著升高,Let-7b-5p 表达显著降低(均P<0.01),见图2A、2B、2C。Pearson相关分析显示:ETFA 与Let-7b-5p 表达呈负相关关系(r=-0.785,P<0.001),ETFA与Runx2表达呈正相关关系(r=0.962,P<0.001),见图2D、2E。

图2 正常对照组与钙化组Runx2、ETFA和Let-7b-5p的表达比较
2.3 Let-7b-5p 可调节ETFA 和Runx2 的表达 与mimic control 组比较,Let-7b-5p mimic 组Runx2 和ETFA mRNA 及蛋白相对表达量显著降低,ALP 活性降低(均P<0.05);与inhibitor control组比较,Let-7b-5p inhibitor组Runx2和ETFA mRNA及蛋白相对表达量显著升高,ALP活性升高(均P<0.05),见图3。
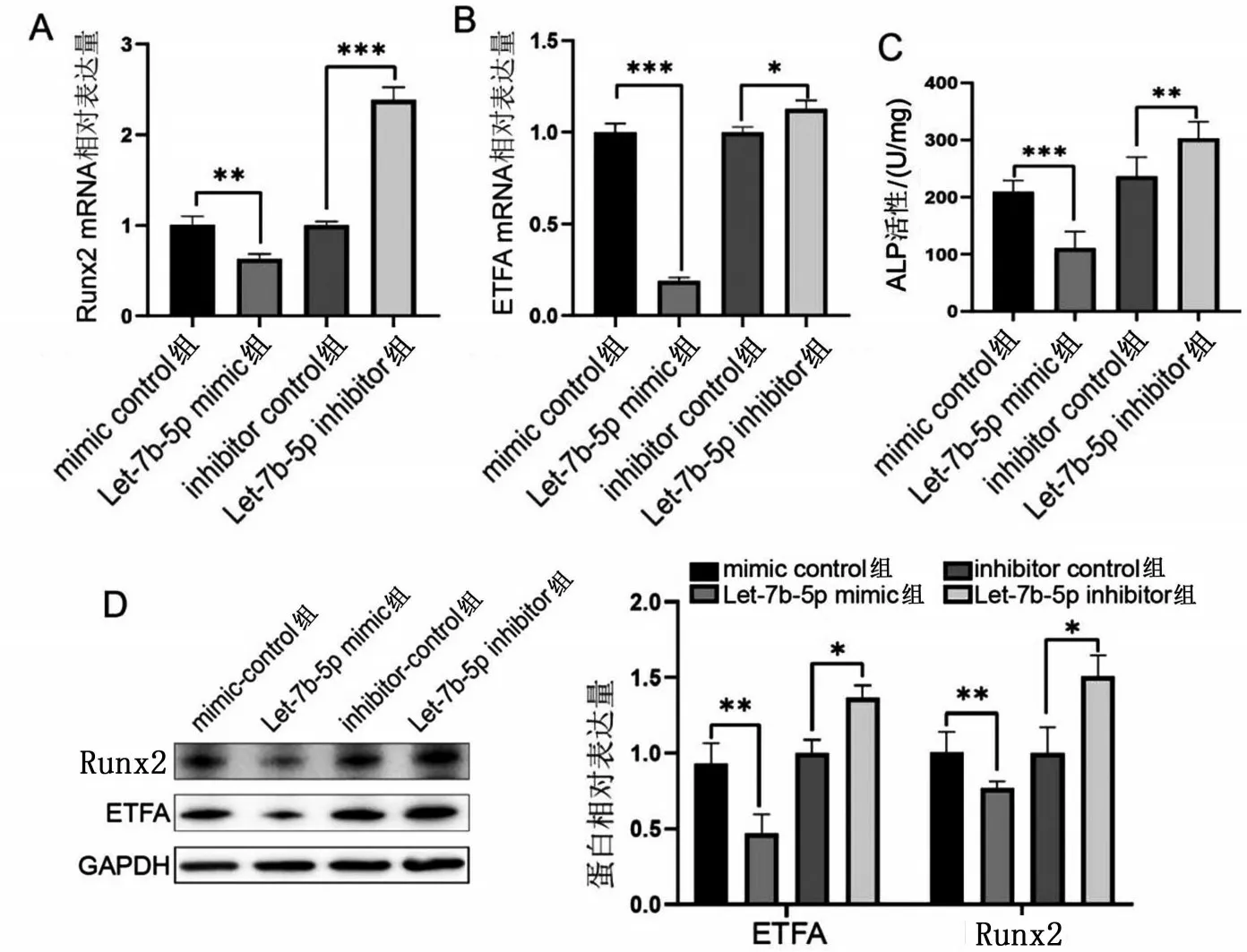
图3 Let-7b-5p对VSMCs中ETFA和Runx2的调节作用
2.4 Let-7b-5p靶向调控ETFA的表达 通过RNA22在线数据库预测显示,Let-7b-5p与ETFA 3’-UTR第80~104 位的碱基存在互补结合位点,见图4A。通过双荧光素酶实验验证Let-7b-5P 是否能够调节ETFA的表达。Let-7b-5p mimic组与NC mimic组荧光素酶活性比较无明显差异(P>0.05);与ETFAWT+NC mimic 组比较,与ETFA-WT+Let-7b-5p mimic 组荧光素酶活性显著降低(P<0.05);与ETFA-WT+Let-7b-5p mimic 组比较,ETFA-MUT+Let-7b-5p mimic 组荧光素酶活性显著升高(P<0.05),见图4B。

图4 Let-7b-5p对ETFA的靶向调控作用
2.5 沉默ETFA 可减轻VSMCs 的钙化与siRNAControl 组比较,ETFA-siRNA 组VSMCs 中ETFA 和Runx2 mRNA相对表达量显著下降(均P<0.01),紫红色钙结节明显减少,见图5。

图5 沉默ETFA后ETFA、Runx2的表达及茜素红染色
3 讨论
血管钙化是心血管疾病的风险预测因子和常见病理变化,与高血压、糖尿病、慢性肾病和衰老等密切相关。血管钙化包括血管内膜钙化和中层钙化。内膜钙化主要是由血管的慢性炎症引起的,导致动脉粥样硬化斑块。中层钙化主要指VSMCs 向成骨细胞表型转变的过程,这是一个主动的、受到调控的过程。目前认为,血管中层的VSMCs 向成骨细胞表型转变是导致血管钙化的重要因素[2]。这种细胞表型的转变使血管平滑肌标志物(SM22α和SMα-肌动蛋白)减少,骨形成标志物(Runx2 和ALP)增加[7,17]。
最新的证据表明,miRNAs参与靶基因的表达,在血管钙化过程中发挥着重要作用。有研究表明,Let-7b-5p可以抑制血管内皮细胞增殖和迁移,促进血管内皮细胞的凋亡[13]。电子转移黄素蛋白(ETF)是一种酶,参与氧化呼吸链过程,与脂肪酸代谢等有关[18],影响线粒体脂酰辅酶A的积累,在脂类疾病中发挥重要作用。人类ETF由两个独立的基因ETFA和ETFB分别编码。ETFA与细胞凋亡有关。在发生凋亡的肝细胞中发现大量的ETFA蛋白[19]。本研究用10 mmol/L β-GP 诱导VSMCs 钙化,茜素红染色发现干预后的VSMCs 出现大量的紫红色钙结节,表明高磷诱导的VSMCs钙化程度增加。
ALP是成骨细胞的表型标志物之一,可反映成骨细胞的增殖活性。ALP 不仅能促进VSMCs 表型分化,而且可通过水解磷酸酯提高磷酸盐浓度,水解焦磷酸盐増加磷酸钙的生成,最终加速血管钙化发展。本研究中,钙化组VSMCs 成骨分化程度(ALP 阳性染色面积)明显增加,成骨细胞因子Runx2表达上调,ETFA表达上调,而Let-7b-5p表达下调;相关性分析显示,Let-7b-5p表达与ETFA呈负相关关系,Runx2 表达与ETFA 呈正相关关系;转染Let-7b-5p mimic 后,Runx2 和ETFA mRNA 和蛋白表达明显下调,ALP活性降低,而Let-7b-5p inhibitor的作用相反;双荧光素酶实验证明了Let-7b-5p可靶向抑制ETFA 的表达。以上结果说明,Let-7b-5p 可通过抑制ETFA 表达减轻VSMCs 的成骨分化。此外,沉默ETFA 后,Runx2 和ETFA mRNA 和蛋白表达明显下调,茜素红染色显示细胞钙结节明显减少,与Let-7b-5p mimic 的作用相一致。表明沉默ETFA表达能抑制血管钙化。
综上所述,Let-7b-5p 和ETFA 参与血管钙化过程,Let-7b-5p 可通过下调ETFA 的表达抑制高磷诱导的VSMCs 钙化。本课题组下一步将研究ETFA是否通过VDR 通路或者其他途径来发挥抗血管钙化的作用,以期完善血管钙化的分子调控机制和提供血管钙化的靶向基因治疗选择。
