探讨沉默LncRNA-H19 联合小剂量冬凌草甲素对APL 细胞增殖和凋亡的影响
2022-01-21单晓英张祥华
单晓英,张祥华,王 岩
莒县中医医院,山东 莒县 276500
白血病(acute myeloid leukemia,AML)是儿童最常见的癌症之一,约占儿童癌症病例总数的25%~35%[1]。急性早幼粒细胞白血病(acute promyelocytic leukemia,APL)作为AML 的亚型之一,其特征在于染色体15和17之间的相互平衡易位,将早幼粒细胞白血病(promyelocytic leukemia,PML)基因与维甲酸受体(retinoic acid receptor α,RARα)基因融合并导致白血病表型[2-3]。自全反式维甲酸和三氧化二砷被引入APL的治疗以来,患儿的总生存率有了显著提升,然而,对这两种药物耐药的复发/难治性患儿的治疗仍是临床上有待解决的难题[2]。长链非编码RNA(long non-coding RNA,lncRNA)是一组碱基数超过200 且与白血病关系密切的非编码RNA,它们通过与蛋白质、miRNA 或基因组DNA 相互作用而介导白血病细胞增殖、凋亡、分化、侵袭等[3]。其中,H19 已被证实能够有效预测AML 预后,是潜在的白血病治疗靶点[4]。冬凌草甲素(Oridonin)是一种从唇形香茶属植物冬凌草中提取的四环二萜类化合物,在多种白血病细胞中表现出抑制细胞增殖、促进细胞凋亡和逆转细胞耐药性等活性[5-7]。但小剂量冬凌草甲素在干预APL 中的效果有限且机制尚未完全阐明,故本研究拟探讨沉默LncRNA-H19 联合小剂量冬凌草甲素对APL 细胞NB4 增殖和凋亡的影响并分析其可能机制,以期为APL 的药物治疗提供新思路。
1 材料与方法
1.1 实验材料人急性早幼粒细胞白血病细胞株NB4(中国科学院上海细胞库);冬凌草甲素(纯度>98%,北京环宇生物技术有限公司,批号:20180726,用二甲基亚砜配制成10 mmol/L 母溶液);胎牛血清(美国Gibco公司,批号:1635367);罗斯韦尔公园纪念研究所(Roswell Park Memorial Institute,RPMI)培养基(美国Gibco 公司,批号:8118352);Lipofectamine 2000(美国Invitrogen公司,批号:1864617);Trizol(美国Invitrogen公司,批号:501751108);逆转录聚合酶链反应(reverse transcription-polymerase chain Reaction,RT-PCR)试剂盒(美国Invitrogen 公司,批号:1908366);Annexin V 细胞凋亡检测试剂盒(美国BD 公司,批号:9009901;碘化丙锭染料(美国Sigma 公司,批号:1696417);细胞计数试剂盒(cell counting kit-8,CCK-8)、细胞增殖检测试剂盒(上海碧云天生物技术有限公司,批号:113119201486);放射免疫沉淀法(radio immunoprecipitation assay,RIPA)裂解液(上海碧云天生物技术有限公司,批号:272631736124);二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度检测试剂盒(上海碧云天生物技术有限公司,批号:001203766845)。
1.2 主要仪器电子天平[瑞士梅特勒-托利多仪器(中国)有限公司];恒温CO2培养箱(美国Thermo Fisher Forma 公司);Milli-Q Plus 纯水器(法国Millipore 公司);流式细胞仪(美国Backman 公司);Real-time PCR 分析仪(美国ABI公司);电泳仪(美国BioRad公司)。
1.3 实验方法
1.3.1 细胞培养与分组将NB4 细胞置于含10%胎牛血清的RPMI-1640 培养基中培养,培养条件:5%CO2、37℃、饱和湿度。每天换液1 次,每2 天传代1 次,取对数生长期细胞进行实验。将细胞分为对照组(未经任何处理)、LncRNA-H19 siRNA 组(沉默LncRNA-H19)、冬凌草甲素组(用5 µmol/L冬凌草甲素处理)、联合干预组(转染LncRNA-H19 siRNA后,用5 µmol/L冬凌草甲素处理)。
1.3.2 转染采用Lipofectmine 2000将LncRNAH19 siRNA 转染至NB4 细胞,转染6 h 后换新鲜的RPMI-1640 培养基继续培养细胞,直至48 h 收取细胞,提取RNA测定LncRNA-H19表达情况。
1.3.3 RT-PCR法检测细胞中LncRNA-H19表达用Trizol 试剂提取细胞中的总RNA 并逆转录合成cDNA,再用cDNA 作为模板合成扩增目的基因,采用β-actin 作为内参照基因。反应条件为95℃预变性30 s,95℃变性15 s,60℃退火30 s,共40 个循环。LncRNA-H19 基因的上游引物序列为:5´-CTACAGCTTACTTCAAGGCCAG-3´;下游引物序列为5´-TCAGAGACAGTCAAGCGGTAT-3´。β-actin 的上游引物序列为:5´-CTTAGTTGCGTTACACCCTTTCTTG-3´;下游引物序列为5´-CTGTCACCTTCACCGTTCCAGTTT-3´。
1.3.4 CCK-8 法检测细胞增殖能力取处于对数生长期的正常细胞或LncRNA-H19 siRNA 细胞,接种于96 孔板上,密度6×103个细胞/孔。各组分别采用相应的干预措施,将培养板置于培养箱中培养96 h。在0、24、48、72和96 h,每孔加入10 µL的CCK8 溶液,于37℃持续孵育2 h,再用酶标仪在450 nm处检测吸光度。实验重复3次。
1.3.5 流式细胞仪检测细胞凋亡情况取处于对数生长期的正常细胞或LncRNA-H19 siRNA 细胞,接种于6 孔板上,密度为5×105个细胞/孔。各组分别采用相应的干预措施,将培养板置于培养箱中培养24 h 后收集细胞,以1500 r/min 离心5 min,弃上清液,用PBS 漂洗3 次,弃上清液。再将细胞重悬浮于200 µL 的Bingding Buffer,并分别加入10 µL 的Annexin V-FITC 和5 µL 的碘化丙锭染料,混匀,于25℃避光反应15 min。最后加入300 µL 的Bingding Buffer,1 h 内上流式细胞仪检测。
1.3.6 Western Blot 法检测细胞中目的蛋白表达水平取处于对数生长期的细胞并接种于6 孔板上,密度为5×105个细胞/孔。各组分别采用相应的干预措施,将培养板置于培养箱中培养24 h后收集细胞,用RIPA裂解液处理细胞,并采用BCA法定量总蛋白浓度。以每孔30 µg 上样,聚丙烯酰胺凝胶电泳后转PVDF 膜,用5% 脱脂奶粉封闭液于25℃封闭1 h 后分别加入兔抗人β-catenin(1∶2000)、兔抗人Cyclin D1(1∶2000)、兔抗人兔抗人C-myc(1∶2000)、兔抗人PI3K(1∶2000)、兔抗人AKT(1∶2000)单克隆抗体,于4℃孵育过夜。用TBST 漂洗3 次后,加入辣根过氧化物标记的山羊抗兔IgG,于37℃孵育30 min,用ECL发光剂显影。采用Quantity One 软件分析条带灰度值,选择β-actin作为上样内参。
目的蛋白相对表达水平=目的蛋白灰度值/内参蛋白灰度值
1.4 统计学方法采用SPSS 21.0统计学软件分析数据,组间比较采用One-Way ANOVA 分析,两组间比较采用LSD 分析,P<0.05 为差异有统计学意义。
2 结果
2.1 沉默LncRNA-H19 和冬凌草甲素对NB4 细胞中LncRNA-H19 表达的影响与对照组比较,LncRNA-H19 siRNA 组和联合干预组NB4 细胞中LncRNA-H19 表达量显著降低,差异有统计学意义(P<0.01);冬凌草甲素组NB4 细胞中LncRNA-H19表达量无明显变化(P>0.05)。见图1。
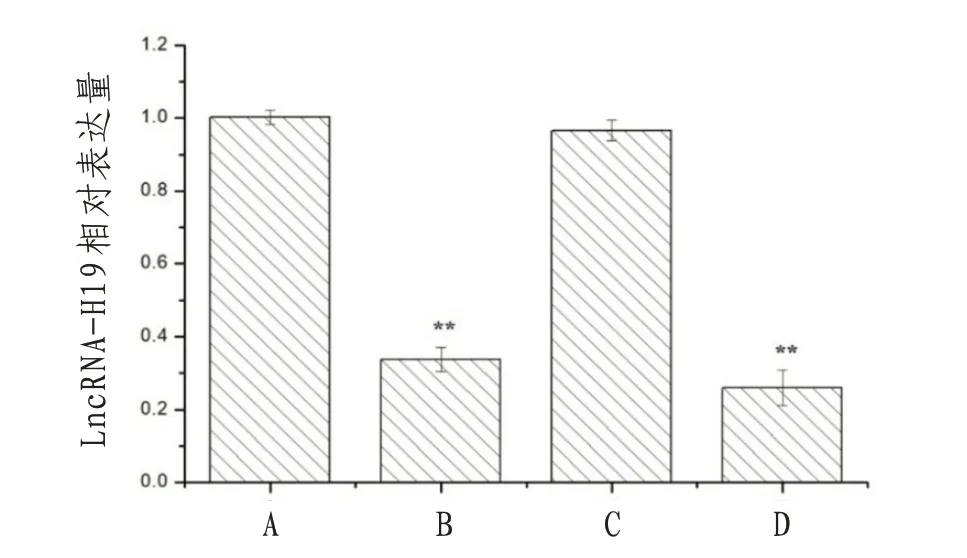
图1 沉默LncRNA-H19和冬凌草甲素对NB4细胞中LncRNA-H19表达的影响
2.2 沉默LncRNA-H19 和冬凌草甲素对NB4 细胞增殖的影响与对照组比较,LncRNA-H19 siRNA组和联合干预组24、48、72 和96 h 以及冬凌草甲素组48、72 和96 h 的细胞增殖抑制率显著增加,差异有统计学意义(P<0.01)。联合干预组细胞增殖抑制率明显高于LncRNA-H19 siRNA组和冬凌草甲素组(P<0.05)。见图2。

图2 沉默LncRNA-H19和冬凌草甲素对NB4细胞增殖的影响
2.3 沉默LncRNA-H19 和冬凌草甲素对NB4 细胞凋亡的影响与对照组比较,LncRNA-H19 siRNA组、冬凌草甲素组和联合干预组细胞凋亡率明显增加,差异有统计学意义(P<0.05);联合干预组细胞凋亡率明显高于LncRNA-H19 siRNA组和冬凌草甲素组(P<0.05)。见图3。

图3 沉默LncRNA-H19和冬凌草甲素对NB4细胞凋亡的影响
2.4 沉默LncRNA-H19 和冬凌草甲素对NB4 细胞中凋亡相关蛋白表达的影响与对照组比较,LncRNA-H19 siRNA 组和联合干预组NB4 细胞中β-catenin、Cyclin D1、C-myc、PI3K 和AKT 蛋白表达量显著降低,差异有统计学意义(P<0.05);冬凌草甲素组NB4细胞中仅有PI3K蛋白表达量明显降低(P<0.05)。联合干预组细胞中凋亡相关蛋白表达率明显低于LncRNA-H19 siRNA组和冬凌草甲素组。见图4—8。
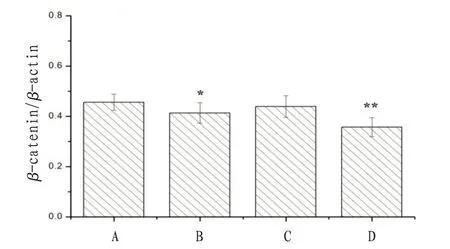
图4 沉默LncRNA-H19和冬凌草甲素对NB4细胞中β-catenin蛋白表达的影响
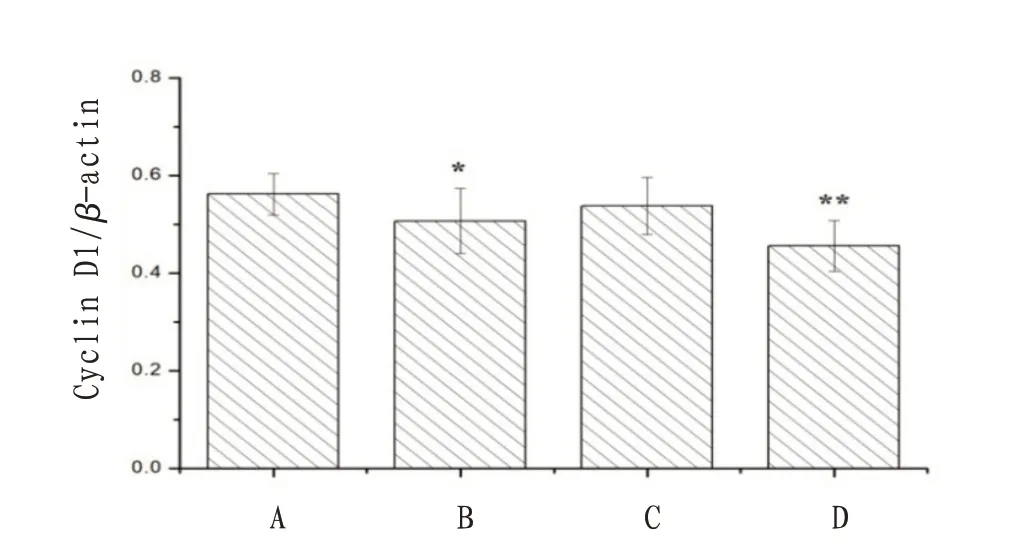
图5 沉默LncRNA-H19和冬凌草甲素对NB4细胞中Cyclin D1蛋白表达的影响
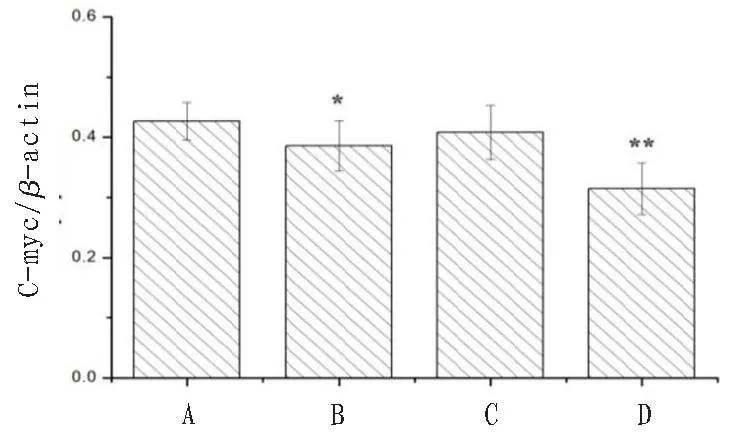
图6 沉默LncRNA-H19和冬凌草甲素对NB4细胞中C-myc蛋白表达的影响

图7 沉默LncRNA-H19和冬凌草甲素对NB4细胞中PI3K蛋白表达的影响
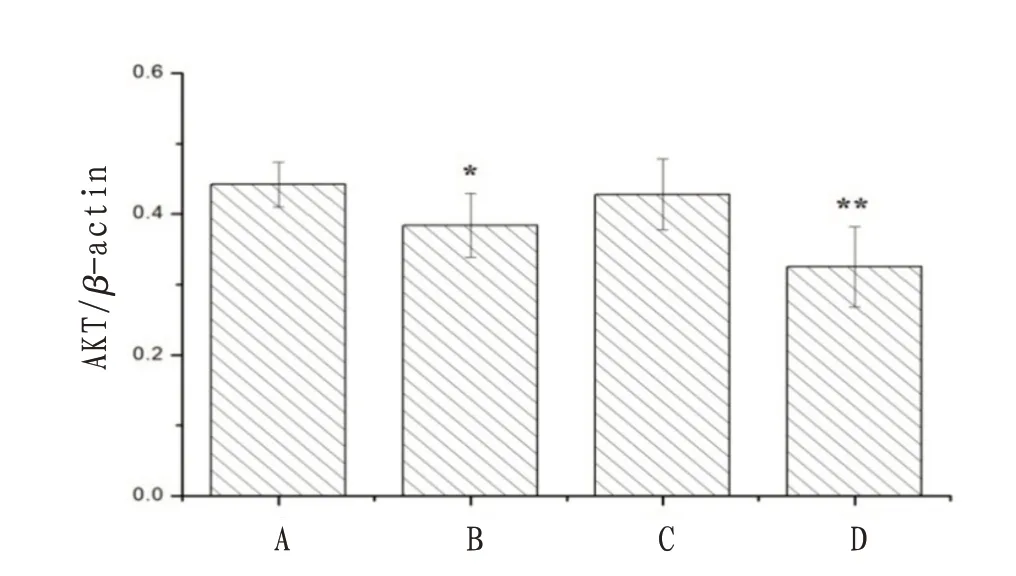
图8 沉默LncRNA-H19和冬凌草甲素对NB4细胞中AKT蛋白表达的影响
3 讨论
APL 是一种以骨髓中早幼粒细胞增多为特点的髓系白血病[8]。虽然砷剂的应用能够有效提高APL 的治愈率,但其作为一种毒性物质,短期可引起胃肠道反应、神经系统、心脏和肝脏损伤,在患儿中的长期安全性也有待考证[9]。
冬凌草甲素是冬凌草最重要的活性成分,既往研究表明其具有一定的抗白血病作用,已明确的作用机制包括调控转移、凋亡相关蛋白MMP、Bax、Bcl-2表达[7]、增加细胞活性氧水平进而稳定RARα蛋白[10]、触发伴侣蛋白介导的白血病BCR-ABL蛋白酶体降解[5]、激活NF-κB、mTOR/P70、RAF/ERK、STAT5 信号通路等[11]。冬凌草甲素的抗肿瘤效应呈剂量和时间依赖性。张晓芬等[12]报道1、2、4 µg/mL冬凌草甲素对急性T淋巴细胞白血病jurkat细胞增殖的抑制率分别为10.80%、32.32%、42.27%,本研究结果也显示用5 µmol/L 冬凌草甲素干预24、48、72 和96 h 后对NB4 细胞的抑制率仅为6.63%、11.72%、18.09和25.38%,抑制率偏低。
LncRNA-H19 位于人染色体p15.5,是首个被鉴定的印记LncRNA,具有高度保守性,出生后除骨骼肌和心脏外,在其他组织中几乎无表达,但在应激状态或肿瘤发生时重新启动表达[13]。在AML细胞系HL-60、THP-1 和U937 中,LncRNA-H19 促进肿瘤细胞增殖并抑制肿瘤细胞凋亡[14]。然而,LncRNA-H19 对APL 细胞的影响未见相关报道,其在白血病中的作用机制仍未完全明确。在本研究中,与对照组NB4细胞比较,LncRNA-H19沉默组细胞中的LncRNA-H19 表达明显降低,细胞增殖率明显降低,凋亡率明显增加,提示沉默LncRNA-H19具有抑制APL 发生发展的作用。联合干预组细胞增殖抑制率和凋亡率高于LncRNA-H19 siRNA组合冬凌草甲素组,说明沉默LncRNA-H19 联合冬凌草甲素能够有效抑制APL细胞增殖,促进细胞凋亡。
细胞增殖和凋亡受到多种肿瘤相关因子的调控。Wnt/β-catenin是介导肿瘤形成的关键通路,当细胞发生癌变时,β-catenin 磷酸化降解受阻,在细胞质中大量蓄积并转入细胞核,其与相关转录因子结合,激活下游的cyclin D1、C-myc等效应分子转录,诱发细胞异常增殖和凋亡抵抗,促使细胞恶性转化[15]。Cyclin D1是Wnt/β-catenin信号通路的下游靶基因,在细胞周期进程中呈周期性变化,通过与其他蛋白相互作用而促进细胞进入S期,进而促进细胞分裂和增殖[16]。C-myc作为致癌基因,是决定细胞由GO/G1进入S期的“开关”,其编码的蛋白与细胞增殖密切相关。C-myc 在血液肿瘤中高表达并与高增殖率、侵袭性表型、耐药以及不良预后相关[17]。PI3K/AKT信号通路通过一系列的级联反应调节下游相关蛋白的活化过程,介导细胞增殖和凋亡,研究表明在白血病中存在该通路的异常激活,是抗白血病治疗的靶点之一[18-20]。在本研究中,LncRNA-H19 siRNA 组和联合干预组细胞中β-catenin、Cyclin D1、C-myc、PI3K 和AKT蛋白表达量以及冬凌草甲素组细胞中PI3K蛋白表达量显著低于对照组,而联合干预组细胞中的以上蛋白表达量又低于LncRNA-H19 siRNA组或冬凌草甲素组,说明沉默LncRNA-H19 联合冬凌草甲素通过抑制Wnt/β-catenin 信号通路及其下游因子Cyclin D1、C-myc以及PI3K/AKT信号通路抑制APL进展,且效果优于LncRNA-H19 或冬凌草甲素单一干预法,尤其是明显优于低剂量冬凌草甲素。
