薏苡仁油对人结肠癌细胞增殖及凋亡的影响和机制∗
2022-01-21费建东聂双发
王 韬,费建东,聂双发,李 磊
河北北方学院附属第一医院胃肠外科,河北 张家口 075000
结肠癌是全球最常见的消化道恶性肿瘤之一,其发病率和病死率呈逐年上升趋势[1],严重威胁人类生命健康。结肠癌早期不易发现,大多数患者发现时已到晚期,失去最佳治疗时机,因此急需提高结肠癌的诊治水平,此外结肠癌的发展是个渐进的过程,重点应放在肿瘤的基因干预方面。Hh 信号通路在多种肿瘤的发生、发展过程中起着重要的作用。薏苡仁油是从中药薏苡仁中提取的脂质成份,其对多种恶性肿瘤细胞的生长具有抑制作用,还可以促进细胞凋亡。本研究探讨薏苡仁油对人结肠癌HT-29 细胞增殖、凋亡的影响,同时从Hh 信号通路的角度探讨薏苡仁油对人结肠癌HT-29细胞的作用机制。
1 材料与方法
1.1 细胞与试剂人结肠癌HT-29 细胞株(中国科学院上海细胞库);薏苡仁油(浙江康莱特药业有限公司,批号:120201);DMEM 高糖培养液、胎牛血 清( 美 国Hyclone 公 司,批 号:SH30081.01,SV30087.02);四甲基偶氮唑蓝(MTT)干粉(美国Amresco 公司,批号:0793);PCR 引物(上海生工生物工程有限公司);兔抗人抗体及羊抗兔Ⅱ抗(武汉博士德生物工程有限公司,批号:10CM199);细胞凋亡DAPI 染色剂试剂盒、Annexin V-FITC/碘化丙啶(PI)双染凋亡检测试剂盒(南京凯基生物科技发展有限公司,批号:KGA251,KGA107);trizol试剂、逆转录试剂盒、DreamTaq Green PCR Master Mix(美国Thermo Fisher公司,批号:15596-0018、K1621、K1081)。
1.2 细胞培养HT-29 细胞于含10% 胎牛血清的DMEM 培养液,温度37℃,5% CO2条件下培养,隔天更换培养基,取对数生长期细胞用于实验。常规胰酶消化接种于96 孔板,每孔4×103个细胞,培养24 h,使细胞同步化。将生长良好的HT-29 细胞分成6 组,观察组分别用薏苡仁油10、20、40、80、160 µL/mL 不同浓度培养72 h,对照组用空白培养基(不含薏苡仁油)培养72 h。
1.3 观察指标
1.3.1 MTT 法检测HT-29 细胞增殖每孔加入0.5 mg/mL的MTT溶液20 µL,37℃孵育4 h,去原培养液,每孔加入DMSO 200 µL,振荡混匀,室温放置10 min,于全自动酶标仪570 nm 测定各组吸光度值(A),并按公式计算增殖抑制率。

1.3.2 流式细胞术检测HT-29 细胞凋亡按“1.2”项下常规培养HT-29 细胞并干预,用胰酶消化细胞,用磷酸盐缓冲液(PBS)洗涤细胞2 次。弃去PBS 洗涤液,加入Binding Buffer 100 µL使细胞呈悬浮状态,后加入Annexin V-FITC 5 µL 混匀后,再加入Propidium Iodide 5 µL,轻摇混匀,室温下避光反应15 min,再加入Binding Buffer 400 µL混匀后,用流式细胞仪进行检测,实验重复3次。
1.3.3 q-PCR 检测Ptch、Smo、Shh 和Gli-1 mRNA表达将观察组和对照组培养72 h 后的结肠癌HT-29 细胞,用trizol 法提取各组RNA,进行RNA浓度及纯度检测。FastQuant cDNA 第一链合成试剂盒合成cDNA。按照SuperReal 荧光定量预混试剂增强版加入试剂后,进行PCR 扩增。基因引物按表1,以GAPDH 为内参照物,应用ImageJ 软件进行灰度值分析。

表1 q-PCR各引物序列
1.3.4 蛋白印迹法检测CyclinD1、p21、Caspase-3、Bcl-2、Ptch、Smo、Shh 和Gli-1 蛋白的表达 按试剂盒说明书操作,用蛋白裂解液和蛋白酶抑制剂提取各组HT-29 细胞中的总蛋白,进行定量及变性后采用Western blot 检测各组细胞中CyclinD1、p21、Caspase-3、Bcl-2、Ptch、Smo、Shh 和Gli-1 蛋白浓度,保存于-78℃,最后在凝胶成像分析系统上曝光、拍照,进行数据分析和处理。
1.4 统计学方法采用SPSS 21.0对数据进行统计分析,计量资料采用±s表示,多组间比较采用方差分析,采用SNK-q 法对各组间指标进行两两比较,P<0.05表示差异有统计学意义。
2 结果
2.1 细胞增殖抑制率空白组,薏苡仁油10、20、40、80、160 µL/mL 各浓度组对人结肠癌HT-29细胞增殖抑制率经单因素方差分析结果显示,差异有统计学意义(P<0.05),进一步采用SNK-q 检验对各组间HT-29 细胞增殖抑制率进行两两比较。结果显示,各浓度水平组HT-29 细胞增殖抑制率差异均有统计学意义(P<0.05)。随着薏苡仁油浓度的增加,抑制率表现出明显的量效关系。见表2。
表2 各组细胞增殖抑制率比较(±s)
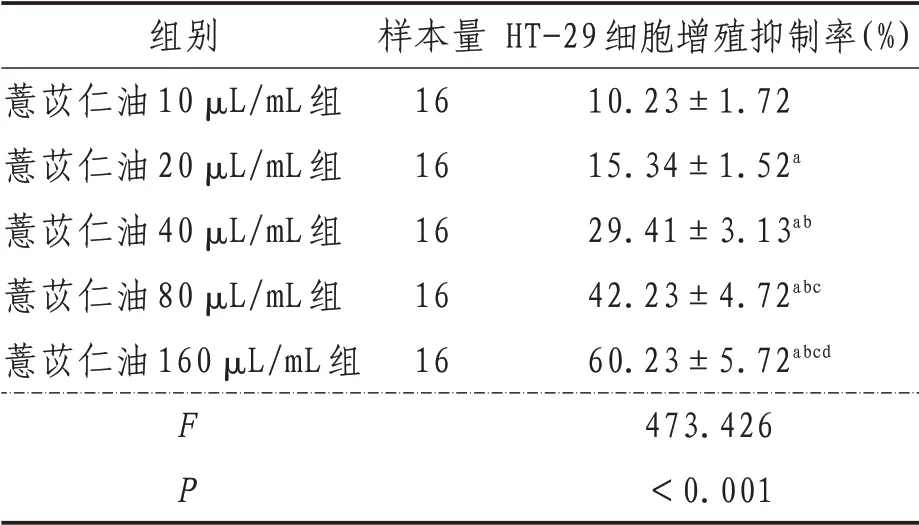
表2 各组细胞增殖抑制率比较(±s)
注:a表示与薏苡仁油10 µL/mL组比较,P<0.05;b表示与薏苡仁油20 µL/mL组比较,P<0.05;c表示与薏苡仁油40 µL/mL组比较,P<0.05;d表示与薏苡仁油80 µL/mL组比较,P<0.05
组别薏苡仁油10 µL/mL组薏苡仁油20 µL/mL组薏苡仁油40 µL/mL组薏苡仁油80 µL/mL组薏苡仁油160 µL/mL组FP样本量16 16 16 16 16 HT-29细胞增殖抑制率(%)10.23±1.72 15.34±1.52a 29.41±3.13ab 42.23±4.72abc 60.23±5.72abcd 473.426<0.001
2.2 细胞凋亡率空白组,薏苡仁油10、20、40、80、160µl/mL 各浓度组的HT-29 细胞凋亡率经单因素方差分析结果显示,差异有统计学意义(P<0.05),进一步采用SNK-q检验对各组间HT-29细胞凋亡率进行两两比较结果显示,各浓度水平组HT-29细胞凋亡率差异均有统计学意义(P<0.05)。随着薏苡仁油浓度的增加,HT-29 细胞凋亡率表现出明显的量效关系。见表3。
表3 各组HT-29细胞凋亡率比较(±s)

表3 各组HT-29细胞凋亡率比较(±s)
注:a表示与空白组比较,P<0.05;b表示与薏苡仁油10 µL/mL组比较,P<0.05;c表示与薏苡仁油20 µL/mL组比较,P<0.05;d表示与薏苡仁油40 µL/mL组比较,P<0.05;e表示与薏苡仁油80 µL/mL组比较,P<0.05
组别空白组薏苡仁油10 µL/mL组薏苡仁油20 µL/mL组薏苡仁油40 µL/mL组薏苡仁油80 µL/mL组薏苡仁油160 µL/mL组FP样本量16 16 16 16 16 16 HT-29细胞凋亡率(%)4.23±1.72 8.33±2.62a 15.48±3.82ab 21.41±4.13abc 30.33±6.62abcd 42.48±8.82abcde 119.906<0.001
2.3 Ptch、Smo、Shh 和Gli-1 mRNA 表达空白组,薏苡仁油10、20、40、80、160 µL/mL 各浓度组培养人结肠癌HT-29 细胞,Hh 信号通路相关因子Ptch、Smo、Shh和Gli-1的mRNA相对表达量经单因素方差分析结果显示,差异有统计学意义(P<0.05),进一步采用SNK-q检验对各组间上述Hh信号通路相关因子相对表达量进行两两比较结果显示,各浓度水平组上述Hh 信号通路相关因子相对表达量差异均有统计学意义(P<0.05)。薏苡仁油浓度为10、20、40、80、160 µL/mL时上述Hh信号通路相关因子相对表达量均比空白组明显下降,并随薏苡仁油浓度升高,上述指标的相对表达量逐渐降低。见表4。
表4 各组Ptch、Smo、Shh和Gli-1 mRNA表达比较(±s)
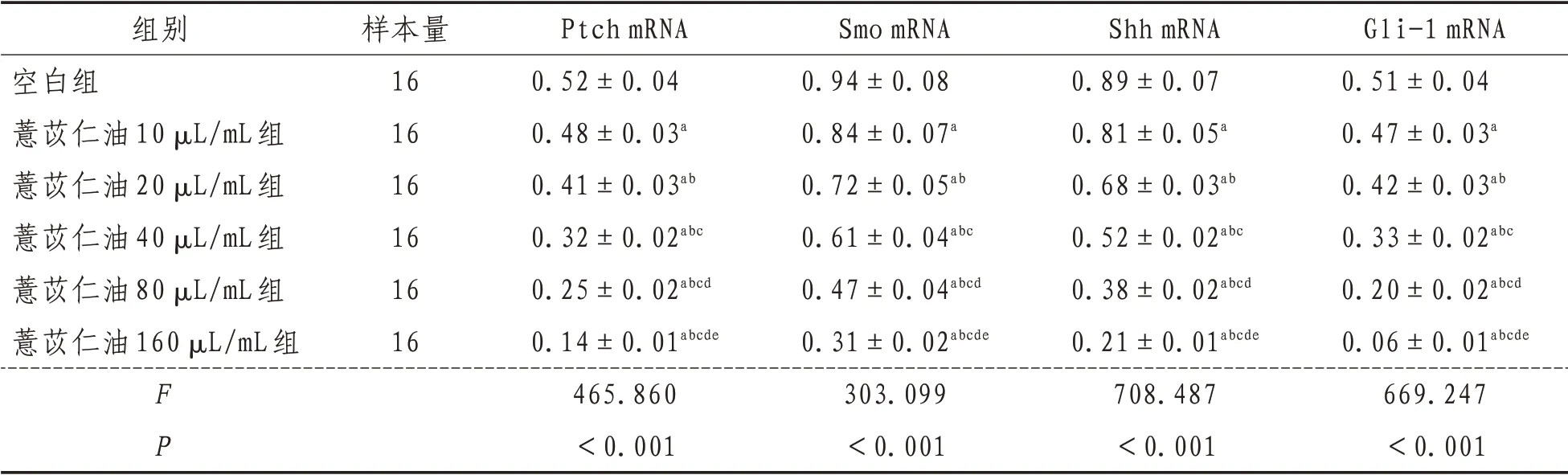
表4 各组Ptch、Smo、Shh和Gli-1 mRNA表达比较(±s)
注:a 表示与空白组比较,P<0.05;b 表示与薏苡仁油10 µL/mL 组比较,P<0.05;c 表示与薏苡仁油20 µL/mL 组比较,P<0.05;d表示与薏苡仁油40 µL/mL组比较,P<0.05;e表示与薏苡仁油80 µL/mL组比较,P<0.05
组别空白组薏苡仁油10 µL/mL组薏苡仁油20 µL/mL组薏苡仁油40 µL/mL组薏苡仁油80 µL/mL组薏苡仁油160 µL/mL组FP样本量16 16 16 16 16 16 Ptch mRNA 0.52±0.04 0.48±0.03a 0.41±0.03ab 0.32±0.02abc 0.25±0.02abcd 0.14±0.01abcde 465.860<0.001 Smo mRNA 0.94±0.08 0.84±0.07a 0.72±0.05ab 0.61±0.04abc 0.47±0.04abcd 0.31±0.02abcde 303.099<0.001 Shh mRNA 0.89±0.07 0.81±0.05a 0.68±0.03ab 0.52±0.02abc 0.38±0.02abcd 0.21±0.01abcde 708.487<0.001 Gli-1 mRNA 0.51±0.04 0.47±0.03a 0.42±0.03ab 0.33±0.02abc 0.20±0.02abcd 0.06±0.01abcde 669.247<0.001
2.4 CyclinD1、p21、Caspase-3、Bcl-2、Ptch、Smo、Shh 和Gli-1 蛋白表达空白组及薏苡仁油10、20、40、80、160 µL/mL 各浓度组培养人结肠癌HT-29 细 胞,CyclinD1、p21、Caspase-3、Bcl-2、Ptch、Smo、Shh 和Gli-1 蛋白的表达经单因素方差分析结果显示,差异有统计学意义(P<0.05),进一步采用SNK-q 检验对各组间上述指标的表达进行两两比较结果显示,各浓度水平组间差异均有统计学意义(P<0.05)。薏苡仁油浓度为10、20、40、80、160 µL/mL 时上述指标的蛋白表达量均比空白组明显下降,并随薏苡仁油浓度升高,上述指标的蛋白表达量逐渐降低,且差异有统计学意义(P<0.05)。薏苡仁油浓度为10、20、40、80、160 µL/mL时p21 和Caspase-3 蛋白表达量均比空白组明显上升,并随薏苡仁油浓度升高,p21 和Caspase-3蛋白表达量逐渐升高,差异有统计学意义(P<0.05)。见表5。
表5 各组CyclinD1、p21、Caspase-3、Bcl-2、Ptch、Smo、Shh、Gli-1蛋白量比较(±s)
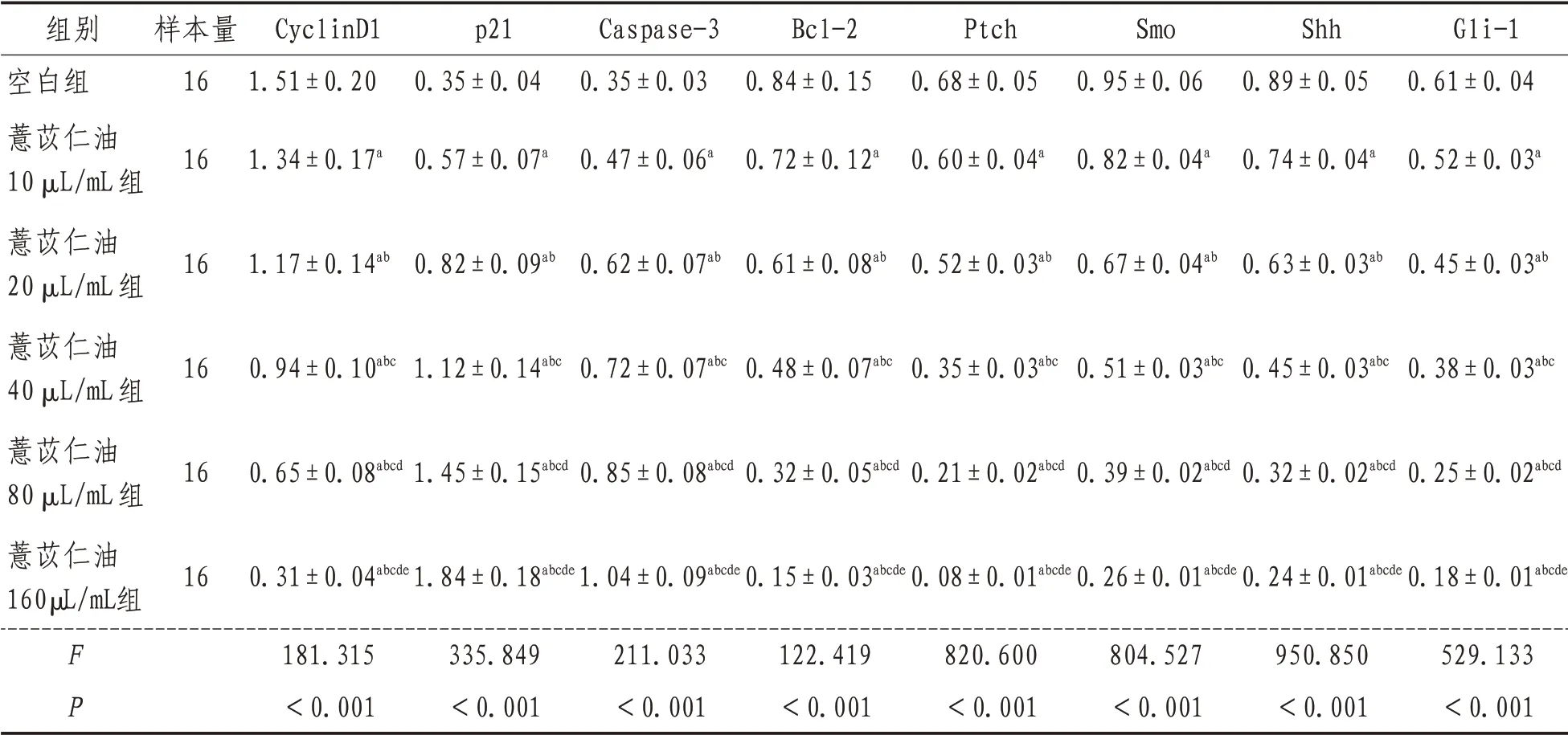
表5 各组CyclinD1、p21、Caspase-3、Bcl-2、Ptch、Smo、Shh、Gli-1蛋白量比较(±s)
注:a 表示与空白组比较,P<0.05;b 表示与薏苡仁油10 µL/mL 组比较,P<0.05;c 表示与薏苡仁油20 µL/mL 组比较,P<0.05;d表示与薏苡仁油40 µL/mL组比较,P<0.05;e表示与薏苡仁油80 µL/mL组比较,P<0.05
组别空白组薏苡仁油10 µL/mL组薏苡仁油20 µL/mL组薏苡仁油40 µL/mL组薏苡仁油80 µL/mL组薏苡仁油160µL/mL组FP样本量16 16 16 16 16 16 CyclinD1 1.51±0.20 1.34±0.17a 1.17±0.14ab 0.94±0.10abc 0.65±0.08abcd 0.31±0.04abcde 181.315<0.001 p21 0.35±0.04 0.57±0.07a 0.82±0.09ab 1.12±0.14abc 1.45±0.15abcd 1.84±0.18abcde 335.849<0.001 Caspase-3 0.35±0.03 0.47±0.06a 0.62±0.07ab 0.72±0.07abc 0.85±0.08abcd 1.04±0.09abcde 211.033<0.001 Bcl-2 0.84±0.15 0.72±0.12a 0.61±0.08ab 0.48±0.07abc 0.32±0.05abcd 0.15±0.03abcde 122.419<0.001 Ptch 0.68±0.05 0.60±0.04a 0.52±0.03ab 0.35±0.03abc 0.21±0.02abcd 0.08±0.01abcde 820.600<0.001 Smo 0.95±0.06 0.82±0.04a 0.67±0.04ab 0.51±0.03abc 0.39±0.02abcd 0.26±0.01abcde 804.527<0.001 Shh 0.89±0.05 0.74±0.04a 0.63±0.03ab 0.45±0.03abc 0.32±0.02abcd 0.24±0.01abcde 950.850<0.001 Gli-1 0.61±0.04 0.52±0.03a 0.45±0.03ab 0.38±0.03abc 0.25±0.02abcd 0.18±0.01abcde 529.133<0.001
3 讨论
薏苡仁油是从薏苡仁中提取得到的脂肪油,其制剂康莱特注射液已批准上市,应用于原发性非小细胞肺癌及原发性肝癌的治疗中。研究表明,其可通过不同途径抑制肿瘤细胞的增殖并诱导其凋亡,在食管癌、肝癌、结肠癌等多种肿瘤中都有明显的抗癌作用[2]。Hh信号通路在胚胎发育过程中参与胃肠道、肺、神经管、皮肤和骨骼的形成,在成年组织中,Hh 信号途径的传导异常可能与癌症有关[3]。本文从Hh信号途径角度探讨薏苡仁油抗结肠癌细胞的机制。
保学明等[4]以薏苡仁酯作用于结肠癌SW480细胞,发现薏苡仁酯组较对照组可明显抑制癌细胞增殖。薏苡仁油抑制结肠癌细胞增殖机制可能通过Fas-FasL 途经进行,亦可能使薏苡仁油作用于细胞周期的G2+M 时相,并抑制细胞端粒酶活性[5]。薏苡仁油可抑制结肠癌细胞接种于裸鼠的脾转移瘤和肝转移瘤,推理薏苡仁油对于结肠癌晚期患者仍有明显效果[6]。薏苡仁油的应用还未普及,其药理机制还不是十分明确,有待进一步研究。
已有研究表明,Hh 信号通路的基因改变可能与肿瘤的始动有关。Hh 信号通路主要是由配体Shh、12 次跨膜糖蛋白受体Ptch、7 次跨膜蛋白受体Smo、含有锌指结构域的转录因子Gli 等构成,当该信号通路收受到刺激,相应下游蛋白激活并过度表达,进而参与肿瘤的异常增生,肿瘤被抑制时,相应的下游蛋白表达也会下降[7]。 此外,CyclinDl、Caspase-3、P21、Bcl-2 均为Hh 信号通路相关蛋白。CyclinDl属于细胞周期调节DNA复制过程的激酶,肿瘤增殖活跃的细胞相应CyclinDl表 达 量 也 会 增 多[8];P21 属 于CDK 激 酶 抑 制 物(CDKIs),与肿瘤抑制作用密切相关;Caspase-3蛋白属于Caspases 蛋白家族中的效应凋亡蛋白,是细胞凋亡过程中最主要的终末剪切酶,参与细胞凋亡的诱导[9];Bcl-2 属原癌基因,位于线粒体膜,可抑制许多因素引起的细胞凋亡,通常在正常组织中低表达,而在肿瘤组织中表达较高,肿瘤细胞的存活可能有赖于Bcl-2的细胞保护作用[10-13]。
有关薏苡仁油对结肠癌HT-29 细胞的抑制机制目前尚无报道,本研究发现,与空白组比较,薏苡仁油对人结肠癌HT-29 细胞具有抑制增殖和促进凋亡的作用,随着薏苡仁油浓度的增加,抑制率和凋亡率也逐渐升高,差异有统计学意义。经检测,薏苡仁油组Ptch、Smo、Shh 和Gli-1 mRNA 和蛋白的表达较空白组增高,表达量随薏苡仁油浓度的增加而增加。CyclinD1、Bcl-2 蛋白表达量较空白组下降,并随薏苡仁油浓度升高蛋白表达量逐渐降低。p21 和Caspase-3 蛋白表达量较空白组上升,并随薏苡仁油浓度升高,p21和Caspase-3蛋白表达量逐渐升高。推测薏苡仁油对结肠癌HT-29细胞的抑制机制与Hh信号通路有关。
综上所述,薏苡仁油对结肠癌HT-29 细胞具有抑制生长和促进凋亡作用,为结肠癌的防治提供了新的方法;其机制与调节Hh 通路相关成员CyclinD1、p21、Caspase-3、Bcl-2、Ptch、Smo、Shh和Gli-1 的表达有关。下一步我们将更深入探讨其临床应用,同时为其他肿瘤的防治提供依据。
