复合芽胞杆菌共培养条件的响应面优化研究
2022-01-21王小兵付宽宽顾红亚汪晓丽
王小兵,付宽宽,顾红亚,汪晓丽
(1.扬州大学 环境科学与工程学院,江苏 扬州 225127;2.江苏省太仓市浮桥镇农业农村服务站,江苏 太仓 215434)
近年来,随着农业结构的不断调整,我国设施农业发展迅速,但设施农业相对封闭的土壤环境和人为不合理施肥导致连作障碍越来越严重。设施土壤中病原菌大量滋生,土壤微生物中细菌/真菌比逐渐下降,土传病害越来越严重[1]。另外,种植户往往忽略土壤营养元素之间的平衡,一味追求作物产量而增施氮肥,致使氮肥在土壤中大量积累,从而产生土壤盐渍化[2]。较高的盐浓度会抑制作物对水分和养分的吸收,进而引发作物的生理性干旱[3]。因此土传病害和土壤次生盐渍化已成为设施农业主要的障碍因子。
设施土壤连作障碍治理措施主要包括土壤消毒、利用抗病品种、嫁接技术、轮作倒茬、土壤施肥、化学防治及生物防治等[4-6]。生物防治技术已被证明对许多植物病原菌和害虫有效[7],因其具有成本低、效率高、不易产生二次污染和环境友好等优点更具有应用前景。近年来,芽胞杆菌在生物防治中的应用受到了广泛的关注。芽胞杆菌能增强作物对病害的控制,诱导作物防御病害,同时能刺激作物生产和合成1-氨基环丙烷-羧酸脱氨酶(ACC)活性和激素,促进作物生长和养分吸收,提高作物的抗氧化能力[8]。Wang等[9]分离并发现了枯草芽胞杆菌BSN-1能够抑制土壤中磷酸盐的结晶,可以有效减轻土壤盐渍化的危害。
响应面方法是生物学中一种重要的优化方法,在发酵工艺优化中应用相当广泛。Khan等[10]通过响应面法优化了芽胞杆菌菌株MS07的培养基以提高抗菌肽的产量。苏同伟等[11]通过响应面法优化了海洋微生物霉菌的培养条件,在培养时间为 9 d、诱导物添加量为 0.5%、培养温度为 28 ℃的条件下,产量可达 1 978.33 mg/L。
通过单一生防菌防治设施连作障碍的研究报道较多[12-16],但用单一生防菌防治设施连作障碍在防治范围上具有一定的局限性,而复合生防菌不仅有更大的防治范围,而且在其共生产物中的活性物质也往往具有特殊的防治效果[17]。然而目前复合菌剂生产基本上采用单菌株发酵培养方式,而对多菌株共培养的研究较少[18-19]。
本课题组在前期筛选了2株芽胞杆菌,其中1株解淀粉芽胞杆菌(Bacillusamyloliquefaciens)BZ6-1对花生青枯病菌等病原细菌,以及水稻纹枯病菌和稻瘟菌等病原真菌均有较强的抑制作用,具有较广的抗菌谱[20-21]。另1株短小芽胞杆菌(Bacilluspumilus)SC-12能生产吲哚乙酸(IAA),并具有显著的耐盐[22]和促生作用[23]。前期研究已证明菌株BZ6-1与SC-12之间没有拮抗作用,可以进行共培养[24]。本研究以短小芽胞杆菌SC-12和解淀粉芽胞杆菌BZ6-1为研究对象,采用单因素和响应面试验法优化了复合芽胞杆菌的共培养条件,并使用100 L发酵罐进行了发酵工艺的验证试验,以期获得具有高有效活菌数和高经济效益的复合芽胞杆菌菌剂。
1 材料与方法
1.1 材料
1.1.1 菌株 供试菌株分别为解淀粉芽胞杆菌BZ6-1(保藏编号:CGMCC No.2892)和短小芽胞杆菌SC-12(保藏编号:CGMCC No.7622)。
1.1.2 培养基 LB固体培养基:胰蛋白胨10 g、酵母提取物5 g、氯化钠5 g、琼脂粉20 g、去离子水1 L, pH 7。LB液体培养基:胰蛋白胨10 g、酵母提取物5 g、氯化钠5 g、去离子水1 L, pH 7。发酵培养基:葡萄糖20 g、胰蛋白胨10 g、氯化钠4 g、磷酸氢二钾0.5 g、硫酸镁0.2 g、氯钾钙1 g、去离子水1 L。
1.2 方法
1.2.1 菌种培养 将BZ6-1菌株从-70 ℃取出,接种于LB固体培养基,在35 ℃下培养24 h后挑取1环菌落,接种于5 mL LB液体培养基中,在35 ℃和150 r/min转速条件下培养24 h,制备BZ6-1菌株的种子液,使其浓度为1×108cfu/mL。将SC-12菌株从-70 ℃取出,接种于LB固体培养基,在35 ℃下培养24 h后挑取1环菌落,接种于5 mL LB液体培养基中,在35 ℃和150 r/min转速条件下培养24 h,制备SC-12菌株的种子液,使其浓度为1×108cfu/mL。取100 μL BZ6-1菌株种子液和100 μL SC-12菌株种子液于5 mL LB液体培养基中,在35 ℃和150 r/min转速条件下培养24 h,制备BZ6-1菌株和SC-12菌株的共培养发酵液,使其浓度为1×108cfu/mL。
1.2.2 菌量测定 采用平板菌落计数法[25],通过梯度稀释计算菌落数。
1.2.3 单因素试验 以两种菌株比例1∶1、接菌量2%(v/v)、pH 7、转速150 r/min、培养温度35 ℃、培养时间24 h为固定值。按照单因素试验依次改变变量,将菌株SC-12和菌株BZ6-1的比例设为1∶1、2∶1、5∶1、10∶1、1∶2、1∶5、1∶10(v/v);接种量设为1%、2%、5%、10%(v/v); pH值设为6、7、8、9;摇床转速设为80、120、160、200 r/min;培养温度设为25、30、35、40 ℃;培养时间设为8、12、16、20、24、28、32 h。取150 mL发酵培养基在250 mL的三角瓶中进行发酵培养。
1.2.4 采用响应面法优化发酵条件 通过Desgin-Exper 8.0.6 软件进行Plackett-Burman试验并确定影响共培养的重要因子,再以得到的重要因子为基础设计最陡爬坡路径试验。最陡爬坡试验第1组条件是接种量2%、pH 7、转速120 r/min;第2组条件是接种量3.5%、pH 7.5、转速140 r/min;第3组条件是接种量5%、pH 8、转速160 r/min;第4组条件是接种量6.5%、pH 8.5、转速180 r/min。
根据最陡爬坡试验结果,以接种量 3.5%、pH 7.5、转速 140 r/min为中心点设计试验,以复合菌菌落数为响应值,设计三因素三水平的响应面试验。影响发酵条件的三因素三水平设计为接种量(2.0%、3.5%、5.0%)、pH值(7.0、7.5、8.0)、转速(120、140、160 r/min),共计17组试验处理。利用Design-Expert 8.0.6软件,进行Box-Behnken中心组合设计并进行响应面分析[26]。
1.2.5 发酵罐验证试验 使用100 L的发酵罐进行优化发酵条件和原始发酵条件两个处理试验,优化发酵处理即在发酵培养基上以最优条件[SC-12菌株与BZ6-1菌株菌落数比2∶1(v/v)、培养温度30 ℃、培养时间16 h、接种量3%、转速132 r/min、pH 7.6]进行发酵;原始发酵处理即在发酵培养基上以SC-12菌株与BZ6-1菌株菌落数比1∶1(v/v)、温度35 ℃、培养时间24 h、接种量2%、转速150 r/min、pH 7进行发酵。在发酵处理结束后,从发酵罐中取样至无菌离心管中,以平板计数法测定滤液菌落数。
1.2.6 数据统计与分析 采用 Microsoft Office Excel 2016 软件进行数据统计,用SPSS statistics 21软件进行数据统计分析,用Origin 8.5软件进行图片绘制。
2 结果与分析
2.1 单因素优化试验
单因素优化试验结果见图1。当接种量为2%、5%时,两种芽胞杆菌的菌落数较多,且与1%接种量的菌落数差异显著;当接种量为5%时,菌落数达到峰值2.71×108cfu/mL。当pH值为7和8时,两种芽胞杆菌的菌株生长旺盛,菌落数居前2位且与其它处理差异显著;当pH值为8时SC-12菌株和BZ6-1菌株的菌落数达到峰值2.72×108cfu/mL;当pH值为7时两种菌株的菌落数为2.42×108cfu/mL。当转速为160 r/min时,菌落数达到峰值7.60×108cfu/mL。当SC-12菌株和BZ6-1菌株的比例为2∶1时,菌落数达到峰值4.36×108cfu/mL,显著高于其他处理。当温度为30 ℃时,SC-12菌株和BZ6-1菌株的菌落数达到峰值6.60×108cfu/mL,且与其它处理差异显著。当发酵时间为16 h时菌落数达到峰值1.17×108cfu/mL,且与其它处理差异显著。

柱状图上标注不同字母表示差异显著(P<0.05)。下图同。
2.2 Plackett-Burman共培养发酵试验
根据共发酵培养条件的单因素试验结果,利用Design-Expert 8.0.6软件进行Plackett-Burman试验设计,见表1。对共培养的条件因子进行显著性分析,结果(表2)显示:该模型的P=0.0055,在0.01水平上显著,因此该模型的可信度高于99%;因素A(接种量)的P=0.0414,因素B(pH值)的P=0.0267,因素C(转速)的P=0.0469,可信度均高于95%,说明上述3个因素对复合芽胞杆菌的菌落数有显著的影响,且影响程度表现为pH值>接种量>转速;其余因素对复合芽胞杆菌的菌落数的影响不大。因此,选择上述3个因素进行下一步的试验。

表2 共培养因素的效应值及方差分析结果
2.3 最陡爬坡路径试验
根据单因素优化实验结果进行最陡爬坡路径试验设计(见表3)。结果表明当接种量为3.5%、pH值为 7.5、转速为140 r/min时复合芽胞杆菌的菌落数最多,达到9.20×108cfu/mL。因此选择这个点为响应面试验的中心点。

表3 最陡爬坡路径试验设计及结果
2.4 响应面法优化试验
以两种芽胞杆菌的菌落数为响应值,对表4中的试验数据进行回归分析,得到下列二次多项回归方程:菌落数=10.72+0.15A+2.16B-0.36C-0.47AB+1.73AC-0.40BC-1.69A2-3.01B2-1.76C2,该方程的相关系数R2=0.9168,说明该方程的拟合程度好,可以对试验结果进行预测。

表4 响应面试验编码方案与试验结果
由表5的方差分析结果可知:模型的F=8.57,P=0.0049<0.0100,说明该回归方程是极显著的;拟失项不显著(P=0.7100>0.05),说明该回归方程具有较高的可信度;模型的相关系数R2=0.9168,说明该模型能够解释91.68%的变化;模型的一次项B及二次项B2影响极显著(P<0.01);二次项A2、C2以及交互项AC影响显著(P<0.05)。

表5 菌株菌落数的回归模型方差分析结果
不同培养条件对复合芽胞杆菌菌落数影响的响应面图和等高线图见图2。等高线图可以准确地反映接种量、pH值和转速之间的交互影响,如果等高线为椭圆形则代表其交互作用较显著;如果等高线为圆形则相反[27]。从图2中可以看出:接种量和转速的等高线为椭圆形,说明其对复合芽胞杆菌菌落数的交互作用显著,符合方差分析中交互项AC影响显著(P<0.05)的结果;pH值和接种量、pH值和转速的等高线均为圆形,说明其对复合芽胞杆菌菌落数的交互作用不显著;固定接种量、pH值、转速中的任一因素,复合芽胞杆菌的菌落数会随着另一个因素的升高而升高,说明转速和接种量、pH值和接种量、pH值和转速都可以找到极值点。从回归方程可知,SC-12菌株和BZ6-1菌株共发酵的最佳培养条件:SC-12菌株与BZ6-1菌株的菌落数比为2∶1;培养温度为30 ℃;培养时间为16 h;接种量为3%;转速为132 r/min;pH值为7.6。

A为接种量/%; B为pH值; C为转速/(r/min); Y为菌落数/(×108 cfu/mL)。
2.5 优化后共发酵的效果
在优化共发酵后,芽胞杆菌的菌落数相较于原始发酵的菌落数有了显著的提升:在原始发酵条件下芽胞杆菌的菌落数只有7.90×108cfu/mL,而在优化发酵条件后芽胞杆菌的菌落数达到了11.00×108cfu/mL,后者比前者提升了39.20%。
2.6 发酵罐试验验证
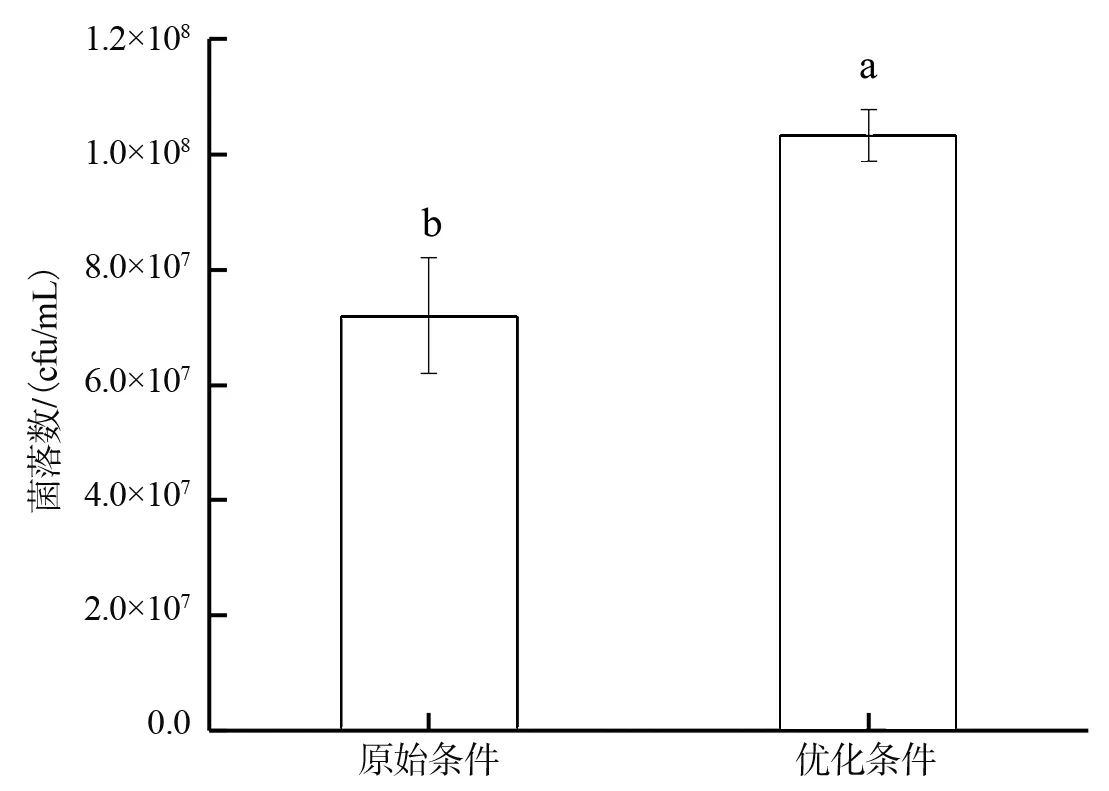
在100 L发酵罐中以响应面法优化预测的共培养条件对复合菌株进行扩大培养验证试验,结果如图4所示。在发酵罐中优化发酵的菌落数达到了10.30×108cfu/mL,而原始发酵的菌落数只有7.20×108cfu/mL,前者比后者提升了43.00%。该验证值与预测值吻合度高,表明响应面分析法可应用于优化共培养发酵试验[28]。

发酵条件
发酵条件
3 讨论与结论
生物菌剂通过改良土壤生物环境来抑制致病菌,提高土壤养分的有效性,从而有效控制设施土壤连作障碍。Laura等[29]利用芽胞杆菌XT1 CECT 8661对设施蔬菜灰霉病进行了防治;王红丽等[30]通过复合接种枯草芽胞杆菌GLB191 和短小芽胞杆菌GLB197提高了对葡萄灰霉病菌的抑病率;吴忠红等[31]研究了耐盐促生细菌Rs-198与Rs-5混合培养提高作物耐盐性以及促进作物生长的效果。前人研究的生物菌剂基本上以单一菌剂或单一功能混合菌剂为主,而本研究的菌剂是具有耐盐、促生和抗病等多重作用的复合菌剂,为今后多功能复合菌剂的研发提供了理论依据。
影响微生物发酵的因素包括培养基组分以及温度、pH值、溶氧、接种量等发酵条件[32]。王建等[33]通过采用响应面法优化复合乳酸菌的培养条件,将菌落数对数值从6.93提高到9.79。本文通过采用单因素优化、Plackett-Burman试验和响应面分析等方法对复合芽胞杆菌的共培养条件进行优化后,芽胞杆菌的菌落数有了显著的提升,达到了11.00×108cfu/mL,比未优化前的芽胞杆菌的菌落数提升了39.20%,表明通过优化微生物的共培养条件可以显著提高复合芽胞杆菌的菌落数量。
不同培养条件对微生物共培养发酵的影响程度均有不同。李佳娣等[34]优化了杀线虫解淀粉芽胞杆菌Sneb709与费氏中华根瘤菌Sneb183的共培养发酵条件,发现影响发酵效果的5个培养条件的顺序为温度>pH值>装液量>时间>转速。本研究发现影响复合芽胞杆菌菌落数的主要因子是pH值、接种量和转速,而且影响程度表现为pH值>接种量>转速,这可能与不同微生物具有不同的生长特性有关。
本研究发现通过采用响应面法优化复合芽胞杆菌的共培养条件,可以显著提升复合芽胞杆菌的菌落数。但今后尚需进一步明确复合芽胞杆菌在共培养后的活性物质产出情况,以期为防治设施农业次生盐渍化和土传病害提供理论依据。
本研究通过单因素优化、Plackett-Burman试验和响应面分析等方法确定了复合芽胞杆菌的最适共培养条件:SC-12菌株与BZ6-1菌株的菌落数比为2∶1(v/v);培养温度为30 ℃;培养时间为16 h;接种量为3%(v/v);转速为132 r/min;pH值为7.6。以优化后的培养条件进行共培养,得到的菌落数为11.00×108cfu/mL,比原始发酵的菌落数增加了39.20%。在100 L发酵罐中的菌落数达到10.30×108cfu/mL,比原始发酵的菌落数增加了43.00%。本次试验探索了不同培养条件对复合芽胞杆菌共培养菌落数的影响,得到了最佳共培养条件,同时在放大发酵试验中得到了验证。本研究结果可为具有高有效活菌数和高经济效益的复合芽胞杆菌菌剂生产提供理论依据,为生物防治设施农业次生盐渍化和土传病害提供技术支撑。
