转录因子NR4A2对乳腺癌细胞增殖与凋亡的调节作用*
2022-01-21蔡明袁荣华杨逸凡
蔡明, 袁荣华,杨逸凡
(南通大学第二附属医院 甲乳外科, 江苏 南通 226000)
乳腺癌为女性最常见癌症类型,1980—2010年乳腺癌发病年增加率达3.1%[1],估计到2030年全世界乳腺癌新发病例将近220万[2]。乳腺癌已成为当前女性癌症死亡的主因,占所有癌症死亡的14.3%[3-4]。由于对肿瘤早期诊断和综合治疗策略的进步,乳腺癌患者的预后得到一定改善[5]。研究表明,转录因子(transcription factors,TFs)在乳腺癌细胞的增殖、入侵和迁移中发挥重要作用[6-8],内源性配体的核孤立受体在生长发育、细胞平衡和癌症发生进展中亦发挥作用,其中某些受体的表达过度或下调对患者的生存具有预测意义[9-11]。孤儿受体表现出肿瘤特异性的致癌或肿瘤抑制剂样活性[12]。核孤立受体NR4A2作为转录因子,已被证实具有一定肿瘤抑制作用[13-15]。在胰腺癌、结肠癌、宫颈癌、卵巢癌、胃癌等细胞系中过表达NR4A2可诱发肿瘤细胞生长抑制,并下调细胞增殖、迁移和侵袭能力[16-18]。目前,关于NR4A2在乳腺癌中的研究较少[19]。本研究采用乳腺癌细胞MCF-7细胞系进行NR4A2过表达和干扰处理,观察NR4A2对乳腺癌细胞增殖和凋亡的调控作用。
1 材料与方法
1.1 材料与仪器
人正常乳腺上皮细胞MCF 10A和乳腺癌细胞系HBL101、MDA-MD-435、MCF-7和HS598T细胞系(ATCC,中国),10%胎牛血清(Gibco,USA),50 U/mL青霉素(Gibco,USA),100 mg/L链霉素(Gibco,USA),RPMI1640培养基(Gibco,USA),oe-NR4A2、si-NR4A2和si-NC质粒(上海吉玛公司,中国);磷酸盐缓冲液(赛默飞世尔,USA),Lipofectamine 2000(赛默飞世尔,USA),Trizol(赛默飞世尔,USA),SYBR®Premix Ex TaqTMⅡ试剂盒(宝生物工程(大连)有限公司,中国)。RIPA裂解液(R0010,solarbio),BCA试剂盒(赛默飞世尔,USA),PVDF膜(ISEQ00010,Millipore,Billerica,MA,USA),兔抗人NR4A2(ab54366)、PCNA(ab92552)、Bax(ab32503)、Bcl-2(ab32124)和GAPDH(ab8226 Abcam,UK),HRP标记羊抗兔IgG抗体(北京中山生物技术有限公司),ECL荧光检测试剂盒(BB-3501,Ameshame,UK)。CCK8(Sigma,USA),酶标仪(北京诺亚威仪器仪表有限公司,中国),胰酶(赛默飞世尔,USA),Annexin-V-FITC细胞凋亡检测试剂盒(Sigma,USA),HEPES缓存液(赛默飞公司,USA)。细胞培养箱(thromo3111,USA),ABI PRISM®7300系统(Prism®7300,上海坤科仪器设备有限公司,中国),Bio-Rad图像分析系统(BIO-RAD,USA),酶标仪(北京诺亚威仪器仪表有限公司,中国)。
1.2 方法
1.2.1细胞培养 分别将人正常乳腺上皮细胞MCF 10A和乳腺癌细胞系HBL101、MDA-MD-435、MCF-7、HS598T细胞系置于37 ℃、5%CO2细胞培养箱中,用含10%胎牛血清、50 U/mL青霉素、100 mg/L链霉素的RPMI1640培养基中进行培养,每天更换培养基,3~4 d传代,选择对数生长期且生长状态较好的细胞进行实验。
1.2.2细胞分组 取对数生长期的人乳腺癌MCF-7细胞系按1×105/孔密度接种于6孔培养板内,转染前1天用不含血清和双抗的RPMI 1640培养基培养。细胞分别转染oe-NC(oe-NC组)、si-NC(si-NC组)、NR4A2过表达质粒(oe-NR4A2组)和si-NR4A2干扰序列(si-NR4A2组),按照Lipofectamine 2000说明书进行转染。将2 μg oe-NR4A2质粒、50 ng si-NR4A2干扰序列或si-NC快速离心,加入170 μL磷酸盐缓冲液后混匀,静置5 min;后加8 μL Lipofectamine 2000,轻荡混匀,室温下静置20 min,添加5 μmol/LDAPT;将以上混合液加入6孔板,轻轻混匀;转染后8 h更换为含10%胎牛血清的培养基。转染48 h后,收集细胞用于后续实验。
1.3 观察指标
1.3.1qRT-PCR检测NR4A2、PCNA、Bcl-2和Bax的mRNA表达水平 收集转染48 h后的各组细胞,Trizol提取总RNA,逆转录合成cDNA。SYBR®Premix Ex TaqTMⅡ试剂盒进行荧光定量PCR检测。依次加入以下组分:25 μL SYBR®Premix Ex TaqTMⅡ(2×),各2 μL PCR上、下游引物,l μL ROX Referesi-NCe Dye参比染料(50×),4 μL DNA模板,以及16 μL ddH2O。采用ABI PRISM®7300系统进行荧光定量PCR,反应条件为95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火30 s,循环32次后72 ℃延伸1 min。ΔCt=CT目的基因-CTGAPDH,ΔΔCt=Ct实验组-ΔCt对照组,以GAPDH为内参,以2-ΔΔCt表示各目的基因相对表达量。引物见表1。

表1 qRT-PCR引物序列
1.3.2Western blot检测NR4A2、PCNA、Bax和Bcl-2蛋白表达 各组细胞转染48 h后,预冷PBS洗3遍,以含PMSF的RIPA裂解液提取细胞中总蛋白,BCA试剂盒测定蛋白浓度,去离子水调零。加入50 μg蛋白样品,70 V恒压电泳3 h。湿转法将蛋白转至PVDF膜,恒流150 mA转膜。5%脱脂奶粉4 ℃封闭2 h。TBST洗膜后,加入一抗兔抗人NR4A2(1∶2 000)、PCNA(1∶5 000)、Bax(1∶1 000)、Bcl-2(1∶1 000)及GAPDH(1∶2 000),4 ℃孵育过夜,TBST洗3 次,每次6 min。加入HRP标记羊抗兔IgG抗体(1∶5 000)孵育2 h。重复TBST洗膜,取ECL荧光检测试剂盒A液和B液、等体积混匀,200 μL滴于膜上,在凝胶成像仪中曝光成像。应用Bio-Rad图像分析系统采集图像,以Image J软件分析各蛋白条带灰度值与内参GAPDH蛋白条带灰度值的比值,表示相对蛋白含量。
1.3.3CCK8法检测各组细胞增殖水平 取对数生长期的各组细胞,用含10%胎牛血清的DMEM培养基制备成1×104个/mL的细胞悬液,接种至96 孔培养板,每组各设8孔,每孔100 μL,置于37 ℃、5%CO2细胞培养箱中培养;培养48 h取出培养板,每孔加入10 μL CCK8继续培养1 h。应用酶标仪于450 nm处读取各孔吸光度值(OD)值。
1.3.4集落形成实验 取对数生长期细胞接种于75 mm平皿内(细胞悬液中单个细胞比例>95%),每皿800个细胞,各加入3%琼脂1 mL(已融化,65 ℃水浴中放置),迅速加入并混匀;培养48 h后,磷酸盐缓冲液(pH 6.8)洗涤2次,甲醇固定20 min,10% Giemse染色20 min,去离子水冲洗,晾干。解剖镜下计数每皿>20个细胞以上的集落数,计算集落形成率。
1.3.5流式细胞术检测各组细胞凋亡情况 细胞转染48 h后,用不含EDTA胰酶消化并收集细胞于流式管中,2 000 r/min离心30 min,弃上清。预冷PBS洗涤3次后,2 000 r/min重复离心20 min,弃上清;按照Annexin-V-FITC细胞凋亡检测试剂盒说明书,将HEPES缓存液、Annexin-V-FITC与PI(50∶1∶2)配成Annexin-V-FITC/PI染液,加入染液100 μL混匀,室温孵育15 min后加入 HEPES缓存液1 mL 振荡混匀。应用流式细胞仪检测细胞凋亡,检测器激发波长488 nm。
1.4 统计学分析

2 结果
2.1 NR4A2在乳腺上皮细胞及各乳腺癌细胞系中的表达
与人正常乳腺上皮细胞MCF 10A比较,乳腺癌HBL101、MDA-MD-435、MCF-7及HS598T细胞系中NR4A2 mRNA表达降低,差异有统计学意义(P<0.05),其中MCF-7细胞系中表达量最低,故选择该细胞进行后续实验。见图1。
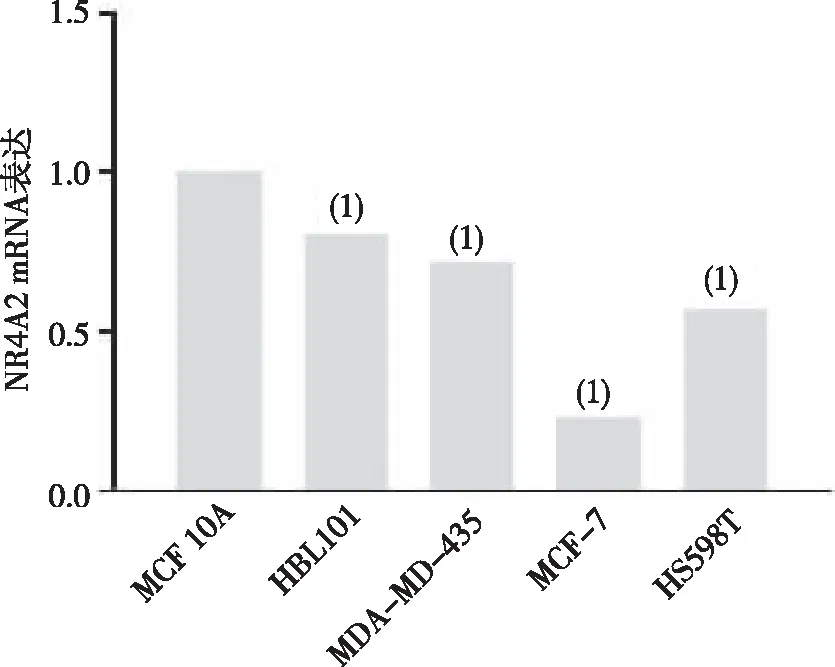
注:(1)与人正常乳腺上皮细胞MCF 10A比较,P<0.05。
2.2 转染后各组NR4A2 mRNA表达
与oe-NC组比较,oe-NR4A2组细胞NR4A2 mRNA表达量升高;而与si-NC组比较,si-NR4A2组NR4A2 mRNA表达量降低,差异有统计学意义(P<0.05);oe-NC组和si-NC组NR4A2 mRNA表达量比较,差异无统计学意义(P>0.05)。见图2。

注:(1)与oe-NC组比较,P<0.05;(2)与si-NC组比较,P<0.05。
2.3 转染后各组NR4A2蛋白表达
与oe-NC组比较,oe-NR4A2细胞NR4A2蛋白表达量升高;而与si-NC组比较,si-NR4A2组NR4A2蛋白表达量均降低,差异均有统计学意义(P<0.05);oe-NC组和si-NC组NR4A2蛋白表达量比较,差异无统计学意义(P>0.05)。见图3。

注:A为各组细胞NR4A2蛋白条带图,B为各组细胞NR4A2蛋白水平统计图;(1)与oe-NC组比较,P<0.05;(2)与si-NC组比较,P<0.05。
2.4 转染后各组细胞增殖能力
与oe-NC组比较,oe-NR4A2组细胞OD值降低;而与si-NC组比较,si-NR4A2组OD值升高,差异均有统计学意义(P<0.05);oe-NC组和si-NC组增殖能力比较,差异无统计学意义(P>0.05)。见图4。
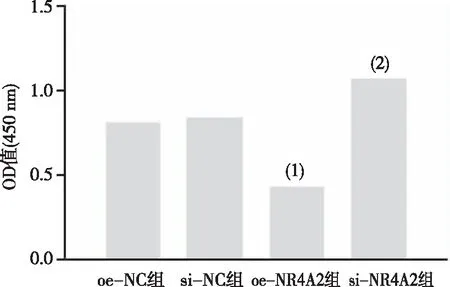
注:(1)与oe-NC组比较,P<0.05;(2)与si-NC组比较,P<0.05。
2.5 转染后各组细胞集落形成能力
与oe-NC组比较,oe-NR4A2组细胞集落形成数减少;而与si-NC组比较,si-NR4A2组细胞集落形成数增多,差异均有统计学意义(P<0.05);oe-NC组和si-NC组集落形成数比较,差异无统计学意义(P>0.05)。见图5。
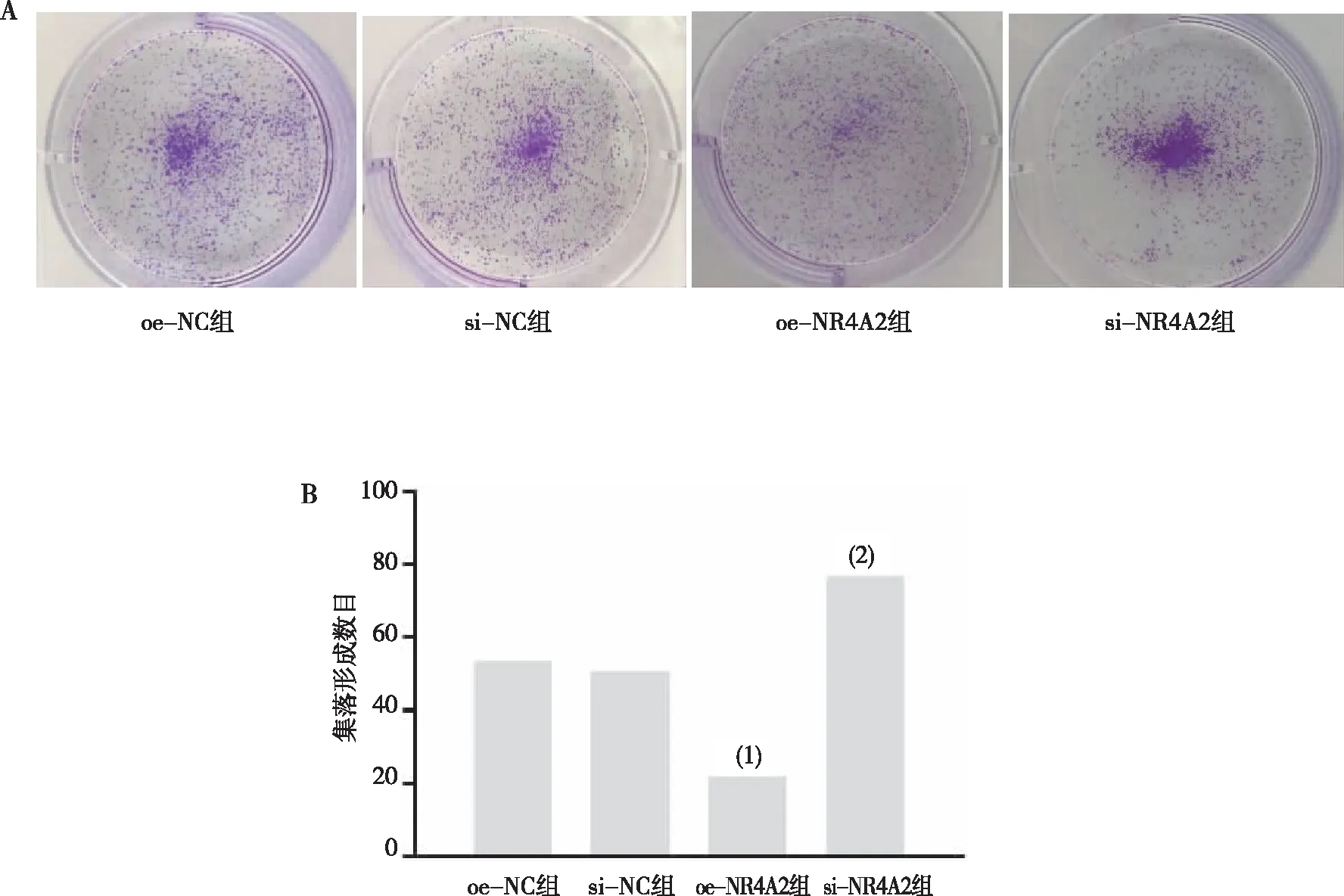
注:A为各组细胞集落形成情况(100×),B为各组细胞集落形成数统计图;(1)与oe-NC组比较,P<0.05;(2)与si-NC组比较,P<0.05。
2.6 转染后各组细胞凋亡情况
与oe-NC组比较,oe-NR4A2组细胞凋亡率升高;而与si-NC组比较,si-NR4A2组凋亡率降低,差异均有统计学意义(P<0.05);oe-NC组和si-NC组细胞凋亡比较,差异无统计学意义(P>0.05)。见图6。

注:A为流式细胞术检测各组细胞凋亡流式率,B为各组细胞凋亡率统计图;(1)与oe-NC组比较,P<0.05;(2)与si-NC组比较,P<0.05。
2.7 PCNA、Bcl-2和Bax mRNA表达
为研究NR4A2是如何影响乳腺癌细胞发生发展的,本研究通过qRT-PCR检测增殖相关因子PCNA及凋亡相关因子Bcl-2和BaxmRNA的表达,结果显示(图7),与oe-NC组比较,oe-NR4A2组细胞的PCNA、Bcl-2 mRNA表达水平降低,BaxmRNA表达水平升高,差异有统计学意义(P<0.05)。与si-NC组比较,si-NR4A2组PCNA、Bcl-2 mRNA表达水平上升,BaxmRNA表达水平下调,差异有统计学意义(P<0.05)。oe-NC组、si-NC组细胞PCNA、Bcl-2和BaxmRNA表达比较,差异无统计学意义(P>0.05)。
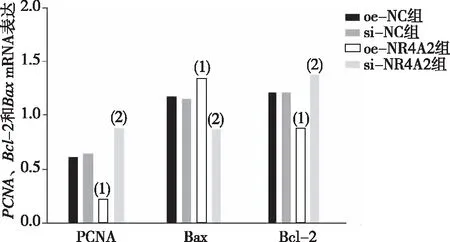
注:(1)与oe-NC组比较,P<0.05;(2)与si-NC组比较,P<0.05。
2.8 PCNA、Bcl-2和Bax蛋白表达
与oe-NC组比较,si-NC组各基因表达比较,差异无统计学意义(P> 0.05)。与oe-NC组比较,oe-NR4A2组细胞PCNA、Bcl-2蛋白表达水平明显减少,Bax蛋白表达水平上升,差异有统计学意义(P<0.05)。与si-NC组比较,si-NR4A2组PCNA、Bcl-2蛋白表达水平上调,Bax蛋白表达水平下调,差异有统计学意义(P<0.05)。见图8。
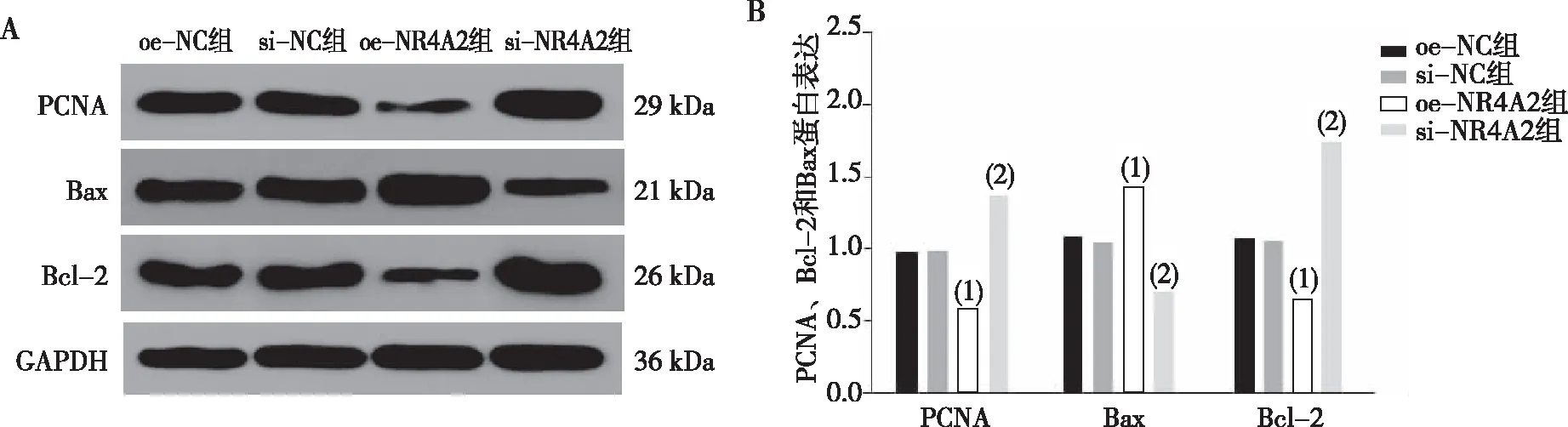
注:A为各组细胞PCNA、Bcl-2和Bax的蛋白条带图,B为各组细胞PCNA、Bcl-2和Bax的蛋白表达统计图;(1)与oe-NC组比较,P<0.05;(2)与si-NC组比较,P<0.05。
3 讨论
既往研究报道,早期乳腺癌干预更有利于提高患者生存率[20]。同时,了解乳腺癌发生机制有助于制定有效防治策略[21]。然而,验证已识别基因及其分子机制以供临床应用有待进一步研究。乳腺癌中已发现数个小异常代谢途径、潜在生物标志物和药物靶基因,但其具体分子网络尚未清晰[22-25]。核受体是积极参与人类生理学和病理学进程的转录因子,可调节下游分子事件并调节复杂基因调控网络[26]。核受体是一类高度保守的配体依赖性转录因子家族,后者可调控正常人体组织和肿瘤组织的许多关键过程[27]。大多数成员受经典配体激素调节,但孤核受体是没有配体或尚未发现配体的核受体[28]。数十种孤核受体广泛分布于机体各组织,在胚胎发育、新陈代谢和昼夜节律调节中起着关键作用[29]。因此,选择性孤核受体调节剂的筛选和开发在肿瘤治疗中具有重要临床意义[30]。
恶性肿瘤以不受控制的肿瘤生长、侵袭性和转移为特征,且涉及多种突变事件,包括转录因子。在本研究中,过表达NR4A2可抑制细胞增殖和集落形成,促进细胞凋亡,同时PCNA和Bcl-2表达明显减少,Bax表达上升;而对NR4A2表达进行干扰后,细胞增殖和集落形成均显著活跃,细胞凋亡被抑制,同时PCNA和Bcl-2表达明显增加,Bax表达下调。提示NR4A2可能通过改变癌细胞增殖相关抗原蛋白和凋亡相关蛋白表达从而对乳腺癌细胞增殖和凋亡发挥作用。因此,本研究揭示NR4A2在乳腺癌中具有一定抑癌作用。本研究推测NR4A2过表达可抑制MCF-7乳腺癌细胞系增殖和集落形成,并促进其凋亡;反向干扰NR4A2进一步双向证实本研究结论。
通过本课题,本研究推测NR4A2对MCF-7乳腺癌细胞系增殖、凋亡、集落形成能力的影响,并认为NR4A2对乳腺癌具有一定抑制作用。NR4A2对乳腺癌的影响机制与其调节其细胞增殖和凋亡,并影响相关蛋白的表达相关。NR4A2有可能是治疗乳腺癌的潜在分子靶标,未来进一步探讨NR4A2分子机制具有重要有意义。然而截至目前,本研究尚未能明确NR4A2对乳腺癌细胞调控的具体分子机制。未来尚基于更多分子技术和手段,以确定NR4A2下游结合蛋白或直接调控分子。
