千里光石油醚提取物舒张气道平滑肌的作用机制研究
2022-01-21彭勇波杨卉卉
彭勇波,杨卉卉
(中南民族大学 生命科学学院&医学生物研究所&武陵山区特色资源植物种质保护与利用湖北重点实验室,武汉 430074)
哮喘是一种多因素参与的气道慢性炎症性疾 病,其生理特征包括气道高反应性、气道平滑肌对吸入刺激物(如胆碱能激动剂或组胺)反应而收缩等[1-2].在临床上,患者常出现复杂多变的可逆性气流限制,导致喘息、咳嗽、胸闷和呼吸急促等症状的反复发作,严重时可因短时间内的气短危及生命[3].而目前使用的可舒张气管药物价格昂贵,且长期使用的副作用明显[4].因此,开发高疗效、耐药性低、价格低廉的气管扩张剂成为了迫切需求.
千里光(Senecio scandensBuch-Ham.)为菊科草本植物,在我国主要分布于华东、中南及西南各地,多生于丘陵山地的灌丛草丛和路边等.该药性寒,味苦,全草可入药,是传统的民间中药.千里光原料易得,不仅价格低廉且富含挥发油类、黄酮类、酚酸类、生物碱类等生物活性物质,化学成分复杂而多样.相关研究发现,千里光具有抗氧化、保肝、抗肿瘤等药理作用;临床上,千里光被广泛用于眼部炎症、湿疹、呼吸道感染等疾病的治疗[5].而在以往的研究中发现千里光具有平喘祛痰作用,其所含的槲皮素[6]、芦丁[7]和金丝桃苷[8]等活性成分也被证明具有肌肉松弛效应,因此对千里光舒张气管平滑肌的研究具有一定的药理基础.本文通过乙酰胆碱(ACh)和高浓度K+溶液(高钾)刺激离体小鼠支气管模拟哮喘的气道收缩,研究了千里光石油醚提取物(PEESS)对气道平滑肌的舒张作用及相关的生理学机制,为进一步开发千里光药理作用及作为支气管扩张剂研究提供科学依据.
1 材料与方法
1.1 试剂和仪器
雄性6周龄Balb/c小鼠,SPF级,购于湖北省疾病预防控制中心,动物合格证号:SYXK(鄂)2016-0089.小鼠饲养在中南民族大学实验动物管理中心,实验严格按照国际实验动物使用与福利相关规定.
千里光干燥全草(北京同仁堂药房);乙酰胆碱(Ach)、Nifedipine、Pyr3、木瓜蛋白酶、胶原蛋白酶、牛血清蛋白BSA、二硫苏糖醇DTT(美国Sigma).生理盐溶液(2 mmol·L-1Ca2+PSS)、无Ca2+PSS溶液(0 Ca2+PSS)参考文献[9]配制.
HV-4离体组织器官恒温灌流系统、BL-420S生物机能实验系统(成都泰盟科技);张力换能器(JH-2,航天医学工程研究所);中草药粉碎机(FW135,天津市泰斯特仪器);体视显微镜(SZM,武汉爱斯佩科学仪器);旋转蒸发器(RE3000A,上海亚荣生化仪器);真空干燥箱(DZ-1 AII,上海精密仪器);震荡切片机(VT1000S型,Leica);小鼠肺功能仪(Flexivent FV-FX4).
1.2 千里光石油醚提取物的制备
千里光干燥全草粉碎,取500 g加入5 L 70%乙醇浸泡3 d,再经过旋转蒸发仪回流获得提取液,多次回流得到100 mL浓缩液后,再用石油醚反复萃取,通过浓缩获得千里光石油醚部膏状物,干燥备用.
1.3 气管收缩/舒张值的测量
将小鼠断颈法处死,失血后迅速取下整个气管,然后转移至冷(4℃)的PSS溶液中,再将气管切成3~5 mm的环,去掉气管周围多余的组织.然后将气管环安装在三角形的钩中,并浸入连续充满气体(95%O2和5%CO2)的6 mL PSS(37℃)浴中.使用高钾或ACh激活气管功能,通过多通道生物机能实验系统测量气管环的等轴张力.
1.4 急性气管平滑肌细胞的分离
获得小鼠气管后,从气管上的肌条分离出平滑肌细胞.首先,将小鼠气管周围的组织去掉,将获得的肌条组织切成2~3 mm3的小块,置于37℃的2 mg·mL-1木瓜蛋白酶中消化20~25 min,然后转移到37℃的1 mg·mL-1胶原蛋白酶中7~10 min,最后将其替换为37℃的1 mg·mL-1BSA溶液,再用指尖弹击溶液使细胞从组织片段上解离,即获得急性分离的小鼠平滑肌细胞.
1.5 钙离子成像
获得急性分离的平滑肌细胞后,混入含有5 μmol·L-1Fura-2 AM染料的PSS中,于平皿上避光染色约20 min,使用PSS溶液灌流5 min后,打开钙离子成像系统记录荧光信号,数据可转化为Excel格式导出.
1.6 离体肺部支气管切片的获取
断颈法处死小鼠后,解剖使气管及肺部暴露,灌入低溶解度琼脂糖,再剪下整个肺部放入充满预冷PSS溶液的样品槽,固定肺部,打开切片系统获取含有小孔的薄肺片,然后转移肺片置于含有DMEM培养基的六孔板中,最后放置于37℃、5%CO2的培养箱中培养至琼脂糖胶完全溶解,即可用于实验.
1.7 肺部气道阻力Rrs的测量
获取小鼠体重后,使用1%戊巴比妥钠并按照1 mL/100 g体重的剂量麻醉小鼠.打开Flexivent仪器和软件后,将已麻醉好的小鼠气管暴露,使雾化器管道接口连通气管,依次按照系统提示,采用雾化程序进行给药,再检测和记录中央气道阻力Rrs.待实验结束后,将保存参数Peding设置为Excel格式,即可导出数据分析.
1.8 数据统计
运用Origin8.0处理数据,CorelDRAW X4 SP2、GraphPad Prism 7绘图,采用T-test统计数据.
2 结果与分析
2.1 PEESS可舒张高钾引起的平滑肌收缩
高钾引起的平滑肌收缩已被证实主要与LVDCC通道的开放有关.在本文中,以高钾诱导的预收缩作为标准收缩,测试PEESS对小鼠ASM的松弛作用,结果见图1.由图1(a)、图1(b)、图1(c)可知:PEESS可呈浓度依赖性地舒张高钾诱导的气管环收缩,这种舒张效应与媒介物PSS无相关性,当添加1.26 mg·mL-1的千里光石油醚提取物时,最大舒张率达到(102.17±4.31)%.已知Nifedipine是LVDCC的选择性抑制剂,而10 μmol·L-1Nifedipine也可短时间内彻底舒张掉高钾诱导的气管收缩[图1(d)],因此推测PEESS对气管环的舒张作用可能与Nifedipine的作用机理类似.
2.2 PEESS可阻止高钾诱导的Ca2+内流
为进一步证实PEESS对高钾诱导的平滑肌舒张作用与LVDCC有关,比较了在不同钙浓度条件下,PEESS对气管平滑肌的舒张作用,结果见图2.由图2(a)、图2(b)知:高钾可对ASMCs引发迅速的Ca2+内流,而随后加入的PEESS可显著性阻断这种Ca2+内流(P<0.01).图2(c)、图2(d)演示了在离体组织水平,无外Ca2+的条件下,由于未发生Ca2+内流,高钾不会引起气管环收缩,但是当细胞外Ca2+浓度恢复到2 mmol·L-1时,气管环立即收缩,而PEESS在Ca2+浓度转变后能阻断气管环收缩.由此可见无论细胞水平还是在离体组织水平上,PEESS对气管环的舒张都是通过阻断Ca2+内流而发挥作用.如果预先添加PEESS,无论是在0 mmol·L-1或2 mmol·L-1Ca2+条件下,高钾都不能引起气管环的收缩[图1(e)].上述实验进一步说明了PEESS松弛高钾诱导的气管收缩是阻断了Ca2+内流而发挥作用的.
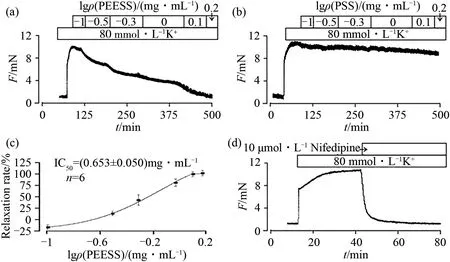
图1 PEESS和Nifedipine对高钾引起的小鼠气管收缩的舒张作用Fig.1 Relaxation effect of PEESS and Nifedepine on the tracheal contraction induced by high K+in mice

图2 PEESS对高钾诱导的Ca2+内流的抑制作用Fig.2 Inhibitory effect of PEESS on Ca2+influx induced by high K+
2.3 PEESS可舒张ACh引起的平滑肌收缩
乙酰胆碱是另一能诱导气道收缩的重要因素之一,且能引起更广泛的离子通道活性.本文利用100 μmol·L-1ACh诱导离体小鼠气管环的收缩来模拟体内的平滑肌收缩,以评估在生理条件下,PEESS对气管平滑肌的可能性影响,结果见图3.图3(a)、图3(b)中PEESS浓度依赖性地舒张ACh引起的气管平滑肌收缩,当浓度为0.794 mg·mL-1时,最大舒张率达到(102.5±3.33)%.已知LVDCC和NSCCs参与由ACh诱导的气道平滑肌收缩,而实验2.1已证实PEESS能阻断LVDCC通道,所以当加入LVDCC阻断剂Nifedipine后,可舒张一部分(22±5.62)%,而后再加入PEESS能完全舒张ACh引起的气管环预收缩,表明PEESS对气道平滑肌的舒张作用还有可能是阻断了其他离子通道.
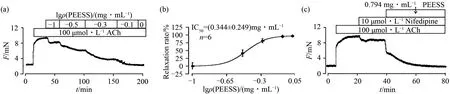
图3 PEESS对ACh引起的小鼠气管收缩的舒张作用Fig.3 Relaxation effect of PEESS on the tracheal contraction induced by ACh in mice
2.4 LVDCC和NSCCs途径对ACh诱导ASM收缩的影响与Ca2+有关
ACh可同时激活多种离子通道,其中包括LVDCC和NSCCs.为判断LVDCC和NSCCs介导的Ca2+运输是否参与ACh诱导的ASM收缩,分别在细胞水平和离体组织水平上进行实验,预先添加LVDCC阻断剂Nifedipine,研究除LVDCC以外的离子通 道,结果 见 图4.由图4(a)、图4(b)知:在ASMCs水平上,加入的ACh可迅速引起Ca2+内流,待离子浓度平衡后,加入的PEESS可显著性阻止这种Ca2+内流(P<0.01,n=50).而图4(c)则在离体组织水平证明了ACh所引起的支气管收缩与Ca2+浓度有关,在无钙离子的环境下,由于肌浆网Ca2+释放,只能诱导低水平的收缩,而加入2 mmol·L-1Ca2+后,气管环便迅速收缩,但同样也被后续加入的PEESS所舒张.在图4(d)中,预先添加PEESS,在Ca2+浓度转变的环境中,ACh的影响不再明显,且随后就被PEESS完全抑制.图4(a)~(d)同时表明ACh对气管平滑肌的影响需要Ca2+的调节,而PEESS可阻断这种Ca2+参与.
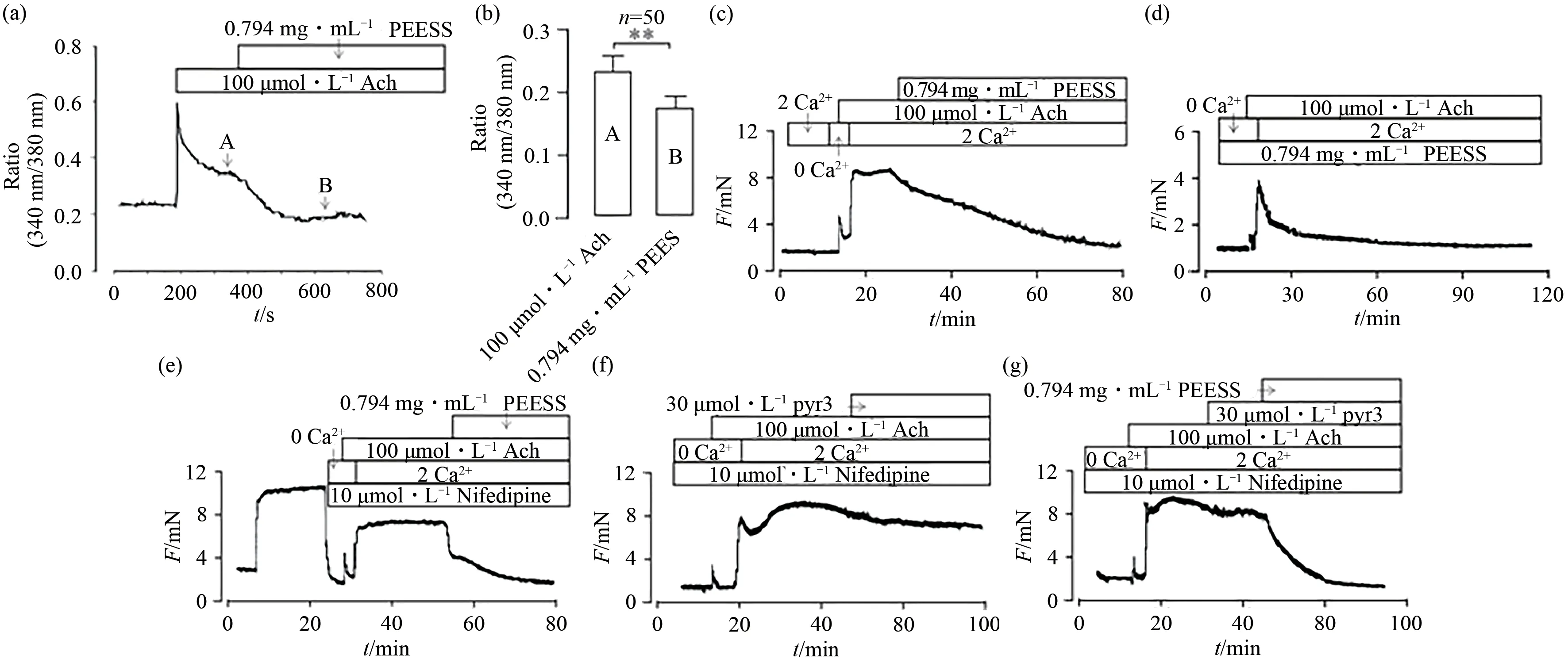
图4 PEESS对ACh诱导的Ca2+内流的阻止作用Fig.4 Inhibitory effect of PEESS on Ca2+influx induced by ACh
为探究ACh诱导的ASM收缩中钙离子相关的离子通道,图4(e)、图4(f)、图4(g)预先添加了Nifedipine阻断LVDCC的影响.瞬时受体电位通道(TRPC)已被证明是NSCCs的编码分子,其中TRPC3是气道平滑肌细胞上主要的天然固有活性NSCCs,在实验中加入TRPC3拮抗剂Pyr3,发现此时也能部分舒张ASM,这表明TRPC3编码的NSCCs通道也参与了ACh诱导的ASM收缩,但仍有一部分需要加入PEESS才能舒张完全,由此推测,PEESS有可能还阻断了由非TRPC3编码的其他NSCCs通道介导的Ca2+内流.
2.5 PEESS对相关钙离子通道的阻断作用并非药物毒性的影响
为阐明PEESS对气管环的可能有害作用,研究了PEESS对气管环收缩活性的影响,结果见图5.如图5所示,当PEESS完全舒张由激动剂引起的气管平滑肌收缩后,重复3次洗去ACh和PEESS,再次加入ACh后,气管环的收缩能恢复到控制水平,说明PEESS对气管环的活性影响及阻断相关钙离子通道的作用,非药物有害所致.
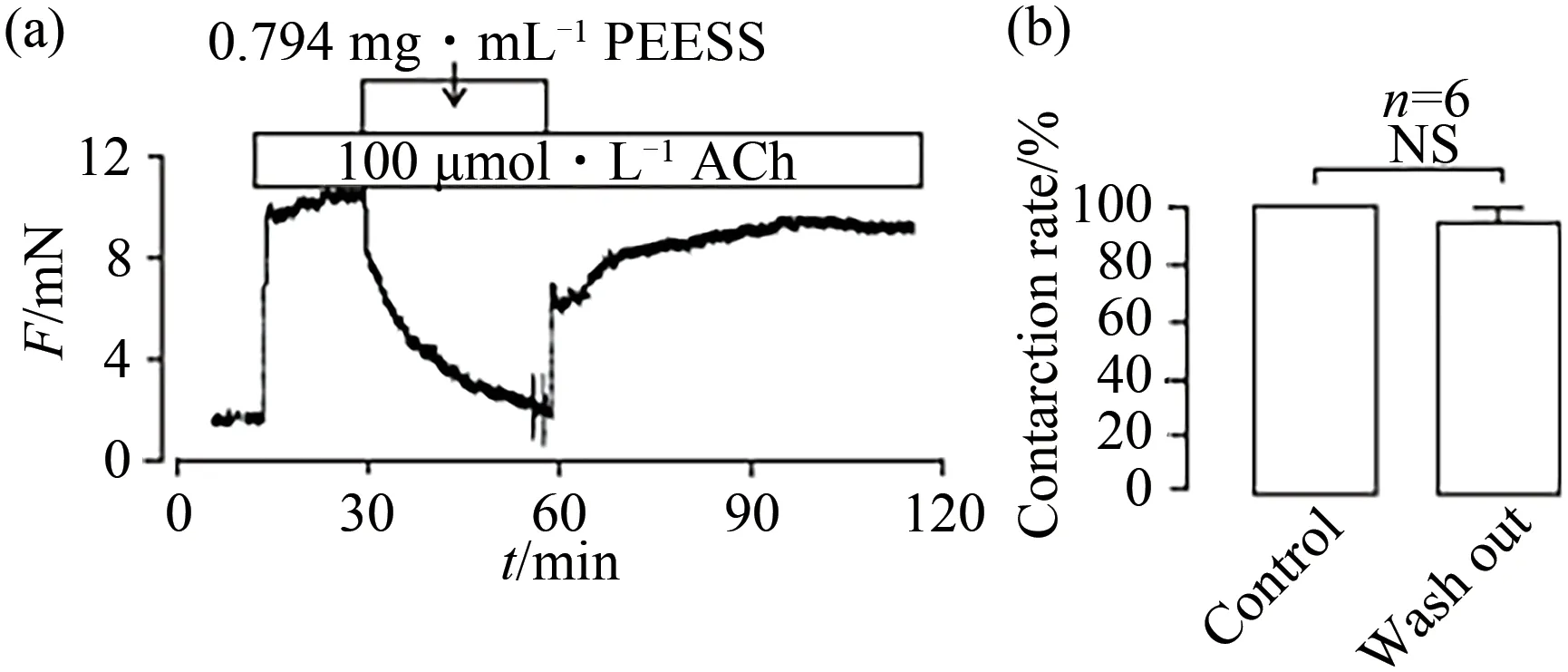
图5 PEESS对ACh诱导的ASM舒张的组织毒性Fig.5 Tissue toxicity of PEESS on ASM relaxation induced by Ach
2.6 PEESS在离体肺内气管水平舒张ASM的作用
哮喘的病理症状常伴随支气管和肺部结构的改变,为了进一步阐述PEESS对肺气管水平的影响,本文采用100 μmol·L-1ACh来引起肺气管张力的增加,再加入0.794 mg·mL-1PEESS,通过激光共聚焦显微镜观察肺气管面积的变化,结果见图6.如图6(a)所示:100 μmol·L-1ACh的加入能引发肺部支气管的收缩,而当加入0.794 mg·mL-1PEESS后,其面积几乎能回到初始值.图6(b)为实验的统计,表明100 μmol·L-1ACh的加入,能显著增加肺支气管张力(P<0.01),而0.794 mg·mL-1PEESS的加入,可完全抑制这一过程(P<0.01).
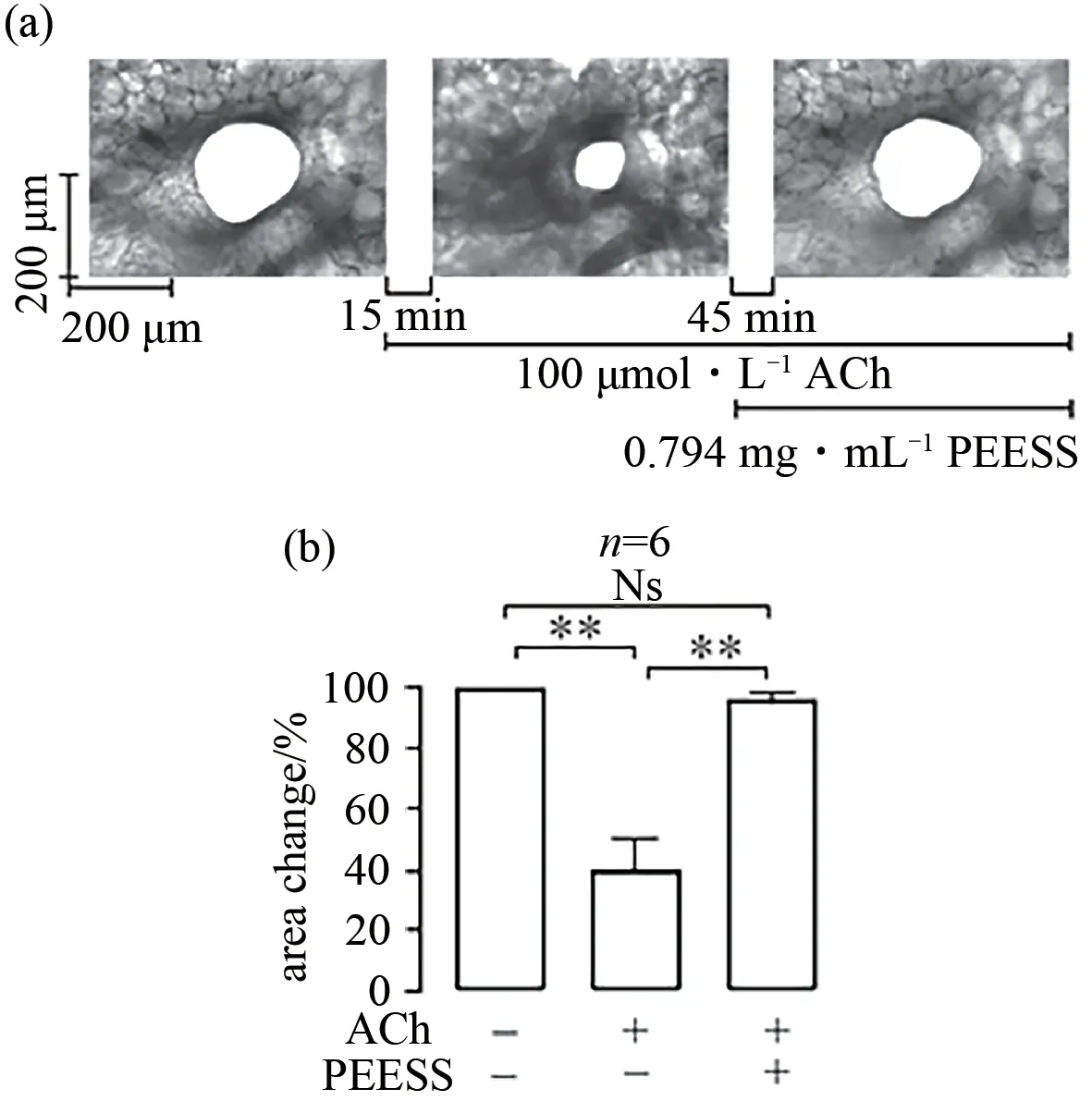
图6 PEESS对肺部支气管和气管平滑肌张力的影响Fig.6 Effects of PEESS on lung bronchus and airway smooth muscle tone
2.7 PEESS能降低小鼠的呼吸系统阻力
为了研究PEESS对体内ASM的松弛作用,采用强制振荡技术记录了Rrs的变化.以一定的ACh剂量(3.125、6.25、12.5、25、50 mg·mL-1)诱导了小鼠Rrs的增加,小鼠Rrs逐级上升且具有明显的剂量依赖性,再加入含有同等梯度ACh剂量的3.97 mg·mL-1PEESS来研究其对小鼠呼吸系统阻力的影响,结果显示3.97 mg·mL-1PEESS能显著抑制由ACh引发的小鼠肺部Rrs的升高(*P<0.05,**P<0.01).
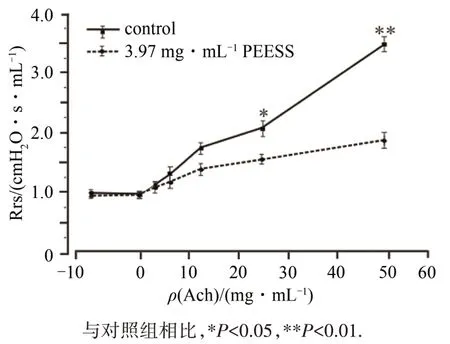
图7 PEESS降低ACh诱发的呼吸系统阻力Fig.7 PEESS reduces ACh-induced respiratory resistance
3 讨论
哮喘是一种以气道平滑肌异常收缩为主要病理特征之一的呼吸系统疾病,在过敏原的刺激下,哮喘患者会表现出严重的气道收缩、呼吸困难等,这些生理病理特征都与ASM的参与有关[9].现已知众多信号转导途径都参与气道平滑肌的收缩,而几乎所有这些途径都与Ca2+有关[10,11].气管的收缩装置由肌球蛋白、肌动蛋白丝以及辅助蛋白、调节蛋白组成.而此收缩装置在ASM中的激活,可以通过激动剂诱导Ca2+释放引发[12].因此,Ca2+对气道收缩的调控至关重要.
据报道,高浓度钾离子溶液是通过改变K+平衡电位以激活LVDCC通道,然后通过增加胞浆中Ca2+的浓度引起平滑肌收缩[13].而乙酰胆碱(ACh)主要通过结合并激活毒蕈碱受体(MR)发挥其生物学影响,在气道平滑肌细胞中能同时激活内质网RyR、IP3受体和细胞膜上一系列G蛋白偶联受体,使胞内Ca2+浓度发生震荡,刺激多种离子通道的开放,最终产生肌肉收缩反应[14].
本文发现:PEESS能完全舒张高钾和ACh引起的ASM收 缩,并 以LVDCC阻 断 剂Nifedipine和TRPC3选择性阻断剂Pyr3作为对照,表明了PEESS可阻断LVDCC通道和部分NSCCs通道.已有实验证实了Nifedipine与Pyr3可部分抑制ACh在气道平滑肌细胞上诱导的LVDCC与NSCCs电流[15],这与本文的结果类似.
为探究PEESS是以何种机制阻断这两种离子通道,先通过钙离子成像系统发现PEESS可抑制ACh与高钾引起的ASMCs Ca2+内流.随后改变离体气管外环境的钙离子浓度,发现只有适当Ca2+溶度才可诱导收缩,但同时这种收缩也迅速被PEESS抑制.如果预先添加PEESS,则改变钙离子浓度也无法引起收缩.说明PEESS是通过抑制Ca2+内流而阻断LVDCC及NSCCs通道的.这与千里光含有的槲皮素、金丝桃苷等活性成分对钙离子的调控及对肌肉的松弛作用一致[6,8].
为进一步验证PEESS对ACh诱导ASM收缩后的舒张作用,利用肺组织切片技术,发现PEESS同样可显著性舒张肺气管.利用小鼠肺功能仪,发现在活体小鼠中,PEESS也可显著性降低由ACh引起的肺部气道阻力Rrs.
综上可知:PEESS通过抑制LVDCC与NSCCs通道,抑制胞外Ca2+内流,从而舒张小鼠气管平滑肌.本文首次证明千里光对于舒张气管的药理作用,可作为潜在的哮喘扩张剂用于哮喘的预防和治疗.
