内镜下黏膜切除术治疗胃肠息肉的临床效果探讨
2022-01-20何张平沈洁刘元辉陈光炳
何张平 沈洁 刘元辉 陈光炳
胃肠息肉属于消化系统基本常见疾病的类型之一,是因消化道黏膜层局限性隆起增生,形成乳头样病变组织。在疾病初期无特异性症状表现,随着疾病持续进展,逐渐出现消化道出血、腹痛等症状,发生癌变风险较高,故需及时开展治疗。内镜下电凝切除术是胃肠息肉临床治疗常用手段,但治疗中难以把握切除深度,往往导致病灶切除不完全或造成消化道穿孔等,该术式对术者操作及临床经验要求较高,术者操作水平直接决定了息肉治疗效果[1]。近年来,内镜下黏膜切除术以安全、微创、方便易行等明显优势在胃肠道息肉疾病治疗中广泛推广,其为黏膜注射治疗和电凝切除治疗的有机结合,优势突出,损伤小、出血少,疼痛轻,有利于术后早期恢复,同时并发症风险相对低,是一种有效性及安全性兼顾的治疗手段[2]。本研究以胃肠息肉100例为研究对象,观察内镜下黏膜切除术的临床效果及并发症,总结如下:
1 资料与方法
1.1 一般资料
遴选时段2019年6月—2020年6月内胃肠息肉100例,开展回顾性分析,参考“数字双盲法”分两组,研究组、对照组。对照组50例:由男27例、女23例组成,年龄线低至25岁、高至78岁,平均年龄(55.52±5.24)岁;息肉位置:肠道26例、胃部24例;病例类型:炎症性息肉24例、管状腺瘤16例、增生性息肉4例、绒毛管状腺瘤6例。研究组50例:由男29例、女21例组成,年龄线低至30岁、高至78岁,平均年龄(54.78±5.58)岁;息肉位置:肠道28例、胃部22例;病例类型:炎症性息肉25例、管状腺瘤16例、增生性息肉3例、绒毛管状腺瘤6例。两组样本基线资料基本一致,差异无统计学意义(P>0.05)。
纳入标准:(1)经内镜确诊为胃肠道息肉;(2)具备明确手内镜下术治疗指征;(3)息肉直径大小5~22 mm;(4)未发现认知缺陷及精神障碍问题,对治疗及检查高度配合;(5)生命体征稳定,凝血机制无异常。
排除标准:(1)既往曾接受内镜下黏膜切除治疗者;(2)经检查后显示黏膜明显浸润;(3)内镜检查明显禁忌者;(4)机体凝血机制障碍;(5)发现心肺等重大脏器严重病变;(6)存在认知缺陷、精神障碍问题;(7)心血管系统严重疾病;(8)病历资料不真实不可靠,或中途失联未能继续。
1.2 方法
术前患者进行结肠镜检查、胃镜检查,检查凝血功能、血尿常规、心电图等,排除治疗禁忌证。提前告知患者手术流程及相关注意事项,做好手术准备。
对照组(普通内镜电凝切除术):利用电子结肠镜探查息肉明确具体位置,于距离息肉边界2 mm处利用高频电刀进行切除,切除时尽量至黏膜上层不可累及基层,完全切除息肉后创面给予电凝止血。
研究组(内镜下黏膜切除术):选用胃肠镜探查息肉明确具体位置,在息肉基底部选取4个点作为注射点,沿着位点注入1:10 000肾上腺素或者0.9%氯化钠注射液,注射时针尖至黏膜下层为准,注射至息肉基底部完全隆起,然后拔出针头,确保黏膜与肌层完全分离,然后利用圈套器将息肉基底套住,收紧并通电,息肉组织用高频电流完全切除,上肽夹预防出血,如果息肉体积直径过大可分多次充分切除,观察创面有无出血情况,及时止血,若创面渗血量少,喷洒0.8%去甲肾上腺素,若创面出血严重,利用肽夹夹闭。息肉切除组织送检,手术完成后抽出胃肠内气体。注意观察患者有腹痛、腹胀、便血等情况。
1.3 观察指标
对两组手术相关指标统计并对比:手术用时、术中出血量、住院时间、息肉切除时间、术后进食时间。
息肉切除情况:观察并记录息肉完整切除率(病变息肉完整切除,经病理检查显示病变未累及切除部位基底和外侧外界)、整块切除率(镜下观察息肉整块切除,得到一个标本)。
炎症因子水平:取所有对象空腹静脉血,开展离心操作,分离血清,采取酶联免疫吸附法测定降钙素原(procalcitonin,PCT)、C反应蛋白(C-reactive protein ,CRP)、白介素-6(interleukin-6,IL-6)、白介素-17(interleukin-17,IL-17)[3]。
观察并统计两组患者术后并发症发生情况:分别有术后出血、切口感染、切口过深等情况。
1.4 统计学方法
所有获取文本数据应用SPSS 24.0统计分析软件,计量资料涉及手术相关指标、炎症因子指标以(±s)表示,开展t检验;计数资料主要涉及息肉完整或整块切除率、术后并发症率以例(%)表示,开展χ2检验。P<0.05表示差异有统计学意义。
2 结果
2.1 手术相关指标
研究组手术用时、术中出血量、住院时间、息肉切除时间、术后进食时间相较对照组均更优(P<0.05)。详见表1。
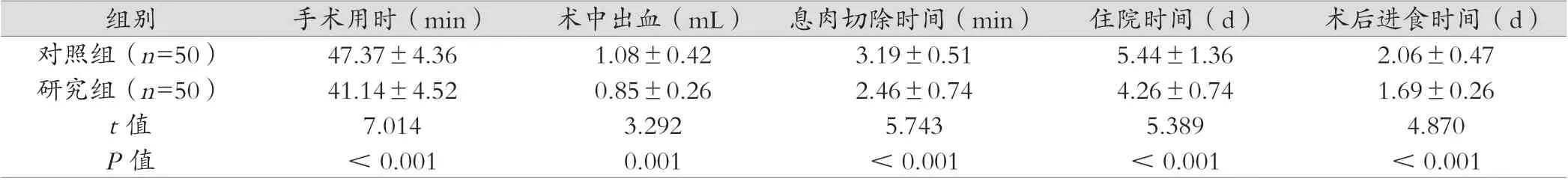
表1 手术相关指标对比(x- ±s)
2.2 息肉切除情况
两组息肉切除情况比较,研究组完整切除率、整块切除率均更高(P<0.05)。详见表2。

表2 息肉切除情况对比[例(%)]
2.3 炎症因子水平
治疗前两组炎症因子水平比较差异无统计学意义(P>0.05),治疗后两组炎症因子指标(PCT、hs-CRP、IL-6、IL-17)均大幅度升高,但研究组相比对照组以上指标均更低(P<0.05)。详见表3。

表3 炎症因子水平比较(x- ±s)
2.4 并发症率
研究组并发症率低,较之对照组(P<0.05)。详见表4。

表4 并发症率效对比[例(%)]
3 讨论
胃肠息肉多见于中老年群体,属于癌前病变的一种,直肠、胃窦、结肠、胃体为常见发病部位。数据统计,在我国胃肠息肉发病率2.5%~3.0%左右,肠息肉发病率占5.4%左右,且随着年龄的增加其发病率明显升高[4]。疾病初期无特异性表现,较为隐匿,后期疾病进展下会出现消化道出血,癌变几率较高,是胃癌、肠癌发生的重要危险因素。因此对胃肠息肉早期诊断发现、及时开展治疗对预防癌前病变、提高患者预后具有积极的临床意义。
近年来,临床内镜技术不断发展及完善,人们的健康查体意识逐渐增强,内镜技术在胃肠息肉诊疗中得到广泛应用,胃肠息肉检出率也明显升高。研究资料指出,胃肠息肉与肿瘤存在密切联系,特别是消化道无蒂息肉(息肉直径5 mm~2 cm)相较有蒂息肉发生癌变风险更高,通常腺瘤性息肉约10~15年可进展为消化道恶性肿瘤,因此对息肉病变应及早发现、早期及时干预治疗,对控制消化道肿瘤发生几率发挥重要作用。无蒂息肉病灶较深,且基底广,故在切除病灶时很容易造成穿孔、出血等情况,较有蒂息肉切除整体难度大[5]。
以往对胃肠息肉临床治疗多采取内镜下电凝切术,操作便捷,易掌握,但术中行息肉切除时无相应的辅助视觉工具,故无法掌控切除深度,而切除时过浅,会导致息肉切除不完整、不彻底,后期复发风险高,切除时过深,可能会出现消化道穿孔。内镜下黏膜切除术是一种微创治疗手段,最早于1973年Deyhle报道中对直肠无蒂息肉注射适量生理盐水切除,发现手术并发症率低,而大量研究报道中证实,较传统电凝切除术实施内镜下黏膜切除术更为安全可靠,疗效显著,住院时间短,易于临床推广[6]。现今,内镜下黏膜切除方法有3种,为透明帽辅助切除、注射黏膜切除、注射分段黏膜切除,需根据患者实际情况合理选择[7]。透明帽辅助切除是在内镜前端放置透明帽,对准黏膜在病变的一侧负压吸引,将病变组织吸入透明帽后再切除,但吸引时息肉基底固有组织容易被吸入透明帽中,进而引发胃肠黏膜穿孔或者深部组织损伤。注射分段黏膜切除对较大病变组织适用,但易发生出血情况,而对于直径小于2 cm的无蒂息肉出血几率高达13.5%[8]。本次研究中根据胃肠息肉大小主要选用注射黏膜切除,通过胃肠黏膜下注射药物使息肉组织隆起,将息肉黏膜肌层与黏膜层相分离,再利用圈套器切除组织。同时内镜下黏膜切除为术者提供清晰的手术视野,明确观察病灶范围,圈套器的使用可避免切除时损伤黏膜肌层同时完整切除病灶[9]。
本次研究结果:两组息肉切除情况比较,研究组完整切除率、整块切除率均更高,同时手术用时、术中出血量、住院时间、息肉切除时间、术后进食时间相较对照组均更优(P<0.05)。证实,内镜下黏膜切除术治疗效果明显优于普通内镜电凝切除术。实施内镜下黏膜切除术将药物注入黏膜下促使病灶隆起,以便于病灶完整切除,同时由于电凝切除时无法掌控切除深度,易造成消化道出血或穿孔,从而造成电凝切除术手术时间及息肉切除时间延长,术中出血量增加[10]。
内镜下治疗胃肠息肉易造成胃肠道黏膜损伤,大量炎性因子在内部组织聚集,相关信号传导通路被激活,炎症因子在血液中释放,从而致使患者机体炎症反应明显升高[11]。本次研究:治疗前2组炎症因子水平比较无统计学差异(P>0.05),治疗后2组炎症因子指标(PCT、hs-CRP、IL-6、IL-17)均大幅度升高,但研究组相比照组以上指标均更低(P<0.05)。由此证实,开展内镜下黏膜切除术相较内镜电凝切除术术,减轻胃肠道黏膜的损伤,故机体炎症反应相对轻。
两组术后并发症情况比较:研究组并发症率低,较之对照组(P<0.05)。开展电凝切除术在息肉切除时深度掌握有一定难度,导致息肉残留或消化道穿孔,故相较而言内镜下黏膜切除术并发症风险更低,安全性高。内镜下黏膜切除术开展过程中术野清晰,术者可对病灶情况清晰观察,及时发现术中出血并有效止血,这也是患者术后并发症几率小的一大因素[12]。此外,电凝切除术长时间电凝容易损伤黏膜下血管,细胞组织灼烧伤变形坏死,坏死逐步扩大引起出血或发生切口感染。
综上,对胃肠息肉患者治疗内镜下黏膜切除术是一种安全可行的治疗手段,在手术创伤、操作方法、安全性、术后胃肠功能恢复等方面相较电凝切除术具有明显优势,一次性完整切除率高,炎症反应轻,并发症风险低,更为安全可靠,以便于患者术后早期恢复,故具有大范围推广的价值。
