马铃薯白酒固态酿造中酵母的 种群结构及多样性分析
2022-01-20任妍菱刘军华李家怡邓友胜陈亦然祝艺嘉
◎ 任妍菱,林 巧,吴 兵,刘军华,李家怡,陈 瑶,邓友胜,陈亦然,祝艺嘉
(1.攀西特色作物研究与利用四川省重点实验室,四川 西昌 615000;2.凉山州天美益农业科技有限公司,四川 西昌 615000)
马铃薯也被叫作荷兰薯、洋芋等,是我国重要农作物之一,营养丰富,富含维生素、淀粉、蛋白质等,所以又把马铃薯叫作“地下苹果”与“第二面包”[1]。马铃薯的糊化性很好,可以作为原材料酿造白酒。凉山州盛产马铃薯,但由于交通不便,许多马铃薯滞销腐烂,因此本试验中以马铃薯、玉米为原料,酿造出马铃薯白酒,合理开发与利用马铃薯资源的同时,也拓大马铃薯产品的加工市场[2]。
高通量测序是目前真菌多样性研究的主要技术,具有信息量大、重复性好、可靠性高等优点[3]。将高通量测序技术用于马铃薯白酒发酵酒醅中的微生物结构分析中,通过处理测序数据,可以对马铃薯白酒酒醅中发挥主要作用的酵母种类和真菌菌落的组成取得整体性认识,了解马铃薯白酒酒醅中主要微生物在酿造过程中的组成差异,从而为马铃薯白酒发酵工艺的优化提供理论指导。
1 材料与方法
1.1 材料与试剂
马铃薯、玉米、高粱、WL培养基、酒曲、糖化酶、白砂糖和麸皮等。
1.2 仪器与设备
电子天平,上海英衡电子秤有限公司;压力蒸气灭菌器,山东博科生物产业有限公司;超净工作台,无锡一净净化设备有限公司;303电热恒温培养箱,联鲸科技有限公司设备;Illumina HiSeq 2500测序平台试验方法。
1.3 试验方法
1.3.1 工艺流程
马铃薯白酒酿造工艺流程如图1所示。
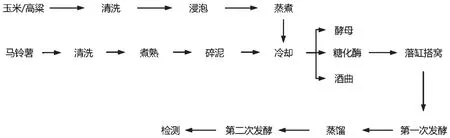
图1 工艺流程图
1.3.2 采样位点
样品来自实验室马铃薯白酒酿造酒醅,共12个采样时间,分别为:第一次发酵第1 d、3 d、5 d、7 d、9 d和11 d(样品分别标号为Fday1、Fday3、Fday5、Fday7、Fday9、Fday11),第二次发酵第1 d、3 d、 5 d、7 d、9 d和11 d样品分别标号为Sday1、Sdays3、 Sday5、Sday7、Sday9、Sday11),采样位置为发酵缸的中上层。
1.3.3 高通量测序分析方法
百迈客生物科技有限公司利用Illumina HiSeq高通量测序平台测序。用检测后的合格的基因组DNA稀释后作为模板,将PCR产物进行纯化和荧光定量,扩增区域为真菌的ITS1区,构建HiSeq文库并进行双端测序,构建小片段文库进行测序。通过对Reads进行拼接,同时对序列质量进行质控和过滤[4],得到优化序列后,进行在线数据分析。
采用Usearch[5]进行可操作分类单元(Operational Taxonomic Units,OTU)聚类分析[6],对于相似性水平≥97%的OTU进行生物信息统计,其中每个OTU代表一个物种。采用朴素贝叶斯分类器对97%相似水平的OTU代表序列进行分类学分析[7],在各个分类水平统计样本群落的组成。利用QIIME2软件计算样本的α多样性,包括Chao1指数、ACE指数、Shannon指数、Simpson指数和Coverage值,以表征真菌群落的丰富度和多样性。采用QIIME软件计算样本β多样性距离矩阵,使用非加权组平均法构建树状结构。
2 结果与分析
2.1 测序数据处理与分析
质量通过Illumina HiSeq高通量测序,12份酒醅样品质构后得到了共获得1015 352对Reads,双端Reads质控、拼接后共产生862350条Clean Reads,每个样品至少产生59122 条Clean Reads,平均产生71863 条Clean Reads。平均长度250~280 bp,按照97%相似性,分别聚成27~50个可操作分类单元(OTUs),见图2。
2.2 酒醅菌群的OTU数图
通常情况下,把相似性>97%的序列分为同一个OTU,每个OTU对应于一种物种。把样品分析聚类后得出各个样品的OTU数图,如图2所示。柱子上面的数字即为相应样品的OTU数目。由图2可知,酵母丰度在整个酒醅发酵期间波动较大,大茬的波动强度明显大于二茬,并且二茬的丰富度明显大于大茬,且在二茬样品11中真菌种类是最多的,说明马铃薯白酒在酿造过程中,其酒醅中的真菌在发酵初期变化趋势较大,后期较为平稳且种类最多。
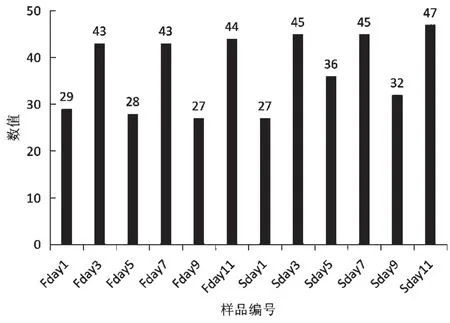
图2 ITS测序的OTU数图
2.3 物种注释及分类学分析
样品的丰度比较低,将低丰度的OUT处理掉后,根据得到的OTU总计出每个样品中各等级能够得到的tags数,再计算出在各分类水平下,物种类型在每个样品中的数目,如表1所示。由表1可知:①在大茬酒醅中的微生物种类随着发酵的进行,有先增多、后减少,到中后期又增加的趋势,但个别样品中的酵母种类数出现异常,可能是在搅拌或取样时,由于操作不当,将环境中的外来微生物也带入其中参与发酵。②在二茬酒醅中的微生物种类先增多后趋于 稳定。
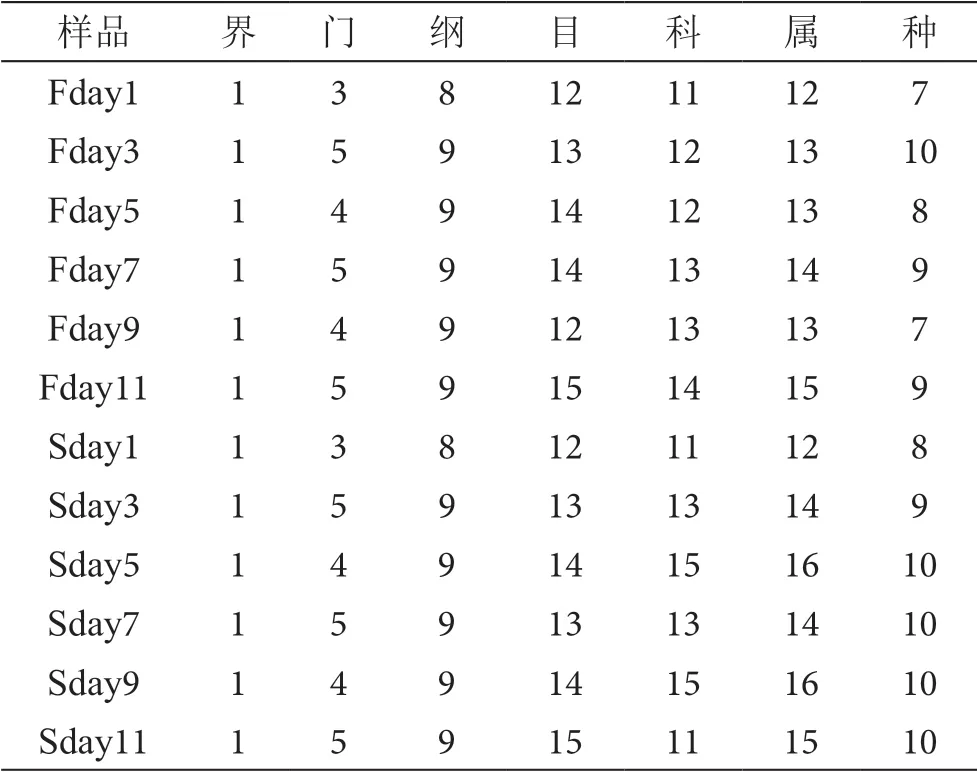
表1 测序的各等级中的物种数表
2.4 马铃薯白酒酒醅测序结果及α多样性分析
通过样本的多样性分析(Alpha多样性)可以反映微生物群落的丰度和多样性[8],Chao1指数是用Chaol算法估计样本中所含OTU数目的指数,Chao1指数和ACE指数可以用来指代菌群的丰度,辛普森(Simpson)指数和香农Shannon)指数都是用来估算样本中微生物多样性的指数。Simpson指数值越大,说明群落多样性越低,Shannon指数值越大,说明群落多样性越高[9]。Coverage是指样本文库的覆盖率,其数值越高,则样本中序列被测出的概率越高,该指数能反映出测序结果是否代表了样本中微生物的真实情况。由表2可知,每个样品的Coverage值均为0.999以上[10],表明测序深度良好,覆盖 率高[11]。
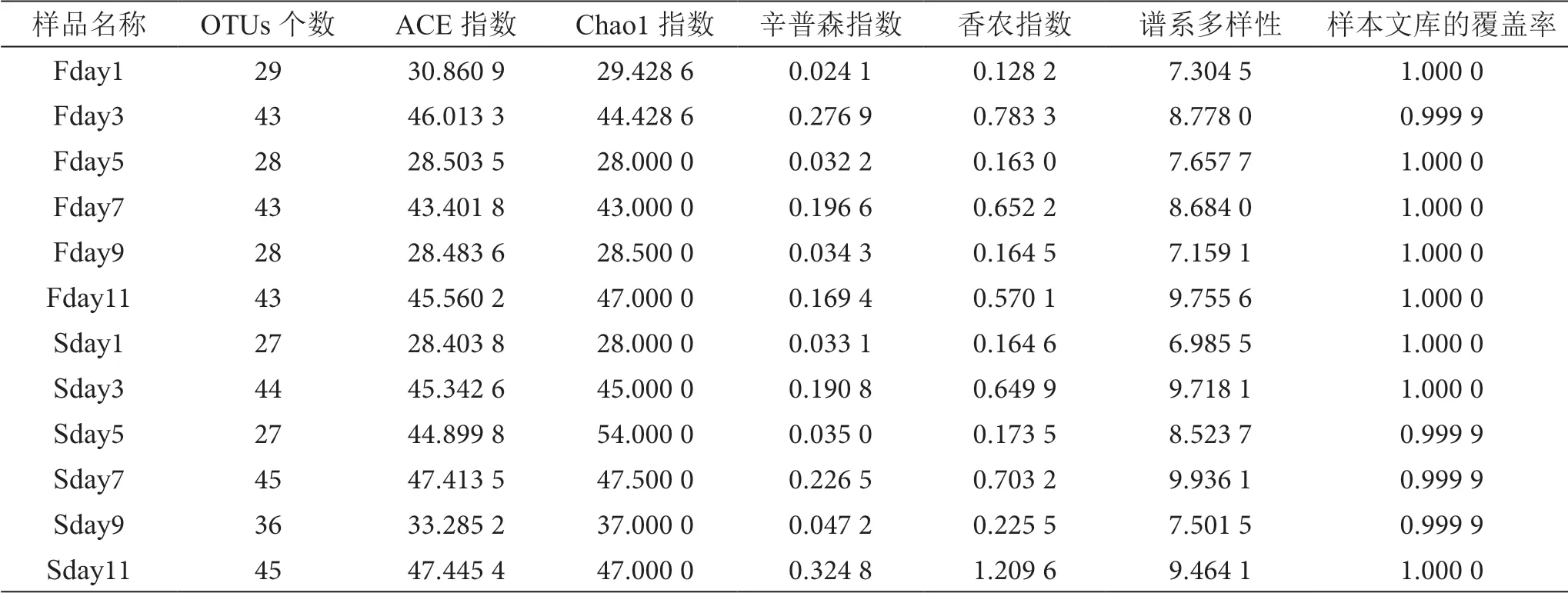
表2 Alpha多样性指数统计表
其中,第一次发酵时的各样品的Chao1指数总体上低于第二次发酵的各样品的Chao1指数,且前者指数变化上下波动较大,说明两次发酵中真菌菌落丰富度存在差异性变化,真菌种类后者高于前者。各样品的Shannon指数表明,在第一次发酵过程中,数值波动较大,真菌的多样性变化不稳定,在第二次发酵过程中,数值波动变化不大,说明真菌的多样性变化趋于平稳,且比对两次发酵,后者的数值除去Sday3以外其他的值均大于前者,说明随着发酵的进行,酒醅中的真菌群落多样性逐渐增高;Simpson指数越大,优势度物种越小,Sday11突增,优势度物种降低。造成这种现象的原因有可能在大茬阶段真菌对环境的适应能力较弱,里面的微生物都在大量繁殖,真菌的变化较为明显,二茬阶段时,真菌群落的丰富度和多样性又有所提高,推测可能是有些真菌逐渐适应了缺氧高酒精的环境,综上所述,大茬和二茬在真菌群落丰富度上度差异较大,且二茬真菌群落多样性远高于大茬。
2.5 酒醅真菌群落在纲、目、科、属、种水平上的组成和相对丰度
纲水平上,除未分类和其他真菌以外,其中Saccharomycetes(酵母纲)占比最高,其次是Eurotiomycetes(散囊菌纲)。在第一次发酵过程中,Eurotiomycetes丰度总体呈下降趋势,在第二次发酵过程,Eurotiomycetes(散囊菌纲)丰度先升高后又降低,且在二茬的末期,除去未分类菌外,Leohumicola(锤苔舌菌)成为第三多的属种。从上述结果可以看出,不同样品真菌的优势纲种类相同,但各优势纲在不同样品中真菌总量的占比并不相同,且发酵末期真菌纲种类增加。
目水平上,除去未分类和其他真菌,其中Saccharomycetes(酵母纲目)占比最高,其次是Eurotiomycetes(散囊菌目)。在第一次发酵过程中,Eurotiomycetes(散囊菌目)丰度总体呈下降趋势,在第二次发酵过程,Eurotiomycetes(散囊菌目)丰度先升高后又降低,其他的真菌占比几乎很小,优势菌依然是Saccharomycetes(酵母目)。
科水平上,12中样品中占比前10的可归类真菌纲依次为Pha☆omycetaceae(法夫酵母科)、Aspergillaceae(曲霉科)、Archaeorhizomycetaceae、Rhizopodaceae、Bolbitiaceae(粪锈伞科)、Cladosporiaceae(枝孢霉科)、Lasiosphaeriaceae(毛球壳科)、Hypocreaceae(肉座菌科)、Didymosphaeriaceae(隔孢球壳科)和Meruliaceae(皱皮菌科)。除去未分类和其他真菌来说,Pha☆omycetaceae(法夫酵母科)相对丰度可以达到82%~99%,占比最高,其次是Aspergillaceae(曲霉科),其他真菌科的占比都较低。
从属水平上看,除去未分类和其他真菌来说,其中Wickerhamomyces(异常威克汉姆酵母)占比最高,其次是Aspergillus(曲霉),而且Aspergillus(曲霉)丰度总体呈下降趋势。在第一次发酵过程中,前期氧气充足,Wickerhamomuces(异常威克汉姆酵母)和Aspergillus(曲霉)都有利于生长繁殖,到了后期氧气稀薄,Wickerhamomyces(异常威克汉姆酵母)能有利的在无氧条件下产生酒精。对曲霉的生长也有一定的抑制作用;在第二次发酵过程中,第11天的Leohumicola(锤舌菌属)成为第三多的属种。
从种水平上看,除去未分类和其他真菌来说,Wickerhamomyces anomalus(异常威克汉姆酵母)含量最高,其次是Pichia myanmarensis(产香酵母)含量较多,为白酒发酵产香起了重要作用。第一次发酵过程中,总体上来说Wickerhamomyces anomalus(异常威克汉姆酵母)含量呈上升趋势,在第二次发酵过程中,第11天出现Leohumicola minima(锤舌菌)含量异常增多的现象,从不同分类单元的统计结果可以看出,在门、纲、目、科、属水平的第一次发酵和第二次发酵的真菌类型大致相同,但具体占比不同。众多研究表明,真菌的群落多样性还取决于发酵次数且异常威克汉姆酵母和产香酵母酒醅发酵过程中起相对重要的作用。
2.6 不同发酵时期马铃薯白酒酒醅发酵液样本真菌群落结构分析
2.6.1 UPGMA分析
Beta多样性是对不同样品中微生物群落构成差异的比较分析,主要关注时空环境格局相关的物种组成变化[12]。在对马铃薯白酒酒醅发酵液中不同分类学水平真菌菌群相对丰度进行分析的基础上,进一步采用UPGMA分析研究不同样本真菌群落结构的相似性和差异关系,根据β多样性距离矩阵进行层级聚类分析[13],使用UPGMA算法构建树状结构[14],如图3所示。马铃薯白酒酒醅发酵液样品可聚为3类,其中对于大茬而言:Fday1、Fday5、Fday9聚为一类,Fday3、Fday7聚为一类,Fday11聚为一类;对于二茬而言:Sday1、Sday5、Sday9聚为一类,Sday11聚为一类,Sday3、Sday7聚为一类。由此也可将整个发酵过程大致分为3个阶段,发酵前期、中期和后期。针对于发酵时期相同的大茬、二茬的来说,真菌群落组成结构相似。从整体的发酵过程上来看,真菌群落组成结构存在差异。

图3 基于Beta多样性距离的样品层级聚类树图
2.6.2 PCA分析
进一步进行PCA分析可知,主成分1(PC1)的贡献率为79.02%,主成分2(PC2)的贡献率为18.99%,合计为98.01%,说明两组间差异具有统计学意义,样本之间的距离代表真菌群落结构的差异程度,如图4所示。12个样品真菌群落结构存在差异,在4个象限均有分布,且聚类趋势不太明显;其中Sday1和Sday5真菌群落多样性差异较小,分布于第三象限,其菌群种类相似程度较高,且对比整体的群落结构具有明显的不同,这与UPGMA聚类分析大致结果 一致。
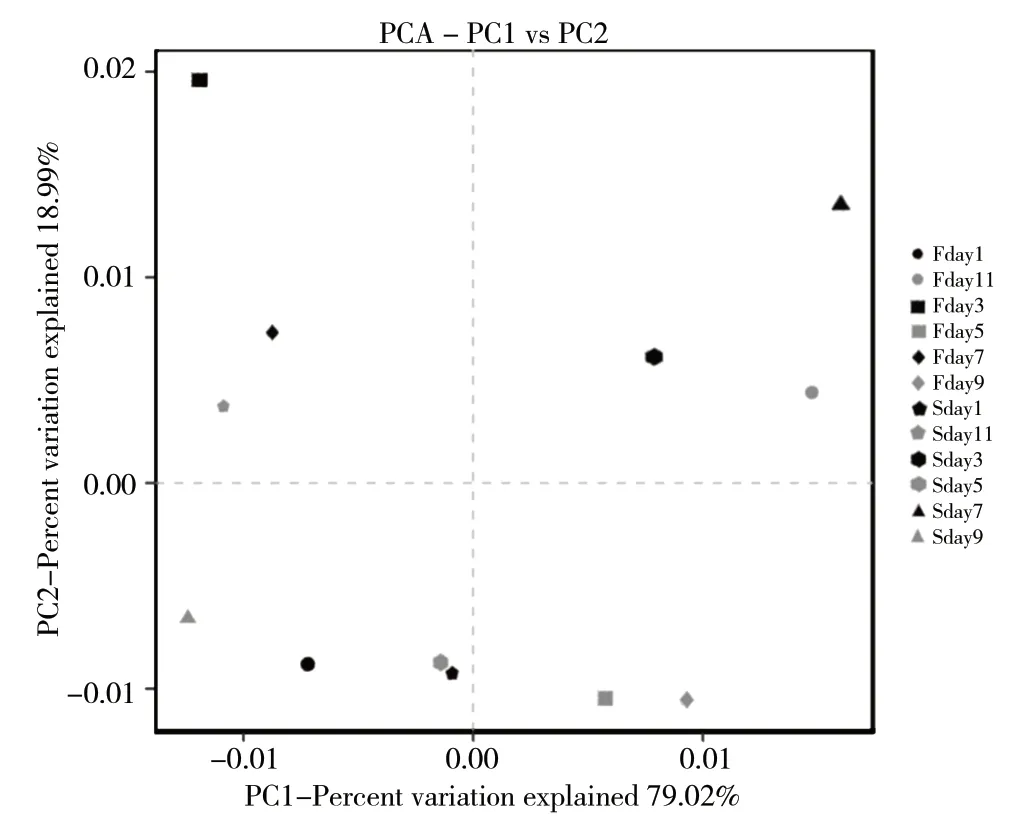
图4 基于Beta多样性的PCA分析图
2.6.3 属水平真菌群落分析
图5表明了在马铃薯白酒在不同发酵时期,样本间不同真菌菌属的相对丰度以及真菌组成的差异性和样品间的相似性。在二茬发酵前期(Sday1~Sday3)时Bjerkandera(黑管菌属)为优势菌属,在二茬发酵中期(Sday5~Sday7)时Fusarium(镰刀菌属)和Ustialaginoidea(绿核菌属)优势菌属,二茬发酵末期(Sday9~Sday11)中,Cladosporium(分支孢子菌属)、Leohumicola(锤舌菌属)、Archaeorhizomyces(子囊菌属)及Phaeosphaeria(球腔菌属),相对丰度大大提高,发展为优势菌属,在大茬发酵阶段真菌组成的差异性不是很大,总体上趋于低丰度。
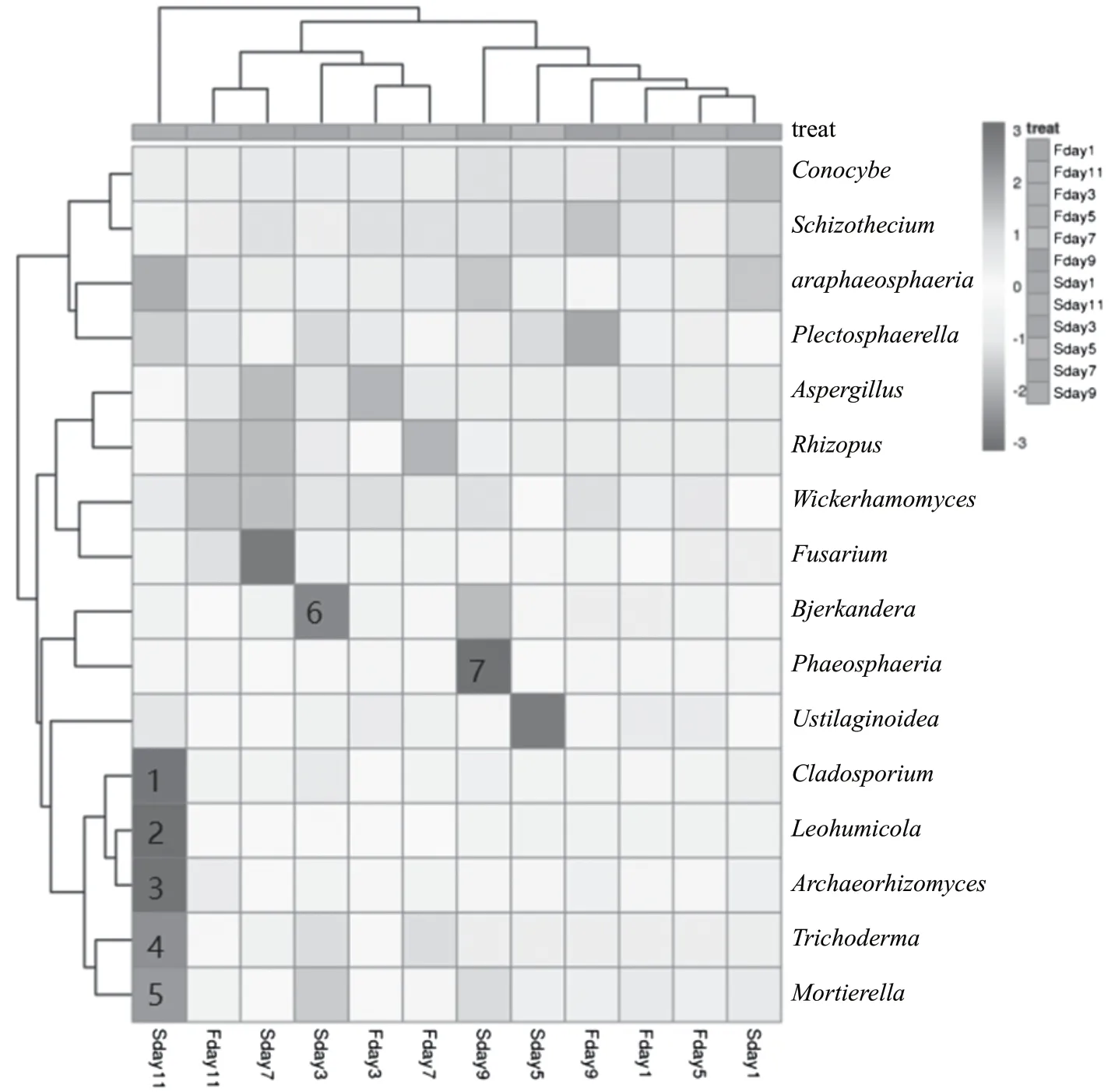
图5 酒醅样品真菌属的聚类分析图
在整个发酵过程中,样品可聚为3类,Sday11单独归为一类,Fday3、Fday7、Fday11和Sday3、Sday7在属水平真菌群落结构比较接近,归为一类;Fday1, Fday5、Fday9、Sday1、Sday5和Sday9在属水平真菌群 落结构比较接近,归为一类。分别对应于二茬的发酵末期、大茬的发酵中末期和二茬的的发酵中期、大茬的发酵前期和二茬的发酵期,总丰度排名在前的可分为4类,其中Cladosporium(分支孢子菌属)、Leohumicola(锤舌菌属)、Archaeorhizomyces(子囊菌属)、Trichoderma(木霉属)及Mortierella(被孢霉属)、Ustilaginoidea(绿核菌属)聚为一类,对应图中1、2、3、4、5。在大茬、二茬的发酵前中期丰度较低,而在二茬的后期丰度较高。Bjerkandaeria(黑管菌属)、Phaeosphaeria(球腔菌属)聚为一类,对应图中6、7。在二茬发酵中末期相对丰度较高,其余时候相对丰度较低。大茬与二茬两者相比,随着发酵时间的延续,通过蒸酒次数的比对,可知二茬的相对丰度比大茬高,菌种后期逐步适宜环境,有利于菌种的生长繁殖。综上,发酵次数对菌种的生长起到一定的影响。
2.7 酒醅中酵母在WL鉴别培养基上的菌落形态及显微镜观察
酵母在WL鉴别培养基上的菌落形态及显微镜观察情况如图6所示。①平板下观察:菌落大,整体菌群分散均匀,表面光滑,酵母外形饱满圆润,形态完整。有些菌落圆形凸起,有些边缘呈放射状,菌株颜色大多呈乳白色,少量菌株边缘白色,中央淡绿色。②油镜下观察:采用吕氏美兰染色法,在100倍显微镜下观察到酵母多呈卵圆形、瓶形、圆形,单细胞结构,能清晰地看见液泡等众多细胞器,有时候会发现酵母的出芽生殖,可以清晰看到从菌体出的芽,在酵母的细胞膜上有细小酵母个体。
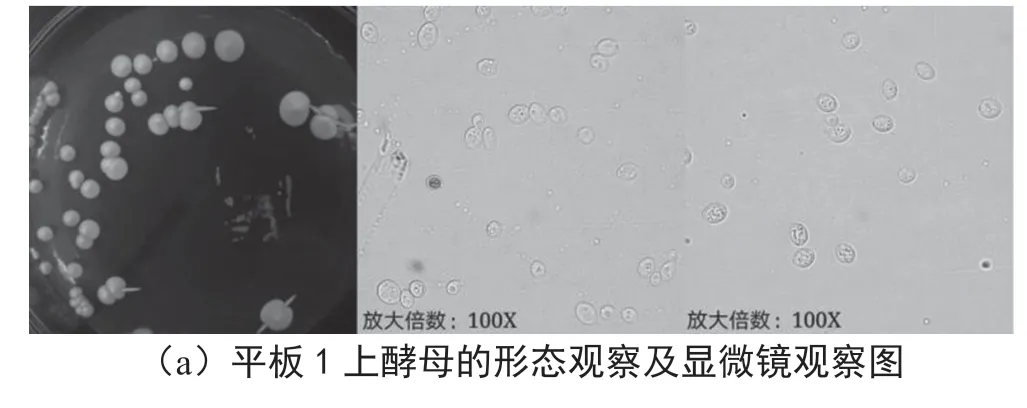

图6 酵母在WL鉴别培养基上的菌落形态及显微镜观察图
3 结论与讨论
本文首次综合采用WL鉴别培养基和利用高通量测序技术对12种酒醅样品的16S rRNA基因18 S和5.8 S 进行测序,该区域适用性较广,能够高效地扩增目标区域,是微生物多样性分析优先选择的区域之一。结果获得了1015 352条有效序列数,并聚成27~50个OTUs,且12种酒醅样品中真菌的Shannon指数、Simpson指数和Chao指数分别在0.1282~1.2096、0.0241~0.3248和28.0~47.0,说明所测定的酒醅含有丰富的真菌种类。同时,从不同分类单元的统计结果可以看出,12种酒醅样品在门、纲、目、科、属水平的优势真菌类型相同,具体占比不同。众多研究表明,从大茬、二茬发酵相同阶段上来说,真菌群落组成结构相似。从整体的发酵过程上来看,真菌群落组成结构存在差异,变化趋势明显。
研究表明,不管从整体还是大茬、二茬分类角度分析,优势菌科都为法夫酵母科,优势菌科都为异常威克汉姆酵母(94%)。酵母菌产生的酯化酶作用下使乙酸和乙醇生成乙酸乙酯,提高酒的含脂量,生香味。异常威克汉姆酵母为主的产酯酵母对酒精的耐受性差,乙醇对异常威克汉姆酵母生长和发酵性能具有严重抑制作用,所以在该实验中异常威克汉姆酵母的相对丰度变化较大[15]。第二大优势菌科为生香酵母,其被广泛应用于食品发酵相关领域,包括酱醋酿造、传统面食、果酒酱发酵、白酒酿造等风味导向型产业,起到丰富香气、改善感官品质的作用,具备提升酒体感官品质的[16]。除了酵母属在酿造过程中起发酵作用外,发现曲霉也具有一定的功能作用,从种水平上看,黄曲霉仅次于Wickerhamomuces anomalus(异常威克汉姆酵母)和Pichia myanmarensis(产香酵母)成为第3大优势菌种,黄曲霉产液化型淀粉酶的能力强,具有较强的蛋白质分解能力,并且能分解DNA产生核苷酸[17]。
酵母作为酿造过程中重要的生物类群,起着重要作用。由于酵母个体小、数量多,其多变的类型和强大的适应环境能力,为我们了解酵母全貌带来障碍。通过高通量测序技术可以快速直观地得到真菌结构并且能获得大量未知种类,显示出分子生物技术的优势,研究酒醅中酵母群落结构及多样性,必须将传统培养方法和现代分子生物学方法结合起来[18]。
