金鱼雌核发育单倍体胚胎血液循环障碍产生机制
2022-01-20张琼宇唐甲卉唐鹏程孙远东
张琼宇 唐甲卉 彭 娟 唐鹏程 孙远东
(1. 永州职业技术学院公共基础学部, 永州 425100; 2. 湖南省中医药研究院附属医院, 长沙 410006;3. 湖南科技大学生命科学学院, 湘潭 411201)
单倍体是指体细胞染色体组数等于该物种配子染色体组数的个体。由于只含有一套染色体, 理论上任何隐性突变基因的遗传效应都会由于缺乏等位基因而在单倍体表型中体现出来。因此, 单倍体在遗传筛选、基因功能研究和转基因动物生产中具有独特价值[1]。
脊椎动物单倍体细胞可以体外培养并持续分裂增殖[2—4], 但人工诱导的鱼类和两栖类单倍体胚胎都呈现出致死的“单倍体综合症”[5—10]。传统的理论认为核质不平衡、有害的隐性基因和单倍体细胞分化能力缺陷是单倍体综合症产生的原因[11,12]。近年来, 一些学者利用新的技术手段探讨了鱼类单倍体综合症形成的分子机制。在青鳉(Oryzias latipes)中, 有研究表明单倍体索前板发育不良导致其体轴短小[7]; 在金鱼(Carassius auratus)中, 蛋白质组分析表明自交二倍体和雌核发育单倍体胚胎在发育过程中的蛋白表达存在显著差异[13]; 表观遗传学研究显示ntl(no tail)基因在精子和卵子存在甲基化差异, 雌核发育单倍体胚胎中因仅含ntl母本等位基因使其表达模式异常导致胚胎发育缺陷[14]。在牙鲆(Paralichthys olivaceus)中, 转录组分析发现在单倍体中Notch和Wnt信号通路的相关基因表达下调[15]。这些研究各自探讨了单倍体胚胎发育异常的原因, 提出了一些与传统理论不同的看法, 但对于单倍体胚胎综合症的产生机制至今仍然没有定论。
血液循环障碍是鱼类单倍体的共有特征[7,8],然而对其形成原因尚未进行系统研究。金鱼(Carassius auratus)是我国传统的观赏养殖鱼类, 距今有1700多年驯养历史[16]。经过长时间人工近交选育, 金鱼各品系群体内遗传相似度很高[17], 其全基因组序列已经被测定[18], 是研究脊椎动物发育和进化的良好模型[19,20]。本研究首先观察了金鱼雌核发育单倍体胚胎血液循环的形态特征, 然后从分子水平比较分析了单倍体与自交二倍体胚胎循环系统发育过程之间的差异, 初步探讨了导致单倍体胚胎血液循环障碍的原因, 为进一步研究单倍体综合症的发生机制奠定基础。
1 材料与方法
1.1 实验动物
金鱼红帽品系(Red cap oranda)和雄性湘江野生鲤(Cyprinus carpioL.)由湖南省水产养殖实践教学示范中心提供。
1.2 金鱼雌核发育单倍体和自交二倍体的获得
在繁殖季节, 用紫外线照射后的鲤精液激活金鱼成熟卵子发育获得雌核发育单倍体胚胎, 通过干法人工授精获得自交二倍体胚胎, 具体方法参照先前的报道进行[21]。雌核发育单倍体和自交二倍体来自同一条雌鱼。卵子受精后3—5min用0.25%的胰蛋白酶(Sangon Biotech)去膜, 胚胎置(20±0.5)℃孵育。金鱼胚胎的发育时期参考文献[22]报道确定。
由于父本鲤具有单尾的显性性状, 而母本金鱼具有双尾隐性性状, 因此, 人工诱导雌核发育单倍体胚胎都是双尾。借助这种明显可分辨的遗传学标记, 在体节形成期即可通过观察尾柄的性状准确鉴别得到可靠的单倍体[6]。
1.3 不同表型单倍体胚胎的鉴定、分类和统计分析
金鱼早期出现血液循环时胚胎透明, 可用体式显微镜直接观察循环细胞的数量和形态。在金鱼单倍体胚胎囊胚早期挑去未受精卵, 将已发生卵裂的受精卵数作为统计基数。当胚胎发育至65%耳囊闭合 (Otic vesicle closure, OVC) 期, 一部分单倍体胚胎死亡, 其余单倍体胚胎根据血液循环表型可分为3类, A类为血液循环基本正常的胚胎, B类为血液循环不良的胚胎, C类为无血液循环胚胎。统计3类不同表型胚胎和死亡胚胎的数目, 实验重复3次。每一批统计的雌核发育单倍体胚胎来自同一条雌鱼。采用SPSS 19.0软件对数据进行单因素方差分析, 多组间两两比较采用Tukey’s多重比较检验,P<0.05表示存在显著性差异。
1.4 流式细胞仪检测染色体倍性
取25% OVC期金鱼胚胎, 于体式显微镜(Olympus SZ61)下用尖头镊子挑去卵黄囊。将自交二倍体和雌核发育单倍体胚胎分别置于ACD抗凝剂(0.48 g柠檬酸+1.32 g柠檬酸钠+1.47 g葡萄糖+100 mL H2O)中剪碎制备成细胞悬液, 取细胞悬液与DAPI染液(Sangon Biotech)1∶1混合后避光染色15min, 样品经过20 μL尼龙过滤器过滤后进行流式细胞仪(CyFlow®Ploidy Analyser, Sysmex Partec)检测。
1.5 邻联茴香胺染色
邻联茴香胺能与亚铁离子耦合特异性标记血红蛋白, 从而可以指示红细胞分布的情况。称取20 mg邻联茴香胺(Sigma)溶于14 mL无水乙醇中,4℃避光储备, 然后以此储备液配制染色工作液(0.6 mg/mL邻联茴香胺、0.01 mol/L醋酸钠、0.65%过氧化氢和40%乙醇)。对去膜的金鱼胚胎进行避光染色15min, 然后利用体式显微镜(Nikon C-DSS230)和数码摄像系统(Nikon DXM1200)观察、拍照。
1.6 金鱼造血与血管发生相关基因的部分cDNA序列获得
使用总RNA抽提试剂盒(SV Total RNA Isolation System, Promega)提取14体节期的金鱼胚胎总RNA。利用琼脂糖凝胶电泳和分光光度计测定RNA完整性和浓度。以500 ng总RNA为模板, 利用PrimeScript™ RT reagent Kit with gDNA Eraser(TaKaRa)合成cDNA第一条链。根据斑马鱼基因scl(AF045432)、gata-1(DRU18311)、flk-1(AF180354)、N-cadherin(NM_131081)的编码区保守序列和金鱼gsc(XM_026285620)编码区序列设计引物(表 1), 以逆转录合成的cDNA为模板进行PCR扩增, 各目的片段回收纯化后, 利用pEGM-T载体(Promega)进行亚克隆和序列测定。所得测序结果经NCBI网站(https://www.ncbi.nlm.nih.gov)中Blast功能分析后,分别确认为金鱼scl、gata-1、flk-1、N-cadherin和gsc基因的部分cDNA序列。所得金鱼scl、gata-1、flk-1和N-cadherin的部分cDNA序列已递交至NCBIGenBank中。

表 1 本研究扩增的金鱼基因Tab. 1 Goldfish genes amplified in this study
1.7 整胚原位杂交
将上述分别插入了scl、gata-1、flk-1、N-cadherin和gsc基因部分cDNA片段并已经测定序列的重组质粒用限制性内切酶NotⅠ (TaKaRa)线性化处理, 然后以此为模板利用T7 RNA多聚酶(Roche)合成地高辛标记的反义RNA探针。在不同的发育时期, 包括95%外包期、5体节期、14体节期、20体节期和25% OVC期等, 随机选取雌核发育单倍体和自交二倍体胚胎各40—50枚胚胎经4%的多聚甲醛(Sangon Biotech)固定过夜, 用于整胚原位杂交分析, 具体步骤参照文献[23] 。
2 结果
2.1 金鱼雌核发育单倍体胚胎呈现不同程度的循环系统发育缺陷
金鱼卵子经遗传失活的鲤精子激活后可以获得高比例的雌核发育单倍体胚胎(图1 b—e), 在体节形成期根据金鱼的双尾隐性遗传性状可将其准确鉴定, 流式细胞仪检测也进一步确定了其倍性(图 1f)。体式显微镜观察发现, 25% OVC期金鱼自交二倍体胚胎开始出现心跳, 然后逐渐可见血液循环; 65% OVC期二倍体胚胎心跳有力、卵黄囊双侧的总主静脉(Common cardinal vein, CCV)中均可见明显的血液流动, 血量充沛、血液循环顺畅(图 1a)。雌核发育单倍体胚胎心跳开始的时间相较于自交二倍体胚胎晚约4—6h, 但不同的单倍体胚胎血液循环出现的时间先后不一, 差异较大,部分单倍体胚胎直至死亡也未出现明显的血液循环。在65% OVC期, 单倍体胚胎循环系统明显呈现不同程度的发育缺陷, 我们可依据观察到的血液循环表型将单倍体胚胎大致分为3类: A类胚胎,血液循环基本正常, 心血管系统发育良好, 心跳明显(图 1b); B类胚胎, 血液循环不良, 胚体局部有血液淤积, 往往仅在卵黄囊一侧的CCV中可见明显的血液流动, 心跳明显, 心包腔有轻度水肿(图 1c和图 1d); C类胚胎, 无明显可见的血液循环, 心脏有微弱跳动, 心包腔严重水肿, 胚体背部可见少量血细胞堆积(图 1e)。其中B类胚胎所占比例明显高于A类和C类(图1g)。对金鱼胚胎血红蛋白进行邻联茴香胺染色, 结果发现60% OVC期的金鱼自交二倍体胚胎全身各处均有被染色的区域(图1h箭头所示), 包括卵黄囊两侧、躯干及尾部血岛(Posterior blood island, PBI); 雌核发育单倍体A类胚胎中染色情况与同期自交二倍体胚胎类似, 但染色面积较少, 强度较弱(图 1i箭头所示); B类胚胎的染色区域主要位于卵黄囊的某一侧及PBI (图 1j和图 1k箭头所示); C类胚胎的染色区域仅位于胚体背部 (图 1l箭头所示)。这些观察结果说明金鱼雌核发育单倍体胚胎中具有不同程度的血液循环不良及原始红细胞生成缺陷。
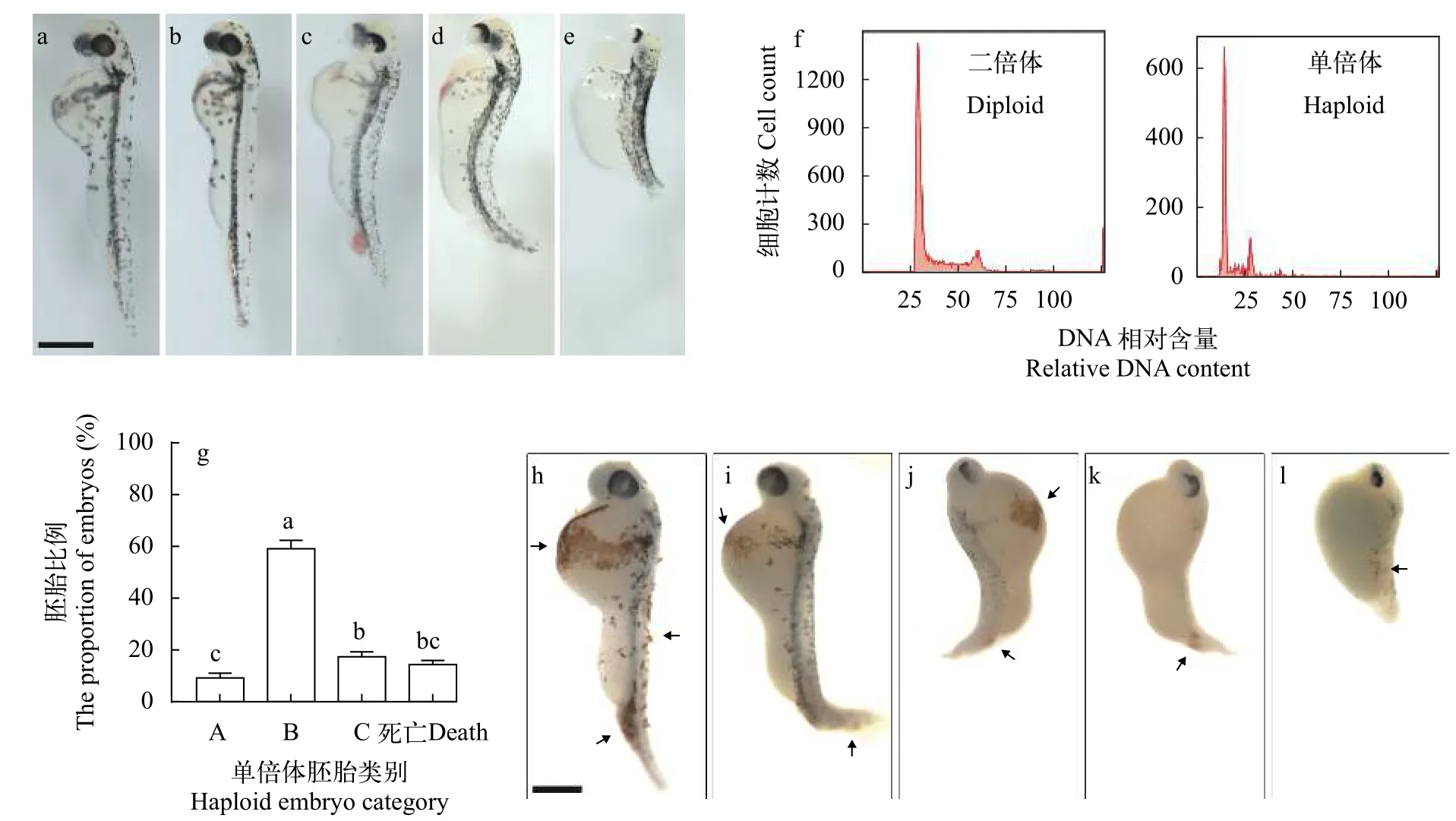
图 1 金鱼雌核发育单倍体胚胎具有循环系统发育缺陷Fig. 1 Circulatory developmental defects of goldfish gynogenetic haploid embryos
2.2 金鱼雌核发育单倍体胚胎存在原始造血缺陷
鱼类胚胎早期血液循环中的血细胞主要是原始造血产生的红细胞[24]。我们首先利用反义RNA整胚原位杂交技术检测了原始红系细胞发育关键基因scl和gata-1在金鱼自交二倍体和雌核发育单倍体胚胎中的表达。结果显示, 在正常自交二倍体胚胎中,scl基因在体节形成早期即开始特异性表达于前侧板中胚层(Anterior lateral-plate mesoderm, ALM)和后侧板中胚层(Posterior lateral-plate mesoderm, PLM)中(数据未显示); 随着胚胎发育的进行,scl的表达沿头端和尾端扩展, 在14体节期, 可以观察到体节外侧表达scl的PLM细胞已经开始向胚体中线迁移(图 2a箭头所示); 20体节期至25%OVC期, PLM逐渐在脊索腹侧躯干区域融合形成ICM (图 2i箭头和图 2m星号所示)。在雌核发育单倍体胚胎中,scl基因也在体节形成后即开始表达(数据未显示), 但其表达模式在后期的发育过程中呈现出多种异常。在14体节期, 表达scl的PLM细胞向胚体中线迁移受阻(图 2b—d), 并且PLM区域scl的表达沿前后轴方向缩短(图 2f—h短箭头所示,78%,n=50); 在20体节期, 单倍体胚胎背部的scl表达减弱, 并保持胚体两侧定位(图 2j—l, 62%,n=50),有的胚胎两侧的scl表达强度也有所不同(图 2k和2l); 在25% OVC期, 单倍体胚胎躯干区域的scl表达进一步减弱, ICM结构模糊, 呈弥散状(图 2n—p,72%,n=50)。
整胚原位杂交检测gata-1基因表达的结果显示, 在正常自交二倍体胚胎中,gata-1基因从5体节期开始特异性表达于胚体两侧的PLM区域内(数据未显示); 14体节期到25% OVC期, 两条条纹状gata-1基因的表达信号从前端靠近 (图 3a), 然后进一步向胚体中线迁移汇聚融合(图 3i箭头所示), 最后形成一条信号, 定位于ICM区域内(图 3m星号所示)。在雌核发育单倍体胚胎中,gata-1开始表达的时间与自交二倍体相似; 但随着胚胎发育的进行, 其表达模式呈现出多种异常。14体节期, 单倍体胚胎中gata-1的表达沿前后轴方向缩短(图 3f—h短箭头所示, 68%,n=50); 20体节期, 单倍体胚胎中gata-1的表达减弱,gata-1+细胞向胚胎背中线迁移受阻(图 3j—l, 82%,n=50); 25% OVC期,gata-1表达信号进一步减弱并仍然定位于胚体两侧, 未能迁移至胚胎背部中线(图 3n—p, 74%,n=50)。在各发育阶段还可见一些单倍体胚胎只在胚体一侧有明显的gata-1表达信号(图 3d和3l)。这些结果说明scl和gata-1在金鱼雌核发育单倍体与自交二倍体胚胎中的表达模式存在明显差异, 原始造血关键部位ICM发育缺陷,原始造血干细胞和红细胞数量减少。
2.3 金鱼雌核发育单倍体胚胎存在血管发育缺陷
已有研究表明SCL在造血干细胞和血管的发育中都发挥了关键调控作用[25],scl在单倍体胚胎中表达异常, 说明其血管系统发育也有缺陷。进一步对成血管细胞和血管内皮细胞的重要标记基因flk-1进行表达分析以了解金鱼单倍体胚胎中血管的发育情况。整胚原位杂交结果显示, 25% OVC期的自交二倍体胚胎中flk-1在整个血管系统均有表达, 在背主动脉、后主静脉、头面部血管、节间血管和尾部血管中均可见表达信号(图 4a和图 4f), 且原始体轴血管背主动脉(图 4g黑色六角星所示)和后主静脉(图 4g白色六角星所示)发育良好, 节间血管清晰完整, 上下排之间夹角固定(图 4g箭头所示); 而同时期的单倍体胚胎中flk-1在躯干处表达减弱(图 4b—e, 72.5%,n=40), 背主动脉和后主静脉结构紊乱、模糊不清, 节间血管与体轴血管呈垂直排列(图 4h和图 4i), 并且数量减少, 在体轴一侧缺失(图 4c)或在躯干背部完全缺失(图 4d和图 4e)。这些结果说明金鱼雌核发育单倍体与自交二倍体胚胎中的flk-1表达具有明显差异, 雌核发育单倍体胚胎中成血管细胞和血管内皮细胞减少, 原始体轴血管发育受到干扰, 节间血管发育不全, 存在严重的血管发育缺陷。
2.4 金鱼雌核发育单倍体胚胎原肠胚期存在细胞运动缺陷
观察金鱼胚胎原肠期发育过程发现, 与自交二倍体胚胎相比, 单倍体胚胎外包运动受阻, 到达尾芽期要延迟30min至1h(67.5%,n=40); 并且单倍体胚胎的前后体轴(图 5b—d中箭头和三角形所示间距)明显缩短。原位杂交检测发现, 与自交二倍体胚胎相比, 95%外包期, 脊索前板标记基因gsc在单倍体胚胎中的表达区域更加靠近植物极(图 5f—h, 77.5%,n=40), 说明其具有延伸障碍;2体节期, 神经板标记基因N-cadherin在单倍体胚胎中的表达区域明显增宽(图 5j—l白色双箭头指示, 77.8%,n=36), 说明胚胎背部未能正常汇聚。这些结果都证明雌核发育单倍体胚胎存在原肠运动缺陷。
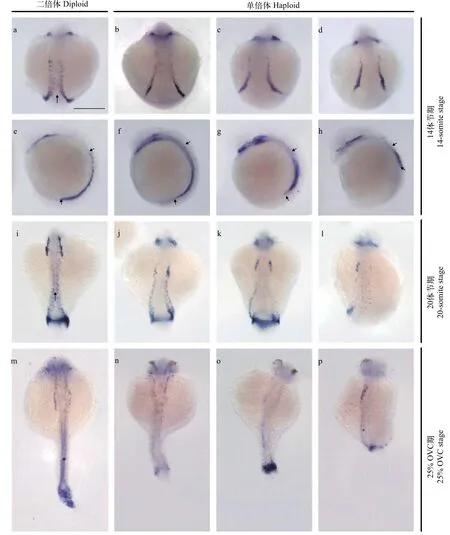
图 2 金鱼自交二倍体与雌核发育单倍体胚胎中scl的差异表达Fig. 2 Differential expression of scl in gynogenetic haploid and inbred diploid goldfish embryos

图 3 金鱼自交二倍体与雌核发育单倍体胚胎中gata-1的差异表达Fig. 3 Differential expression of gata-1 in gynogenetic haploid and inbred diploid goldfish embryos
3 讨论
3.1 金鱼雌核发育单倍体胚胎细胞的发育潜能
本研究发现金鱼雌核发育单倍体活体胚胎循环系统存在不同程度的发育缺陷(图 1), 这与其他鱼类单倍体胚胎中的观察结果相似[7,8,26]。有研究认为单倍体胚胎细胞虽具备分裂增殖的能力但缺乏发育和分化的能力[27]; 对金鱼单倍体胚胎眼睛的表型差异进行统计分析, 推测某些发育关键基因在单套染色体组中只有 50% 的表达概率[6]。然而, 我们检测到scl、gata-1、etv2[28]和flk-1等调控原始造血和血管发生的关键基因在金鱼雌核发育单倍体与自交二倍体胚胎中的起始表达时间没有明显的区别, 并在胚胎各个发育阶段均有表达。同时, 即使在无血液循环的单倍体胚胎中仍可观察到血细胞堆积于其背部(图 1e), 邻联茴香胺染色结果也证明这些血细胞能够表达血红蛋白(图 1l)。这些结果说明单倍体胚胎能够产生成血管母细胞、造血干细胞、成血管细胞、红细胞和血管内皮细胞等。对金鱼单倍体胚胎眼睛进行组织切片也发现其中具有各类已分化的细胞[6]。这提示单倍体胚胎细胞本身具有完全的发育潜能, 能够产生终末分化的体细胞。

图 4 金鱼自交二倍体与雌核发育单倍体胚胎中flk-1的差异表达Fig. 4 Differential expression of flk-1 in gynogenetic haploid and inbred diploid goldfish embryos
3.2 金鱼雌核发育单倍体胚胎血液循环障碍的产生原因
原位杂交检测发现, 体节形成早期, 单倍体胚胎中scl和gata-1都能在PLM区域表达, 与二倍体胚胎相似; 但14体节期以后, 单倍体胚胎scl和gata-1的表达十分紊乱, 呈现出各种异常(图 2和图 3), 其共同特点是没有像自交二倍体胚胎那样逐渐表达于胚体中线, 而仍然表达于胚体的两侧; 这说明金鱼雌核发育单倍体胚体两侧的PLM不能正常迁移至胚体中线形成ICM。20体节期至25% OVC时期, 单倍体胚胎中scl和gata-1的表达在躯干部位逐渐减弱, 说明其原始造血干细胞和红细胞数量减少。单倍体胚胎中的成血管细胞标记基因etv2的表达模式与scl类似, 在胚体中线表达缺失并在躯干部表达减弱[28]; 结合血管内皮标记基因flk-1的表达情况(图 4),可以说明单倍体胚胎中成血管细胞数量减少, 向中线迁移存在障碍, 原始体轴血管的发育受到干扰,并且血管内皮细胞分化减少, 节间血管发育不良。综上所述, ICM和体轴血管发育缺陷, 红细胞数量减少及外周血管发育不全可能是导致单倍体胚胎出现血液循环障碍的重要原因。
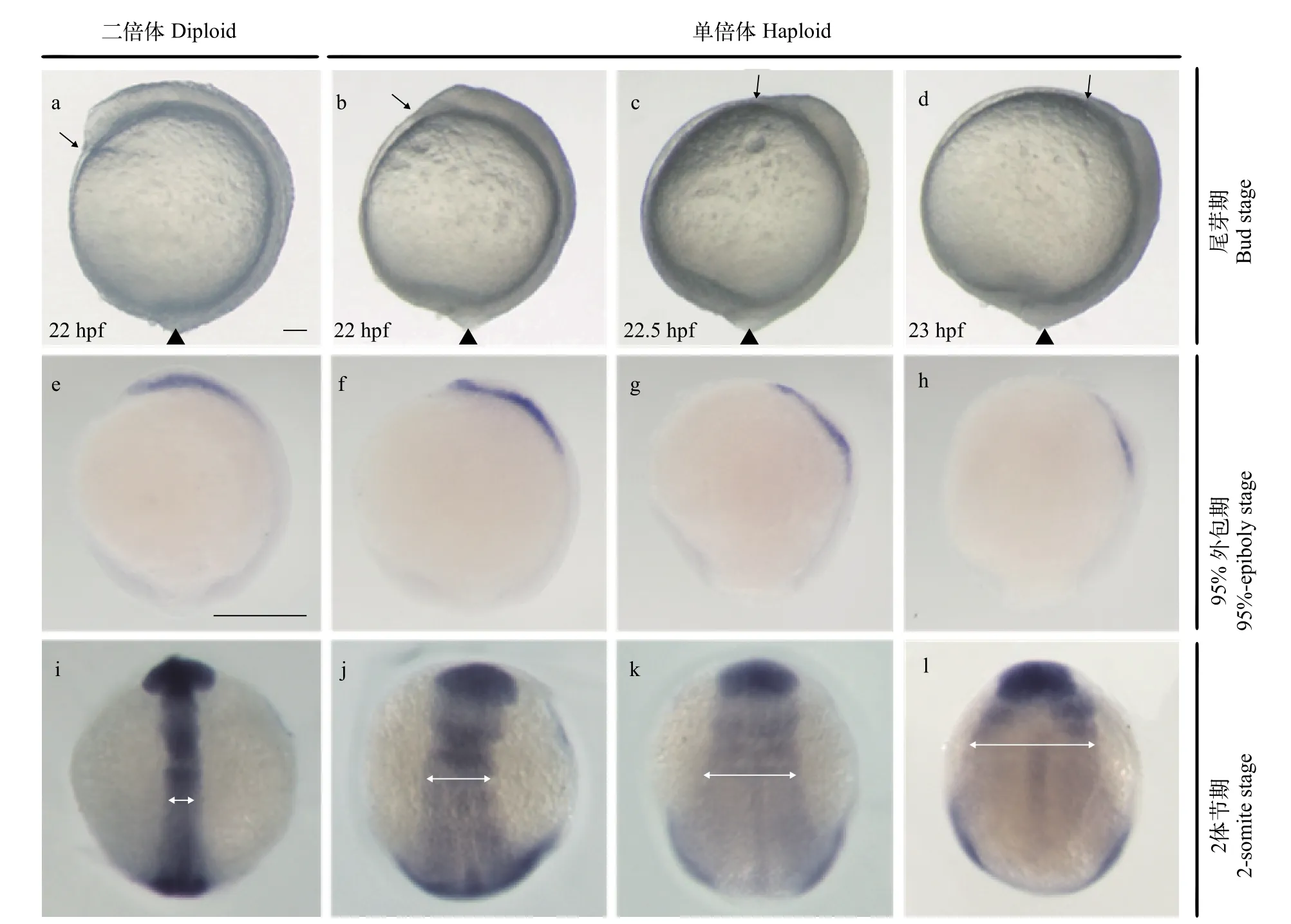
图 5 金鱼自交二倍体和雌核发育单倍体胚胎汇聚延伸运动比较Fig. 5 Comparison of convergence and extension movement between gynogenetic haploid and inbred diploid goldfish embryos
3.3 广泛的细胞运动迁移异常可能是金鱼雌核发育单倍体胚胎发育畸形的重要原因
脊椎动物原肠胚期, 胚胎细胞历经包括外包、内卷和汇聚延伸等大规模的形态发生运动, 形成3个胚层, 为胚胎体轴建立和器官发育奠定了基础[29]。外包运动在原肠末期完成, 而汇聚延伸运动在体节期仍在进行。在原肠胚期, 可以观察到金鱼单倍体胚胎外包运动受阻 (图 5a—d), 这与其他鱼类中报道的情况相似[7,8]。在原肠运动过程中, 从胚盾处最先内卷的胚胎细胞是脊索前板前体细胞, 它们进入胚胎内部后持续地向动物极迁移, 位于延伸最前端[30]。原位杂交检测显示, 脊索前板标记基因gsc在95%外包期单倍体胚胎中的表达部位较自交二倍体胚胎更加靠近植物极(图 5e—h), 说明单倍体胚胎延伸运动受阻。N-cadherin主要表达于胚胎背部的神经外胚层和中胚层, 是细胞汇聚到背中线所必需的关键基因[31]。因此, 在原肠运动完成后,可以通过N-cadherin表达区域的宽度来评估背部细胞是否正常汇聚。原位杂交检测显示, 2体节期单倍体胚胎中N-cadherin的表达区域明显比自交二倍体胚胎增宽(图 5i—l), 说明单倍体胚胎汇聚运动异常。同时, 原位杂交检测显示单倍体胚胎的PLM细胞在体节期不能正常迁移至胚体中线 (图 2和图 3)。这些结果提示金鱼雌核发育单倍体胚胎在进入原肠胚期后出现了广泛的细胞运动迁移异常从而导致其发育畸形。由于细胞运动迁移和有序地重新组织对于包括循环系统在内的各个系统器官形成都有重要作用, 因此可以推测单倍体胚胎中各器官的畸形严重程度是密切相关的。在金鱼单倍体胚胎中也的确可以观察到, 如果某个胚胎眼睛发育严重畸形时, 往往大脑结构也不正常[21], 同时其躯体十分短小扭曲, 围心腔异常膨大并不具有血液循环(图 1e)。
造成单倍体胚胎细胞运动迁移异常的原因可能非常复杂。首先, 由于只含有单倍遗传物质, 单倍体中与细胞运动迁移相关功能基因的表达产物可能不足[15]; 其次, 父母本基因组存在表观遗传修饰差异, 这也可能改变单倍体中与细胞运动迁移相关功能基因的时空表达模式[14]; 再次, 单倍体胚盘内存在广泛的非特异性细胞死亡可能影响了原肠期的细胞运动迁移[7]; 此外, 最近的研究证明只有大小合适的细胞才能在特定发育时期以最佳方式自主地迁移至合适的部位参与形态发生, 而单倍体胚胎中细胞小于同时期的二倍体细胞, 所以无法以最佳方式进行运动迁移[32]。然而, 要确定单倍体胚胎细胞运动迁移异常的具体原因仍有赖于今后深入和系统的研究。
另外, 在一些单倍体胚胎中可以发现scl+和gata-1+细胞的迁移路径十分紊乱(图 2j和图 3j), 表明其成血管细胞和造血干细胞迁移过程具有随机性, 它们的迁移路径和最终迁移部位没有受到精确控制, 这可能是导致单倍体胚胎群体中循环系统表型呈现多样性的重要原因。
总之, 在本研究中我们观察了金鱼雌核发育单倍体胚胎循环系统发育的形态学特征, 证明了原始造血和血管发生关键基因scl、gata-1和flk-1的表达模式在雌核发育单倍体和自交二倍体胚胎中存在明显差异, 同时发现单倍体胚胎在发育过程中存在广泛的细胞迁移运动异常。这些事件可能是导致金鱼单倍体胚胎循环系统发育缺陷和血液循环障碍的重要原因, 为进一步揭示单倍体综合症的发生机制奠定了基础。
