不同病理分型混合型肝癌的超声造影特征分析
2022-01-20陈彦玲朱宇莉陈凯玲张炜彬汪瀚韬王文平
陈彦玲, 朱宇莉, 陈凯玲, 张炜彬, 汪瀚韬, 王文平,2*
1.复旦大学附属中山医院超声科,上海 200032 2.上海市影像医学研究所,上海 200032
混合型肝癌(combined hepatocellular cholangiocarcinoma, CHC)是一种罕见的原发性肝癌,占原发性肝癌的1%~4.7%[1]。1903年,Wells首次报道了CHC,其在一个肿瘤病灶内同时具有肝细胞肝癌(hepatocellular carcinoma, HCC)成分及肝内胆管细胞癌(intrahepatic cholangiocarcinoma, ICC)成分[2]。因该肿瘤较为罕见,临床特征不典型,常被误诊为HCC、ICC等,术前诊断符合率较低[3]。影像学检查对明确诊断CHC具有重要意义,有助于进一步选择合适的治疗方案。
2010年版WHO消化系统疾病分类将CHC分为经典型及具有干细胞特征型,后者再进一步分为经典亚型、中间细胞亚型及胆管细胞亚型[4]。目前,有关CHC超声造影特点的研究较少,且其与病理分型的关系尚不明确。因此,本研究旨在分析CHC的超声造影表现,并与病理分型对照,以提高疾病诊治水平。
1 资料与方法
1.1 一般资料 回顾性分析复旦大学附属中山医院于2015年3月至2019年5月收治的符合以下标准患者的临床资料。纳入标准:(1)经手术病理证实为CHC,具有明确病理分型诊断;(2)术前1个月内行超声造影检查;(3)超声造影检查前未行任何治疗。排除标准:图像质量不佳,无法用于分析。最终纳入49例CHC例患者。其中男性34例,女性15例,年龄36~78岁,平均年龄为(55.86±9.61)岁。本研究经复旦大学附属中山医院伦理委员会批准(B2021-082R)。
1.2 超声造影检查
1.2.1 仪器 采用GE LOGIQ E9、Philips iU22等型号超声诊断仪,探头频率值为1~6 MHz,造影时机械指数(MI)0.06~0.10。
1.2.2 超声造影剂 以SonoVue○R(意大利Bracco公司)为超声造影剂,使用前加入5 mL生理盐水(0.9% NaCl)配成8 μL/mL的微泡混悬液,造影时经肘前静脉团注1.5~2.4 mL,随后快速推入5 mL 0.9% NaCl冲管。
1.2.3 检查方法 二维灰阶条件下扫查全肝,寻找病灶。观察病灶基本特征,选择最佳切面切换至造影模式,观察病灶增强方式、增强程度、消退时间等情况,从注射造影剂开始计时,观察时间不少于5 min,造影全程进行录像。
1.3 图像分析 由2名具有5年以上肝脏超声造影经验的医师在盲法条件下对图像进行分析。灰阶超声主要分析病灶位置、数目、大小、回声水平、形态、边界、血流信号分布、有无肝内胆管扩张及血管癌栓等。超声造影分析3个时相:动脉期(10~40 s)、门脉期(45~120 s)及延迟期(120~300 s)[5]。记录病灶增强时间、增强方式、各时相增强表现、病灶内部是否出现未增强区等。多发病灶则选择最大病灶进行分析。
依据病灶增强回声在动脉期相对肝实质增强强度的变化, CHC的动态增强表现分为3种增强方式:(1)“整体均匀增强”(图1A),表现为造影剂快速填充整个病灶,无明显方向性;(2)“整体不均匀增强”(图1B),表现病灶内各处造影剂分布不均匀,填充时间不一致;(3)“环状增强”(图1C),表现为造影剂由病灶周边部呈环状快速增强。在动脉期、门脉期及延迟期3个时期依据病灶相对肝实质的增强强度,可分为高回声增强、等回声增强及低回声增强。

图 1 超声造影下CHC病灶的增强方式 A:整体均匀增强;B:整体不均匀增强;C:环状增强。
根据病灶增强回声在造影剂注射后2 min内肝实质增强程度的变化,将造影剂消退情况分为:(1)“显著消退”(图2A)为造影剂基本退出病灶,病灶回声明显低于周围肝实质;(2)“轻度消退”(图2B)为造影剂仍存在于病灶内,病灶回声稍低于周围肝实质。(3)“不消退”(图2C)为造影剂存在于病灶内,病灶增强强度与周围肝实质相同。
1.4 病理分析 手术切除标本经甲醛固定,石蜡包埋切片,H-E染色或行免疫组化法染色后依据镜下肿瘤细胞形态分为经典型与伴干细胞特征型;依据细胞内部HCC成分及ICC成分的相对比例分为以HCC成分为主型、以ICC成分为主型、比例相等型(图3)。

图 2 超声造影下CHC病灶造影剂消退程度 A:显著消退;B:轻度消退;C:不消退。
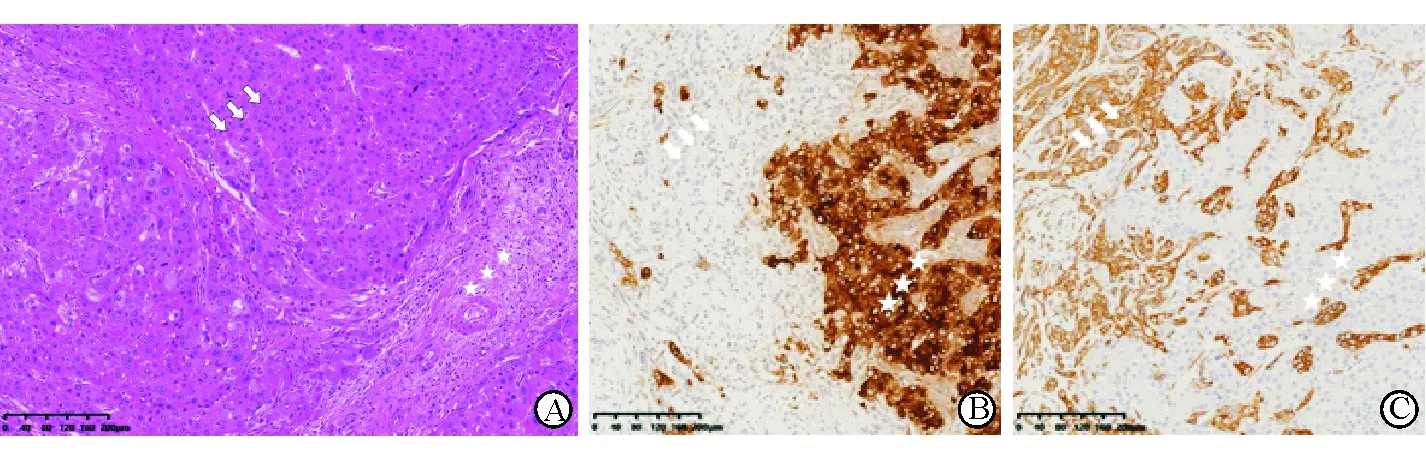
图 3 经典型肝右叶CHC病灶病理图

2 结 果
2.1 患者一般资料 本研究纳入49例CHC患者(表1),其中单发41例,多发8例,选择最大病灶作为观察对象,共纳入49个病灶,病灶平均直径为(28.61±20.10)mm。14.3%患者AFP与CA199同时升高。22例患者术前检测异常凝血酶原(des-gamma-carboxyprothrombin, DCP)水平,其中8例(36.40%)患者DCP升高。
2.2 病理分型 49例CHC中经典型27例(55.1%),伴干细胞特征型22例(44.9%)。以HCC成分为主型21例(42.9%),以ICC成分为主型25例(51.0%),HCC与ICC比例相等型3例(6.1%)。

表1 49例CHC患者的临床基本特征 N=49
2.3 灰阶超声与超声造影特征 灰阶超声显示CHC病灶内部回声多样,其中39例(79.6%)表现为低回声,3例(6.1%)为等回声,7例(14.3%)为高回声。23例(46.9%)病灶形态不规则,41例(83.7%)病灶边界不清,13例(26.5%)病灶周边可见暗环。此外,3例(6.1%)病灶同时存在肝内胆管扩张,2例(4.1%)合并血管内癌栓。彩色多普勒显示CHC病灶的血流信号检出率为49%,平均阻力指数0.75±0.08。
超声造影(表2)显示,49例患者CHC病灶的平均开始增强时间及消退时间分别为(18.04±4.93) s及(64.69±43.96) s。40.8%(20/49)病灶增强方式为整体均匀增强,46.9%(23/49)为整体不均匀增强,12.2%(6/49)如环状增强。53.1%(26/49)病灶表现为显著消退,38.8%(19/49)表现为轻度消退,8.2%(4/49)增强程度不消退。20.4%(10/49)CHC病灶内部出现始终不增强区。
2.4 超声造影特征与病理特征的关系 不同病理类型及细胞成分的CHC超声造影表现(表3)显示,伴干细胞特征型CHC平均消退时间长于经典型CHC[(79.21±55.01) svs(54.08±30.75) s],差异有统计学意义(P<0.05)。此外,两者的开始增强时间、增强方式、各时相增强强度及造影剂消退程度等差异无统计学意义。不同细胞成分CHC病灶的超声造影增强模式存在差异(P<0.05),以HCC成分为主的病灶多表现为整体均匀(57.1%,12/21)或不均匀增强(42.9%,9/21),而以ICC为主要成分的病灶多呈整体不均匀增强(48.0%,12/25)或环状增强(24.0%,6/25)。

表2 混合型肝癌病灶的灰阶超声及超声造影特征

表 3 不同病理类型CHC超声造影模式分析
3 讨 论
CHC是一种同时具有HCC及ICC成分的肝脏原发恶性肿瘤,其病理学基础影响其影像学表现[6]。当前尚未有研究报道CHC的超声造影表现与病理分型的相关性。本研究总结49例手术病理确诊CHC病灶的超声造影特征,探讨其与病理分型的相关性。
研究[7]认为,CHC具有与HCC、ICC相似的危险因素,如HBV感染、HCV感染、酒精性肝硬化等。本研究结果与之相符,纳入病例中85.7%患者HBV阳性,4.1%患者HCV阳性。Li等[8]认为AFP与CA199同时升高可用于提示CHC的诊断,而本研究中55.1%患者AFP升高,18.4%患者CA199升高,14.3%患者AFP与CA199同时升高,还需随访更多病例进行验证。DCP近年来愈加广泛应用于肝脏恶性肿瘤的诊断,其敏感性可达96.9%[9]。本研究中44.90%患者检测了DCP,其中36.40%患者DCP升高,提示其在CHC的诊断中有一定应用价值。
近年来,关于CHC超声造影表现的研究[10]逐渐增多,认为CHC既可表现与HCC相似的增强模式[动脉期整体均匀或不均匀增强伴造影剂缓慢(≥60 s)轻度消退],也可呈现与ICC相似的增强特点[动脉期环状增强和/或造影剂快速(<60 s)显著消退]。Zhang等[11]研究发现,CHC在动脉期增强方式与HCC更为相似,多呈整体增强(73.3%),而门脉期及延迟期的表现则更接近于ICC,其消退程度多呈显著消退(82.8%),消退时间与ICC相近。Sagrini等[12]研究肝硬化背景下CHC的超声造影表现发现,55%病灶动脉期呈整体均匀增强,而环状增强的病灶仅占26%,89%病灶门脉期呈低回声。本研究与以上两项研究结果较为相似,87.8%CHC病灶动脉期呈整体增强,53.1%病灶呈显著消退,提示CHC的超声造影表现与HCC及ICC存在部分相似表现。研究[6]发现,CHC的超声造影表现受病灶内部HCC及ICC成分相对比例的影响,环状增强的病灶以ICC为主要成分,整体均匀增强的病灶以HCC为主要成分。本研究结果与之一致,以HCC成分为主的病灶主要呈整体均匀增强,而以ICC成分为主的病灶多呈整体不均匀增强或环状增强。当病灶以HCC成分为主时,由于肿瘤以肝动脉供血为主且病灶内血窦丰富,超声造影上多表现整体增强的特点[13]。而以ICC为主要成分的病灶其血供不如HCC丰富,中央常发生缺血坏死,周边部则有肿瘤细胞聚集,整体上呈环状增强或不均匀增强的表现[14]。
依据CHC病灶中HCC、ICC及干细胞特征含量的比例不同,2010年WHO将CHC分为经典型和伴干细胞特征型,后者进一步分为经典亚型、中间细胞亚型及胆管细胞亚型。有研究[15]显示,伴干细胞特征型CHC预后较经典型CHC差。钱旭东等[16]对经典型CHC与伴干细胞特征型CHC的增强MRI表现进行比较,发现两者动脉期强化方式及胆管扩张情况差异有统计学意义,然而其余MRI表现差异均无统计学意义。与之相似,本研究仅发现经典型CHC与伴干细胞特征型CHC在超声造影上消退时间存在差异(P<0.05),其增强模式等特征差异无统计学意义,提示超声造影对区分两种类型CHC病灶有一定提示作用,但帮助有限。推测其原因是CHC主要基于细胞微观形态及免疫组化标志物进行病理分型,而超声造影主要反映病灶的微血流灌注特点,对显示病灶的微观层面特点的能力有限,也可能与本组样本数较少有关,未来需收集更多病例进一步探究[17]。
综上所述,CHC的超声造影表现与HCC、ICC存在部分相似特点。不同细胞成分CHC病灶超声造影增强模式存在差异,经典型CHC与伴干细胞特征型CHC造影剂消退时间有差异,CHC的超声造影表现与病理特点存在相关性。
利益冲突:所有作者声明不存在利益冲突。
