硫酸乙酰肝素蛋白多糖在唾液腺腺样囊性癌伴神经侵袭中的表达分析
2022-01-20张艳宁赵增波郝亚丽李荷香
张艳宁 石 宏 赵增波 郝亚丽 李荷香
唾液腺腺样囊性癌(salivary adenoid cystic carcinoma,SACC)是最常见的唾液腺恶性肿瘤之一,约占唾液腺恶性肿瘤的22%。此肿瘤无包膜,易于早期侵袭神经,引起感觉异常、麻木和疼痛。发生在腮腺者可以引起患者面神经麻痹或瘫痪,给患者带来极大痛苦,也给临床治疗带来困扰。以往研究表明,蛋白多糖广泛存在于腺样囊性癌肿瘤组织及肿瘤间质中。抑制腺样囊性癌细胞蛋白多糖合成与分泌,能够明显抑制其生长、增殖、转移、神经侵袭等恶性生物学行为过程[1,2]。本研究以人周围神经系统中的雪旺细胞为对照,检测硫酸乙酰肝素蛋白多糖(heparan sulfate proteoglycans,HSPGs),包括GPC1、GPC2、GPC3、GPC4、GPC5、GPC6、HSPG2、SDC1、SDC2、SDC3、SDC4,在腺样囊性癌中的表达,并探讨其在腺样囊性癌侵袭周围神经过程中的作用。
资料和方法
一、细胞培养
人唾液腺腺样囊性癌细胞株SACC-83细胞(来自北京大学口腔医学院口腔颌面外科研究室)于含15%胎牛血清的RPMI 1640培养液(100U/ml青霉素和100U/ml链霉素)中,于37℃、5% CO2饱和湿度培养箱中培养。
人雪旺细胞(Cat.NO:1700,ScienCell,美国)在含5%血清的培养基(SCM,Cat.No:1701,ScienCell,美国),于37℃、5% CO2饱和湿度培养箱中培养。
二、HSPGs在腺样囊性癌细胞中的表达
采用Real time PCR检测HSPGs(GPC1、GPC2、GPC3、GPC4、GPC5、GPC6、HSPG2、SDC1、SDC2、SDC3、SDC4)在SACC-83细胞与人雪旺细胞中的相对表达量。
TRIzol法(Invitrogen,美国)提取SACC-83细胞和人雪旺细胞总RNA,反转录合成第一链cDNA(RevertAidTMFirst Strand cDNA Synthesis Kit,MBI Fermentas,美国),反应条件:60℃,5分钟;42℃,60分钟;70℃,5分钟。
实时荧光定量(7500 Real time PCR System,Applied Biosystems,USA):50℃,2分钟;95℃,10分钟;95℃变性20秒,57℃退火20秒,72℃延伸31秒,共40个循环。生成融解曲线(The Melt Curve):95℃,15秒;60℃,1分钟;95℃,30秒;60℃,15秒。
采用2-△△CT相对定量法计算样本中基因相对表达量。
引物序列如下见表1。

表1 引物序列表
三、免疫组织化学检测SDC1、SDC4在腺样囊性癌伴神经侵袭组织中的表达
临床收集2007至2021年间,来自河北医科大学口腔医院、河北医科大学第四医院口腔颌面外科就诊的唾液腺腺样囊性癌伴神经侵袭病例23例。肿瘤组织福尔马林固定,同时由两名病理医师进行病理学诊断为“腺样囊性癌”,组织学描述镜下可见神经侵袭。根据上述Real time PCR检测结果,采用免疫组织化学法(PV6000,北京中杉金桥生物技术有限公司,中国)检测SDC1(1:100,Cat.NO:5608-1,Epitomics,美国)、SDC4(1:100,Cat.NO:AF0831-100,Affinity公司,美国)在腺样囊性癌组织中的表达。根据细胞着色深度进行半定量分析:肿瘤细胞或腺腔内黏液不着色为阴性(-),浅棕色者为弱阳性(+)、棕色为阳性(++)、深棕色者为强阳性(+++)。由两名病理医师共同对着色程度进行判断,并分为低表达组(-、+)、高表达组(++、+++)。采用IBM SSPSS 21.0软件、Fisher确切概率法进行统计学分析,P<0.05具有统计学意义。
结 果
一、HSPGs在唾液腺腺样囊性癌细胞中的表达
Real time PCR检测HSPGs mRNA(GPC1、GPC2、GPC3、GPC4、GPC5、GPC6、HSPG2、SDC1、SDC2、SDC3、SDC4)在SACC-83细胞、人雪旺细胞中的相对表达量。结果显示,SDC1在SACC-83细胞中的表达是人雪旺细胞的5.49倍,SDC4在SACC-83细胞中的表达是人雪旺细胞的2.09倍,均高于人雪旺细胞2倍以上(图1)。
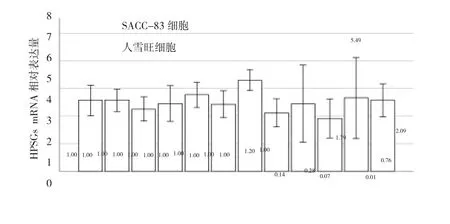
图1 Real time PCR检测HSPGs在SACC-83细胞和人雪旺细胞的表达(N=3)
二、SDC1、SDC4在唾液腺腺样囊性癌伴神经侵袭组织中的表达
临床收集唾液腺腺样囊性癌伴神经侵袭23例(图2)。患者年龄33~72岁,平均年龄52.6岁,男女比例为15:8。其中大唾液腺者18例,小唾液腺者5例。

图2 唾液腺腺样囊性癌伴周围神经侵袭(HE,×200)
免疫组织化学检测结果显示,SDC1在腺样囊性癌肿瘤组织表达阳性(23/23,100%),主要表达于肿瘤细胞膜、细胞浆及肿瘤细胞外基质内,在神经纤维束表达亦呈阳性。在神经侵袭部位与远离神经侵袭部位(镜下远离受侵袭神经束约2.5mm)表达无差别(图3)。SDC4在腺样囊性癌肿瘤组织均有表达(图4),主要表达于肿瘤细胞膜和细胞浆,在神经纤维表达阳性。同时免疫组化半定量分析结果显示,SDC4在伴有神经侵袭部位的肿瘤细胞中表达强阳性5例,阳性16例,弱阳性2例;而远离神经侵袭部位的肿瘤组织中表达阳性1例,弱阳性8例,阴性14例。差别显著,具有统计学意义(表2,P<0.05)。
图3 SDC1蛋白在腺样囊性癌组织中表达阳性(IHC,×200)

表2 SDC4蛋白在腺样囊性癌伴神经侵袭肿瘤组织中的表达统计(N=23)
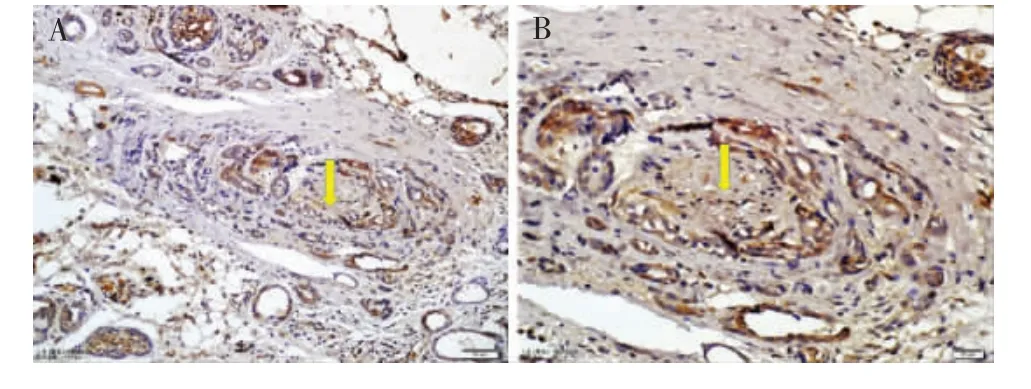

图4 SDC4蛋白在腺样囊性癌组织中表达阳性(IHC)
讨 论
唾液腺腺样囊性癌发生淋巴道转移比较少见,却极易侵袭周围神经组织,表现为包裹周围神经,破坏神经束膜,侵袭神经纤维束,或沿神经纤维束生长,甚至还可以出现沿神经束膜的跳越式转移。因此周围神经侵袭生长也被认为是腺样囊性癌远处转移的途径之一。我们以往的研究发现,抑制腺样囊性癌细胞蛋白多糖的合成分泌,能够明显降低其神经侵袭能力[2]。
HSPGs广泛分布于多种肿瘤组织,如结直肠癌、唾液腺腺样囊性癌和多形性腺瘤等肿瘤细胞及细胞外基质中[3,4]。在应用免疫电镜和原位杂交技术对五种不同的腺样囊性癌细胞株的检测中均发现:腺样囊性癌细胞产生470kDa核心蛋白的HSPG,它与Ⅳ型胶原等细胞外基质(extra cellular matrix,ECM)共同作用于腺样囊性癌细胞的转移过程[5]。而且,转移能力不同的腺样囊性癌细胞株有不同的蛋白多糖表达。卫晋雄等[6]曾比较腺样囊性癌肺转移细胞株ACC-M与其母系细胞ACC-2中HSPGs表达分析,发现具有较高转移活性的ACC-M细胞的HSPGs表达明显高于ACC-2细胞,而且ACC-M细胞中的HSPGs合成速度与沉积于细胞外基质的能力均明显高于ACC-2细胞。同时在对ACC-2细胞研究中,ACC-2细胞在富含蛋白多糖的基质中培养,其粘附、扩散、增殖能力均明显增强[7]。以上研究,均提示高表达的蛋白多糖对腺样囊性癌的恶性生物学行为有促进作用。我们进一步研究发现,不同亚类的HSPGs在腺样囊性癌中的作用也不同,如GPC5在腺样囊性癌肺转移患者的肿瘤组织中表达明显高于未发生肺转移的患者,同时抑制GPC5表达,能够明显降低其肺转移能力[8]。本研究以人雪旺细胞为对照,检测HSPGs在腺样囊性癌SACC-83细胞的表达,结果显示不同亚类的蛋白多糖在腺样囊性癌和周围神经雪旺细胞中表达水平也不尽相同,尤其SDC1与SDC4表达明显高于人雪旺细胞。
多配体蛋白聚糖(Syndecans)作为一类跨膜HSPGs,包括SDC1、SDC2、SDC3和SDC4共4名成员,参与细胞信号通路、增殖、粘附等过程[9,10]。其中SDC1是目前研究比较多的一种,参与细胞增殖、凋亡、血管生成、迁移等过程,并通过细胞外间质蛋白分子受体参与细胞与胞外间质互通[11,12],而使其广泛表达于多种正常及肿瘤组织中[13],促进肿瘤的发生发展,如肝癌、纤维肉瘤、宫颈癌等[14~16]。在本研究中,SDC1在SACC-83细胞中表达明显高于人雪旺细胞,且在唾液腺腺样囊性癌肿瘤组织中表达阳性,提示其可能参与了该肿瘤的发生。而SDC4作为一种糖蛋白受体,担任了在细胞粘附、迁移、增殖、血管生成、内吞和转导等过程中的重要介质分子[17,18],通过调节αVβ3整合素机械受体功能来控制神经突细胞骨架收缩性[19],作为机械传感器,触发整个细胞的整合素激活和粘附强化等[20]。并发现SDC4高表达与大肠癌[21]、乳腺癌[22,23]、肝癌[24]、骨肉瘤[25]等肿瘤的侵袭性、生存期等明显相关,可能作为其临床预后的判断指标[26]。本研究结果显示,SDC4在腺样囊性癌肿瘤组织中表达阳性,尤其是在伴神经侵袭部位肿瘤细胞中表达明显高于远离神经侵袭部位肿瘤细胞,提示其可能参与了肿瘤细胞的周围神经侵袭过程。
综上所述,SDC1、SDC4表达于腺样囊性癌细胞及伴神经侵袭肿瘤组织中,尤其是SDC4蛋白可能参与了腺样囊性癌的周围神经侵袭过程。这为今后的基础研究和临床治疗提供思路,但其具体机制还有待进一步研究。
