HGF过表达对慢阻肺小鼠肺功能、肺动脉压力的影响及其作用机制
2022-01-20吉圣珺李敏菁温业良赖其廷张培芳
吉圣珺 李敏菁 温业良 赖其廷 张培芳
慢性阻塞性肺疾病(Chronic obstructive pulmonary disease)简称慢阻肺,是一种慢性呼吸系统疾病,病情呈进行性发展会引发肺动脉高压(Pulmonary hypertension,PH),形成慢性肺源性心脏病,无法彻底治愈[1-2],临床只能采取对症药物治疗缓解慢阻肺患者症状,而药物长期使用产生的费用和副作用给患者、家庭及社会均带来了沉重的负担[3-5]。因此,寻找慢阻肺的有效治疗方法极为重要。肝细胞生长因子(Hepatocyte growth factor,HGF)是一种间充质来源的多肽生长因子,具有促进内皮损伤修复、抑制细胞凋亡等多重功效[6-7]。有研究报道,HGF在气道损伤修复、肺泡再生等方面起着积极作用[8]。同时HGF还可逆转肺气肿的生理和形态学变化[9]。但HGF在慢阻肺中的作用机制尚不清楚。本研究旨在观察HGF对慢阻肺小鼠肺功能及肺动脉压力的影响,并探讨其作用机制。
资料与方法
一、材料
1 实验动物 野生型C57BL/6J小鼠,雄性,6~8周龄,体重18~22 g,我院医学部实验动物中心提供,饲养环境:室温22~26℃,相对湿度45~65%,标准饲料喂养,自由进食、饮水。
2 主要试剂和仪器 主要试剂:不携带HGF基因的腺病毒载体和携带HGF基因的腺病毒载体均由中国医学科学院提供;戊巴比妥钠(上海榕柏生物技术有限公司);万宝路牌香烟(湖南中烟工业有限责任公司);PI3K抑制剂LY294002(美国Sigma公司);RIPA细胞裂解液(普利莱基因技术有限公司);BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司);ECL化学发光试剂盒(上海碧云天生物技术有限公司);TRIzol试剂盒(美国Life technologies公司),cDNA反转录试剂盒(美国Sigma公司);Maxima SYBR Green qPCR Master Mix (2×)(美国ThermoFisher公司);鼠源HGF、Caspase-3、Bcl-2、PI3K、p-PI3K、Akt、p-Akt、β-actin抗体(英国Abcam公司);辣根过氧化物酶(Horseradish Peroxidase,HRP)标记的羊抗小鼠IgG抗体(上海荣盛生物技术有限公司),SDS-PAGE蛋白上样缓冲液(10×)(上海芳甸生物科技有限公司),TUNEL试剂盒(美国Promega公司),Apelin检测试剂盒(合肥莱尔生物科技有限公司)。
主要仪器:多参数肺功能检测系统(上海玉研科学仪器有限公司),动物多导生理记录仪(上海玉研科学仪器有限公司),UV-1900型紫外分光光度计(让奇(上海)仪器科技有限公司),实时荧光定量 PCR 仪(美国ThermoFisher),All-in-One 荧光显微成像系统 BZ-X(基恩士 (中国) 有限公司),倒置荧光显微镜(日本Olympus公司),蛋白电泳仪及转膜仪(美国Bio-Rad公司)。
二、实验方法
1 慢阻肺模型的建立及分组 40只C57BL/6J小鼠适应性喂养一周后,以随机数字表法分为对照组、模型组、HGF组、HGF+LY294002组,每组10只。除对照组小鼠给予等量生理盐水外,模型组、HGF组、HGF+LY294002组3组小鼠均参照文献[10]以香烟尘雾颗粒(Cigarette dust particles,DSP)经鼻腔滴入法建立慢阻肺小鼠模型。具体过程为:⑴制备DSP溶液:取除去滤嘴的3支万宝路牌香烟(焦油量:12 mg,烟气烟碱量:0.9 mg,烟气一氧化碳量:12 mg,烟长:84 mm),用装有1 mL蒸馏水的水烟斗(连接真空吸尘器)收集烟雾,水烟斗接口处用无菌棉花滤过,获得DSP溶液,无菌条件下吸取上述方法制备的 DSP 3 μL于2 mL 离心管中,加1 mL无菌生理盐水,混匀,配制成 3 mL/L DSP溶液。⑵DSP诱导慢阻肺模型:各组小鼠分别采用乙醚短暂麻醉,每天分别滴鼻3 mL/L DSP溶液,每只20 μL,连续滴鼻30 d。造模后观察到小鼠活动减少,呼吸急促,伴喘息、咳嗽,严重者听诊可闻及湿啰音,反应灵敏度变差,进食下降,体重逐渐减轻,肺组织HE染色病理切片显示肺部支气管壁增厚,管腔严重变形,肺部可见大量炎细胞浸润,肺泡结构紊乱,肺泡壁破裂,肺泡腔扩大,部分融合形成较大的囊腔,即为造模成功。
2 动物处理 模型建立成功后第2天,模型组小鼠气管内滴入不携带HGF基因的腺病毒2×109pfu/只,HGF 组小鼠气管内滴入携带 HGF 基因的腺病毒2×109pfu/只,HGF+LY294002组小鼠气管内滴入携带 HGF 基因腺病毒2×109pfu/只,同时尾静脉注射LY294002(2.0mg/kg),对照组小鼠气管内滴入同等剂量的等张力生理盐水。在相同条件下单笼饲养4周,肺功能指标及肺动脉压力指标检测结束后处死小鼠留取肺组织,一部分-80℃保存,一部分用4%多聚甲醛固定、石蜡包埋,备用。
3 肺功能及肺动脉压力检测 各组小鼠给予戊巴比妥钠(100 mg/kg)腹腔注射麻醉,将小鼠以仰卧位固定于手术台上,常规消毒颈部皮肤,剪开颈部皮肤,分离血管和肌肉,暴露主支气管,用镊子将缝合线置于气管底部,局部按压进行止血,以剪刀切开主气管小口,避免血液进入气管,置入气管插管,以缝合线固定后,连接多参数肺功能检测系统检测各组小鼠的潮气量(Tidal volume,TV)、呼气峰流速(Peak expiratory flow,PEF)、吸气峰流速(Peak inspiratory flow,PIF)、0.3秒用力呼气量(0.3 sec forced expiratory volume,FEV0.3),0.3秒用力呼气量与用力肺活量比(0.3 sec forced expiratory volume to forced vital capacity ratio,FEV0.3/FVC)。同时将充入2%肝素钠的聚乙烯导管经小鼠右侧颈部静脉插管右心至肺动脉干,连接压力换能器,稳定10 min后,采用动物多导生理记录仪记录各组小鼠平均肺动脉压(mean pulmonary arterial pressure,mPAP)。
4 ELISA测定肺组织Apelin水平 取各组小鼠肺组织匀浆标本,4 ℃低温下10000 r/min离心5 min,收集上清液,严格按照ELISA试剂盒说明操作检测Apelin水平,在紫外分光光度计上于450 nm处检测吸光(OD)值,根据样品OD值在标准曲线图上查出相应Apelin含量,乘以稀释倍数即可。
5 RT-PCR检测肺组织HGF mRNA表达 取各组小鼠肺组织样品0.02 g,加入Trizol试剂1 mL,液氮条件下将肺组织充分研磨,室温静置5 min提取RNA,应用紫外分光光度计测量RNA浓度,A260/280在1.8~2.1范围内即可。根据反转录试剂盒合成cDNA,进行RT-PCR反应检测HGF mRNA水平,RT-PCR反应体系为:Maxima SYBR Green qPCR Master Mix (2×)10 μL,10 μmol/L的上游引物和下游引物各0.5 μL,cDNA模板0.5 μL,加双蒸水(Water distillated two times,ddH2O)补充至20 μL。反应条件为:95 ℃预变性3 min,95 ℃ 30 s,60 ℃ 30 s,72 ℃ 1 min,进行40个循环,实验重复3次。HGF上游引物:5′-AGCTCAGAACCGACCGGCTTGCAACAGGAT-3′;下游引物:5′-TTACCAATGATGCAAT-TTCTAATATAGTCT-3′;内参β-actin上游引物:5′-TCTTCCAGCCCTCCTTCCTG-3′;下游引物:5′-CG-TTTCTGCGCCGTTAGGT-3′;采用2-△△Ct计算分析目的基因的相对表达水平。
6 Western blot检测肺组织HGF、Caspase-3、Bcl-2、PI3K、p-PI3K、Akt、p-Akt的蛋白表达 取各组小鼠肺组织样品0.02 g,充分研磨后,用RIPA细胞裂解液冰上裂解10 min提取总蛋白,采用BCA法测定总蛋白浓度。取适量裂解产物,上样后进行SDS-PAGE分离蛋白,电转至硝酸纤维素膜,用磷酸盐缓冲液(Phosphate buffer,PBS)洗3次,加入5 %脱脂奶粉封闭液,室温封闭1 h,PBST洗涤后加入HGF抗体(1 ∶500)、Caspase-3抗体(1 ∶500)、Bcl-2抗体(1 ∶500)、PI3K抗体(1 ∶500)、p-PI3K抗体(1 ∶500)、Akt抗体(1 ∶500)、p-Akt抗体(1 ∶500)和β-actin抗体(1 ∶5000)孵育,4 ℃过夜,用PBS洗膜3次,每次10 min,加入相应HRP标记的二抗(1 ∶1000),室温孵育1.5 h,洗膜3次,每次10 min,采用ECL化学发光液进行显影,图像分析系统分析统计目的蛋白相对表达量,实验重复3次。
7 TUNEL法检测细胞凋亡情况 取各组小鼠肺组织标本石蜡切片脱蜡水化,PBS彻底冲洗,滴加稀释后的蛋白酶 K 工作液,37 ℃反应30 min,平衡缓冲液孵育20 min,PBS洗涤3次,擦干切片周围缓冲液,加入50 μL TUNEL反应混合液,37℃避光反应 60 min,置于DAPI染色液中孵育30 min,前后PBS 冲洗 3 次,加50 μL DAB底物(×20),室温下反应10 min,苏木精复染3 min,然后脱水、透明、中性树胶封片,采用荧光显微镜观察采集图像,倍数为40*10倍。正常细胞核呈蓝色,细胞核呈绿色的细胞即为阳性细胞。每张切片随机选取 5 个视野拍照,计算细胞凋亡指数(AI),AI =凋亡细胞数/细胞总数×100%。
三、统计学分析
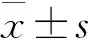
结 果
一、各组小鼠肺功能及肺动脉压力比较
与对照组比较,模型组小鼠肺功能指标TV、PEF、PIF、FEV0.3、FEV0.3/FVC水平均显著降低(P<0.05),mPAP水平显著升高(P<0.05);与模型组比较,HGF组小鼠肺功能指标TV、PEF、PIF、FEV0.3、FEV0.3/FVC水平均显著升高(P<0.05),mPAP水平显著降低(P<0.05);与HGF组比较,HGF+LY294002组小鼠肺功能指标TV、PEF、PIF、FEV0.3、FEV0.3/FVC水平均显著降低(P<0.05),mPAP水平显著升高(P<0.05)(见表1)。
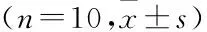
表1 各组小鼠肺功能及肺动脉压力比较
二、各组小鼠肺组织Apelin水平比较
各组小鼠肺组织Apelin水平均有显著性差异(F=18.461,P<0.001)。与对照组比较,模型组小鼠肺组织Apelin水平显著降低(P<0.001);与模型组比较,HGF组小鼠肺组织Apelin水平显著升高(P<0.05);与HGF组比较,HGF+LY294002组小鼠肺组织Apelin水平显著降低(P<0.05)(见图1)。
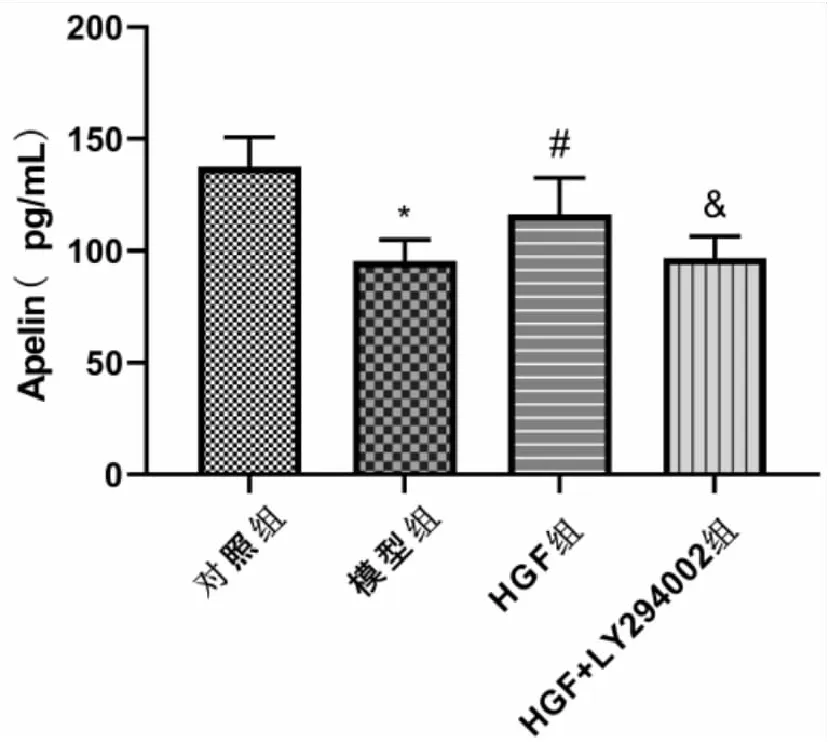
图1 各组小鼠肺组织Apelin水平比较
三、各组小鼠肺组织HGF mRNA和蛋白表达水平比较
各组小鼠肺组织HGF mRNA和蛋白表达水平均有显著性差异(F=16.735,P<0.001;F=15.081,P<0.001)。与对照组比较,模型组小鼠肺组织HGF mRNA和蛋白表达水平均显著降低(P<0.001;P<0.001),HGF组和HGF+LY294002组小鼠肺组织HGF mRNA和蛋白表达水平均显著升高(P<0.05);与模型组比较,HGF组和HGF+LY294002组小鼠肺组织HGF mRNA和蛋白表达水平均显著升高(P<0.05)(见图2A、B)。
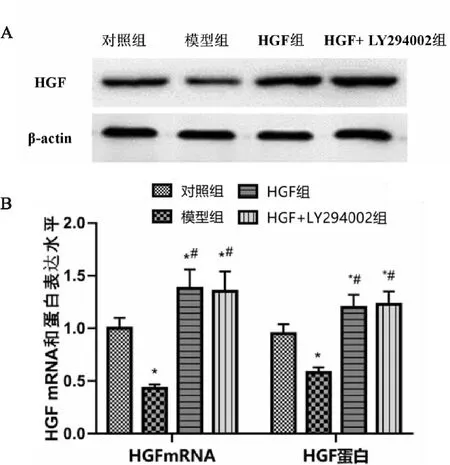
图2 各组小鼠肺组织HGF mRNA和蛋白表达水平比较
四、各组小鼠肺组织Caspase-3、Bcl-2蛋白表达水平比较
各组小鼠肺组织Caspase-3、Bcl-2蛋白表达水平均有显著性差异(F=21.468,P<0.001;F=20.726,P<0.001)。与对照组比较,模型组小鼠肺组织Bcl-2蛋白表达水平显著降低(P<0.001),Caspase-3蛋白表达水平显著升高(P<0.001);与模型组比较,HGF组小鼠肺组织Bcl-2蛋白表达水平显著升高(P<0.001),Caspase-3蛋白表达水平显著降低(P<0.001)。与HGF组比较,HGF+LY294002组小鼠肺组织Bcl-2蛋白表达水平显著降低(P<0.001),Caspase-3蛋白表达水平显著升高(P<0.001)(见图3A、3B)。
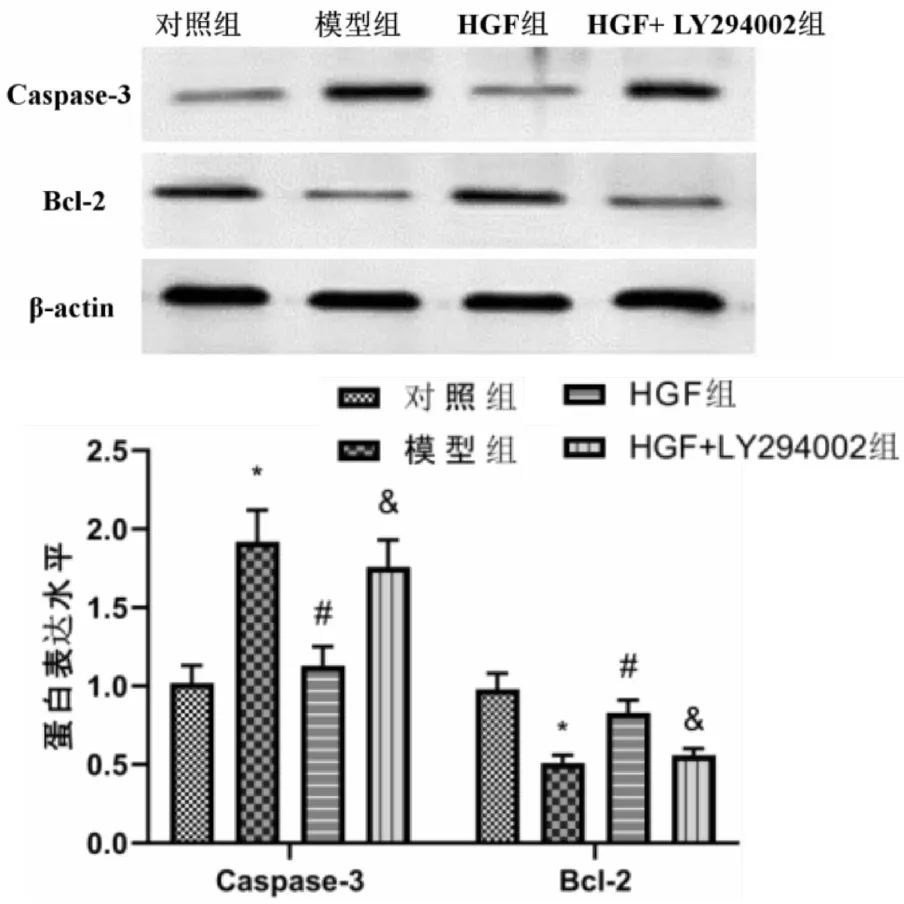
图3 各组小鼠肺组织Caspase-3、Bcl-2蛋白表达水平比较
五、各组小鼠肺组织PI3K、p-PI3K、AKT、p-AKT蛋白表达水平比较
各组小鼠肺组织p-PI3K/PI3K、p-Akt/Akt比值均有显著性差异(F=19.400,P<0.001;F=17.800,P<0.001)。与对照组比较,模型组小鼠肺组织p-PI3K/PI3K、p-Akt/Akt比值显著降低(P<0.001;P<0.001);与模型组比较,HGF组小鼠肺组织p-PI3K/PI3K、p-Akt/Akt比值显著升高(P<0.001;P<0.001);与HGF组比较,HGF+LY294002组小鼠肺组织p-PI3K/PI3K、p-Akt/Akt比值显著降低(P<0.001;P<0.001)(见图4A、4B、4C)。
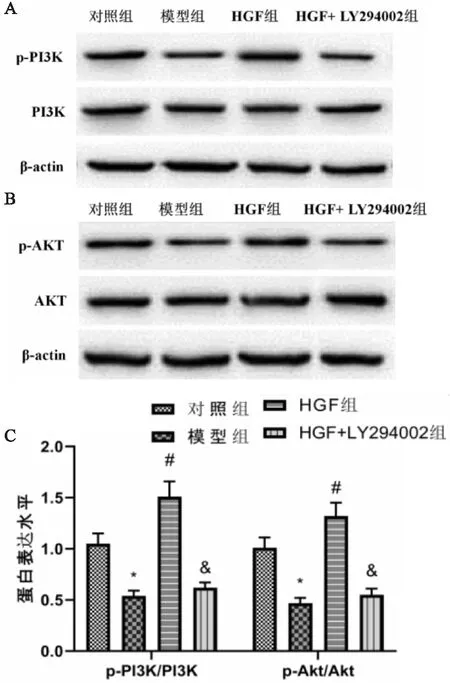
图4 各组小鼠肺组织PI3K、p-PI3K、AKT、p-AKT蛋白表达水平比较
六、各组小鼠肺组织细胞凋亡情况比较
各组小鼠肺组织AI均有显著性差异(F=31.667,P<0.001)。与对照组比较,模型组小鼠肺组织AI显著升高(P<0.001);与模型组比较,HGF组小鼠肺组织AI显著降低(P<0.001);与HGF组比较,HGF+LY294002组小鼠肺组织AI显著升高(P<0.001)(见图5A,5B)。
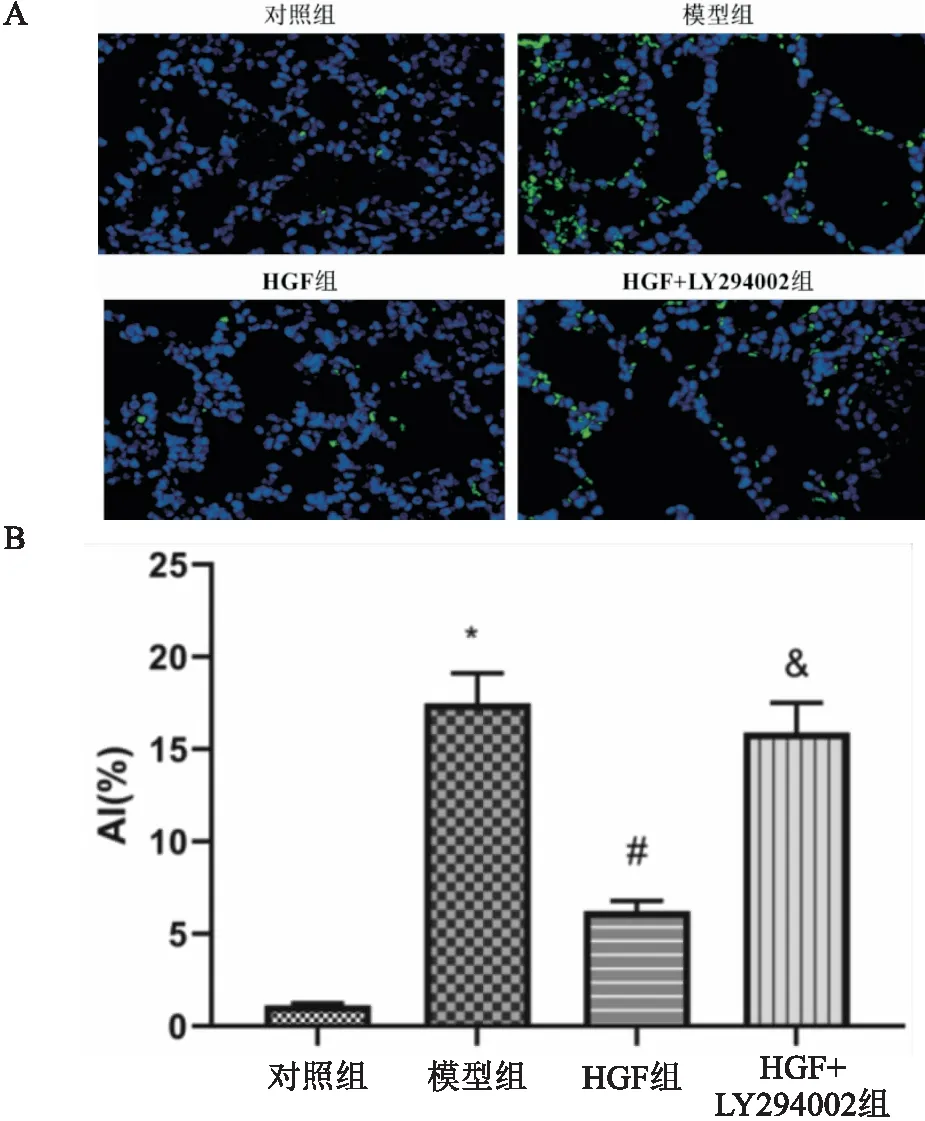
图5 各组小鼠肺组织细胞凋亡情况比较(×400)
讨 论
慢阻肺是一种呼吸系统常见病和多发病,慢阻肺发生会引起患者肺功能下降、肺动脉压力升高,进而引发一系列并发症,严重威胁患者生命健康,当前临床上该疾病以药物对症治疗为主,疗效有限,尚无明确治愈慢阻肺的有效措施[11]。HGF作为一种多效性生长因子,在肺部上皮细胞和间质细胞的相互作用中发挥着调节功能,同时,还可促进肺支气管上皮细胞增生和肺上皮组织形成[12]。已有研究报道,腺病毒介导的外源性HGF基因在慢阻肺修复中起一定作用[13]。但HGF作用于慢阻肺的分子机制尚不清楚。
TV、PEF、PIF、FEV0.3、FEV0.3/FVC是临床常用反映肺功能的重要指标,mPAP则是影响慢阻肺预后的重要因素,肺动脉压力越高,疾病病程越短,病死率越高,早期检测肺动脉压力并阻断PH形成,对慢阻肺的防治以及降低病死率具有指导意义。王伟等研究报道,携带外源性HGF基因的腺病毒经支气管滴入PH家兔模型,可有效降低肺动脉压力[14]。本研究通过DSP经鼻腔滴入法建立慢阻肺小鼠模型,探究HGF过表达对慢阻肺小鼠肺功能和肺动脉压力的影响,结果显示,HGF过表达,显著改善了慢阻肺小鼠TV、PEF、PIF、FEV0.3、FEV0.3/FVC,肺功能指标水平和mPAP水平。说明 HGF过表达对于改善慢阻肺疾病具有良好的效果。
慢阻肺继发PH疾病是慢阻肺患者急性加重甚至死亡的主要原因之一[15],目前临床认为慢阻肺继发PH疾病主要与肺血管内皮细胞受损相关,肺内皮细胞受损后,血管调节因子分泌异常,使得血管平滑肌促有丝分裂和抗有丝分裂失衡,导致血管收缩、重塑,肺动脉压升高[16]。Apelin是一种小分子活性多肽,亦是内源性血管舒张因子,对机体多种细胞和器官具有保护作用[17]。Kleinz等[18]检测发现Apelin主要存在于肺血管内皮细胞,其在调节肺血管循环稳态方面,具有特殊的生理病理意义。本研究发现慢阻肺小鼠肺组织中Apelin水平明显降低,HGF过表达可以有效增加小鼠肺组织Apelin分泌,进而调控肺血管循环状态,改善肺动脉压力。
大量临床研究表明细胞凋亡在慢阻肺发病机制中起着重要作用,一方面,慢阻肺患者肺内实质细胞及间质细胞过度凋亡会引起肺部结构发生改变,导致肺气肿形成;另一方面,肺内炎症细胞凋亡不足,促使过度激活、聚集致使肺部炎症持续加剧,最终损害气道及肺血管内皮功能,导致气道阻塞及PH发生[19]。PI3K/Akt信号通路是细胞存活、增殖、凋亡的重要信号转导途径。PI3K是一种能够影响细胞多种生物学功能的磷脂酰肌醇激酶,HGF可通过激活PI3K发挥生物学活性,PI3K调节亚基与HGF受体上磷酸化的酪氨酸残基结合,使PI3K磷酸化得以激活,进而促使PI3K配体Akt转移至质膜内侧,从而磷酸化多种蛋白,发挥调节细胞代谢、影响细胞生存等效应[20-22]。Bcl-2是一种典型的抗凋亡蛋白,在细胞凋亡的各种信号转导途径中起着重要的调控作用;有研究表明[23],细胞凋亡开始时Bcl-2向线粒体中释放信号,促进凋亡激活Caspase-3,导致DNA断裂,引起细胞骨架及内膜缺损,直至细胞凋亡。Caspase-3是Caspase家族成员发生级联式反应引起细胞凋亡的激活途径终点,属于各种凋亡刺激因子被激活的关键酶,其水平可反映细胞凋亡的严重程度[24]。本研究观察到慢阻肺小鼠肺组织中Bcl-2蛋白表达水平显著降低,Caspase-3蛋白表达水平显著升高。HGF过表达能够显著改善凋亡相关蛋白Bcl-2、Caspase-3蛋白表达水平,逆转慢阻肺小鼠肺组织细胞凋亡情况;同时,慢阻肺小鼠中HGF过表达能够促进PI3K/Akt信号通路相关分子磷酸化,而PI3K抑制剂LY294002干预后HGF过表达的作用效果消失,提示HGF通过激活PI3K/Akt信号传导途径发挥抗凋亡作用。
综上所述,HGF可通过增加肺组织Apelin分泌、抑制肺组织细胞凋亡达到改善慢阻肺小鼠肺功能和肺动脉压力的目的,其作用机制可能由PI3K/Akt信号通路介导。本研究为临床探索HGF治疗慢阻肺提供了新的靶点通路。本研究仅从PI3K/Akt信号通路方向研究了HGF对慢阻肺的作用效果,HGF可能通过其他信号途径发挥对慢阻肺的作用,还需进一步深入研究。
