姜酮纳米混合胶束的制备及其对高脂血症的调节作用
2022-01-20葛竹妹余江南徐希明
葛竹妹,余江南,徐希明
(江苏大学药学院,江苏 镇江 212013)
高脂血症是导致心脑血管疾病和非酒精性脂肪肝病的重要原因,我国约1.3亿人患有高血脂[1]。然而血脂异常的病因复杂,治疗较为困难,目前常用的降脂药如他汀类、贝特类、烟酸类等均可引起肝损害[2]。在中医学中,高脂血症属于“血瘀”“痰浊”的范围,患者由于饮食不节、体内湿热等而引起代谢不畅、气滞血瘀、脾虚痰浊等病症[3]。传统中药在高脂血症的防治中具有显著影响,主要是通过抗氧化、抑制外源性脂类、胆酸吸收及减少脂类物质在血管内皮的沉积等来发挥降脂作用[4]。生姜是一种不可或缺的传统中药材,因其无毒、安全、有效的活性而受到关注。新鲜的生姜根茎中有大量的生姜酚和少量的姜酮,其中姜酮具有广泛的药理活性,可以清除自由基[5],抗氧化[6],抑制脂质过氧化[7],抗炎[8],抗癌[9],止吐止泻[10]等。
近年来,纳米技术即胶束、聚合物纳米粒和纳米乳液等增加难溶性化合物的溶解度,进而应用于药代动力学的研究十分广泛。其中,胶束具有一种固有的结构,可同时负载水溶性药物和脂溶性药物,保护药物免受水相影响,增加药物的水溶性,以提高药物的生物利用度[11-12]。在混合胶束递送系统中,大量研究表明,基于脂质的胶束作为药物载体具有维持细胞膜流动性,增强药物吸收和增加疏水性药物生物利用度的能力[13-14],已广泛应用于多种药物的体内递送。因此,本研究通过研究四元纳米混合胶束这一类的纳米载体传递技术,以姜酮为原料药,制备姜酮纳米混合胶束(zingerone nano-mixed micelles,ZNMs),探讨体内和体外ZNMs对血脂的调节作用。
1 材料与方法
1.1 动物与细胞
35只雄性C57BL/6小鼠,体重18~22 g,6~8周龄,SPF级,序列号:UJS-IACUC-2019092603。本研究遵从国际有关动物实验和临床研究的基本伦理和准则,并通过江苏大学动物伦理委员会批准。人肝癌HepG2细胞株,购自中国科学院上海生科院细胞资源中心。
1.2 主要试剂与仪器
姜酮(江苏鸿曜生物科技有限公司);胆酸钠、磷脂、聚乙烯吡咯烷酮K30(PVP K30)、维生素E聚乙二醇琥珀酸酯(TPGS)、非诺贝特均为阿拉丁试剂有限公司产品;胎牛血清、胰蛋白酶均为美国Gbico公司产品;高糖DMEM(美国HyClone公司);三酰甘油(triglyceride,TG)试剂盒、总胆固醇(total cholesterol,TC)试剂盒、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)试剂盒、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)试剂盒、谷草转氨酶(aspartate aminotransferase,AST)试剂盒、谷丙转氨酶(alanine amino-transferase,ALT)试剂盒均购自南京建成试剂有限公司;油酸、棕榈酸均为美国Sigma公司产品;高脂饲料(基础饲料78.8%,胆固醇1%,胆盐0.2%,猪油10%,蛋黄10%)购自北京维通利华实验动物技术有限公司。
高效液相色谱仪(日本Shimadzu公司);BSA233S电子天平(北京赛多利斯有限公司);SHA-C水浴恒温振荡仪(上海华邻实业有限公司);KQ-500DE 超声波清洗仪(无锡超声电子设备公司);UNIQUE-R10超纯水机(锐思捷科学仪器有限公司);NanoBrook 90 Plus PLAS粒径电位仪(美国布鲁克海文仪器公司);旋转蒸发仪(上海亚荣生化仪器厂);JEM-1010型透射电子显微镜(日本电子公司);细胞培养超净台(苏州净化设备有限公司);倒置显微镜(日本Olympus公司);正置显微镜(日本Nikon公司)。
1.3 ZNMs处方设计
1.3.1 单因素试验 固定处方和工艺中部分因素不变,改变其中一种组成或工艺因素。根据文献[15],固定磷脂与胆酸钠总量为 150 mg。分别选用投药量、磷脂∶胆酸钠(m/m)、PVP K30、TPGS用量以及甲醇溶剂用量作为单因素,以样品粒径、多分散系数及包封率为指标,筛选出最佳因素水平。
1.3.2 正交设计优化处方组成 通过正交试验以优化筛选出最佳处方。以包封率为考察指标,按照正交设计原理选用L9(34)设计表进行实验。
1.4 ZNMs体外性质评价
1.4.1 表观形态 将制备的ZNMs通过0.22 μm微孔滤膜过滤后,取澄清滤液稀释至500 μg/mL。吸取20 μL稀释液滴于铜网,晾干后用2%磷钨酸染色处理。红外灯下至样品干燥后置于透射电镜下观察。
1.4.2 粒径与电位测定 ZNMs过0.22 μm微孔滤膜后,稀释至1 mg/mL。取3 mL置于比色皿中,用激光粒度分析仪测定ZNMs的zeta电位、粒径及其分布情况。
1.4.3 高效液相色谱测定包封率与载药量 取100 μL ZNMs,用色谱级甲醇稀释,过0.22 μm微孔滤膜以除去微量未包封的姜酮。用高效液相色谱分析确定药物含量,色谱柱:Symmetry C18(4.6 mm×150 mm,5 μm);流动相:甲醇∶超纯水=60∶40(V/V);流速:1 mL/min;检测波长:280 nm;温度:30 ℃;进样量:20 μL。载药量(%)=姜酮质量(g)/制剂总质量(g)×100%;包封率(%)=过滤后溶液中姜酮含量(g)/加入制剂中姜酮总含量(g)×100%。
1.4.4 芘荧光探针法测定临界胶束浓度 精密移取ZNMs适量至各容量瓶,将ZNMs溶液浓度分别稀释为8×10-1、4×10-1、2×10-1、8×10-2、4×10-2、2×10-2、8×10-3、4×10-3、2×10-3、8×10-4、4×10-4、2×10-4mg/mL。将配置好的不同浓度ZNMs分别加入含芘的棕色瓶中,超声30 min,避光过夜。用荧光分光光度计扫描350~500 nm处胶束光谱,固定激发波长为336 nm,记录373 nm和383 nm处荧光强度,用Origin软件分析I373∶I383与浓度对数值(lgC)的拟合结果。
1.4.5 ZNMs体外释放的测定 取ZNMs与姜酮原料药溶解于PBS,稀释至1 mg/mL后放进透析袋(分子量=3 500)中;恒温振荡器设定为37 ℃,100 r/min;于0.5、1、2、3、4、6、8、10、12 和 24 h不同时间点取样品 1 mL,并补充1 mL PBS。通过高效液相色谱法检测姜酮含量,计算姜酮原料药与ZNMs体外累积释放率,并作累积释放曲线图。
(2)解决脱模平台四角不平问题。①安排技术人员采用支垫方式对脱模平台四角进行调平,保证脱模时模具四角同时接触脱模台,使模具受力均匀,轨枕同步脱出。②对脱模平台四角水平情况进行定期复检,发现异常及时整改。通过对脱模平台四角进行调平,双块式轨枕脱出后挡肩位置的黑色印迹得到了有效控制,外力对轨枕挡肩的撕拉大为减小。
1.5 姜酮及ZNMs体外调节血脂作用
1.5.1 MTT法检测细胞增殖 HepG2细胞培养于含有10%胎牛血清的高糖DMEM,37 ℃、5% CO2培养箱中;当细胞贴壁生长达80%~90%时,消化接种于96孔板中;实验组更换不同浓度的姜酮及ZNMs(1,10,20,40,80,100 μg/mL)培养液;空白对照组用培养基处理。培养24 h后,弃培养基,PBS清洗1~2次;每孔加入20 μL MTT溶液(5 mg/mL),培养4 h;弃MTT溶液,每孔加入100 μL二甲亚砜溶液,摇床晃动3~5 min,直至蓝紫色结晶完全溶解;用酶标仪检测波长490 nm处光密度(D)值,细胞存活率(%)=实验组D值/空白组D值×100%。
1.5.2 建立高血脂细胞模型及分组 称取0.061 g油酸和0.028 g棕榈酸溶于含25%牛血清白蛋白的PBS中,振荡混匀,超声溶解后置于37 ℃水浴过夜,制得20 mmol/L油酸母液,过滤除菌后于4 ℃保存。细胞分为空白对照组、模型组、非诺贝特组(5 μmol/L)、姜酮低剂量组(20 μg/mL)、姜酮高剂量组(100 μg/mL)、ZNMs低剂量组(20 μg/mL)及ZNMs高剂量组(100 μg/mL);空白对照组用新鲜的高糖DMEM,其余组用含有0.6 mmol/L油酸培养基,培养诱导24 h,建立细胞高血脂模型;空白对照组更换新鲜培养基,模型组更换油酸培养基,其他各组给药培养24 h。
1.5.3 油红O染色检测血脂调节作用 取“1.5.2”不同组处理后的高血脂细胞,用PBS洗涤3次;4%多聚甲醛固定30 min;洗涤,加入60%异丙醇,静置5 min;用新稀释的油红O溶液染色15 min;60%异丙醇洗涤1 min;超纯水冲洗并用苏木素复染30 s。荧光显微镜观察,并拍照。
1.5.4 生化指标检测 取“1.5.2”不同处理组细胞,弃培养液,PBS洗涤3次,留少许PBS;用细胞刮轻轻刮下细胞,收集至离心管中,1 000 r/min离心8 min;加入500 μL PBS悬浮细胞于EP管中,于液氮和室温下反复冻融裂解细胞;室温12 000 r/min离心20 min,取上清液。按照试剂盒说明书检测TG、TC、HDL-C及LDL-C。
1.6 姜酮及ZNMs体内调节血脂作用
1.6.1 建立小鼠高血脂模型及分组 取35只C57BL/6雄性小鼠,适应性饲养3 d。按随机数字表法将其分为7组,每组5只,即空白对照组、模型组、非诺贝特组(0.4 mL/20 g)、姜酮低剂量组(100 mg/kg)、姜酮高剂量组(400 mg/kg)、ZNMs低剂量组(100 mg/kg)及ZNMs高剂量组(400 mg/kg)。除空白对照组予以常规饲料喂养,其他组予以高脂饲料喂养,建立小鼠高血脂模型,连续喂养4周;空白对照组予以常规饲料喂养,模型组予以高脂饲料喂养,其他组连续灌胃给药8周。
1.6.2 称重 造模期间,每周称1次体重。给药期间,于每周的相同时间称体重1次。
1.6.3 血样采集与测定 各组小鼠禁食24 h不禁水,称重后眼球取血0.5 mL置于肝素管,3 500 r/min离心10 min,取上层血浆;脱颈处死小鼠并解剖,取肝脏称重并计算肝脏指数。肝脏指数(%)=肝脏湿质量(g)/小鼠体质量(g)×100%。按试剂盒说明书检测各组小鼠血浆中TG、TC、LDL-C、HDL-C、AST、ALT等指标。
1.7 统计学分析
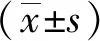
2 结果
2.1 ZNMs最优处方设计
2.1.1 单因素试验 由表1可知,姜酮投药量在20~40 mg时粒径较小且稳定性良好,包封率高;当m磷脂∶m胆酸钠=3∶2时包封率最高,但是粒径较大且多分散系数大,所以稳定性较差。同时,磷脂用量增加会降低胶束中姜酮的包封率,不利于胶束体系保持稳定。因此,m磷脂∶m胆酸钠的比例宜选用m胆酸钠>m磷脂;采用3种不同剂量的甲醇溶剂制备的ZNMs粒径及稳定性均良好,且包封率较为接近,所以甲醇溶剂的用量对制备ZNMs的影响不大。
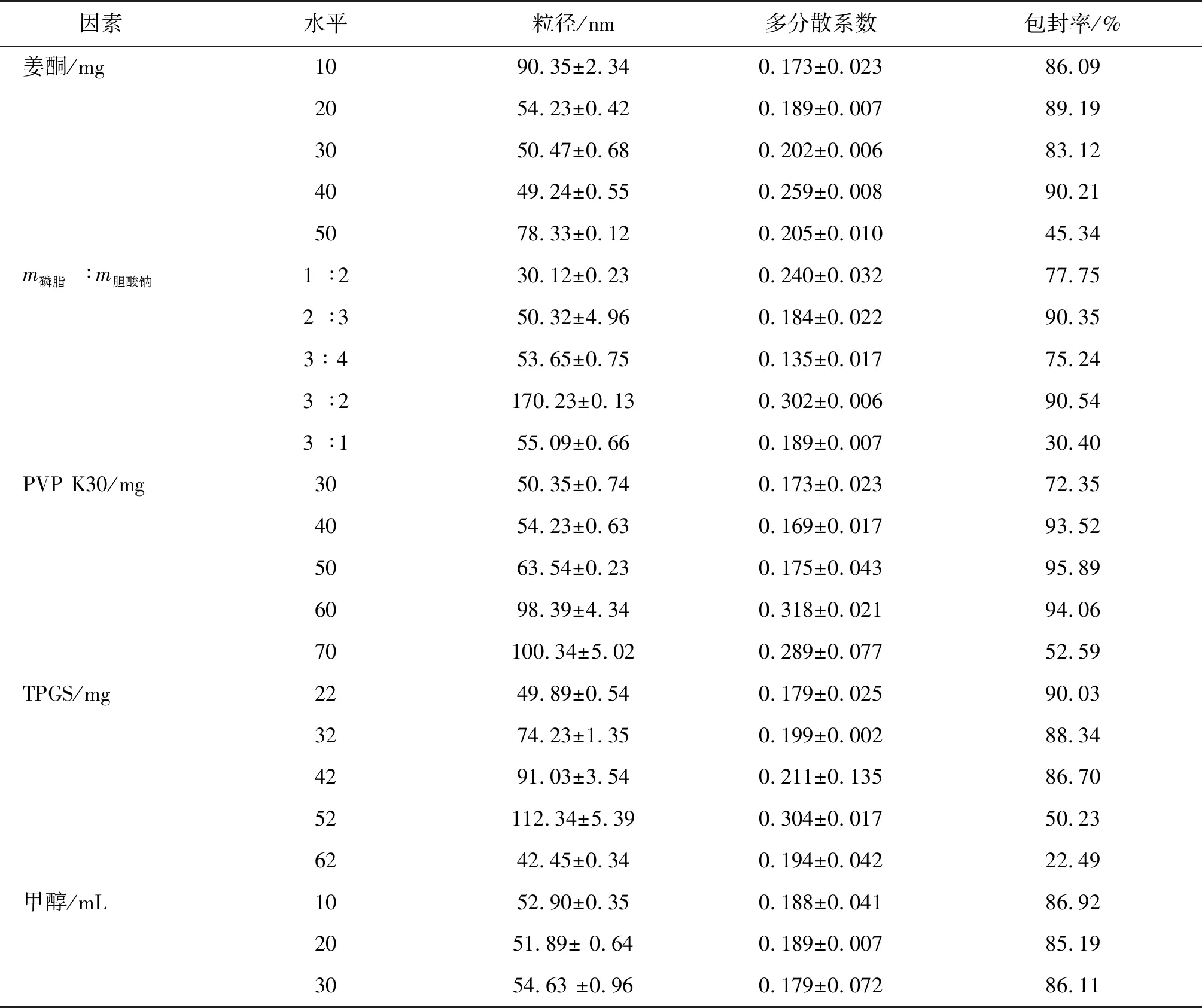
表1 单因素试验考察结果
2.1.2 正交设计优化处方组成 在完成单因素试验基础上进行正交试验,如表2所示为各影响因素及因素水平取值。比较各因素极差R值(表3)可知,各影响因素对包封率的影响依次为 A>B>D>C。因素A极差最大,为主要因素,因素C极差最小,为最次要因素,所以C可以作为误差项。方差分析结果显示,A、B、D 因素对ZNMs包封率的结果有显著影响,最优工艺确定为 A3B2C1D3,即投药量为40 mg,m磷脂∶m胆酸钠=2∶3,PVP K30用量为30 mg,TPGS用量为22 mg。各因素水平之间的差别行方差分析,结果表明,A、B、D 因素对提取结果有显著影响,见表4。

表2 影响因素及水平
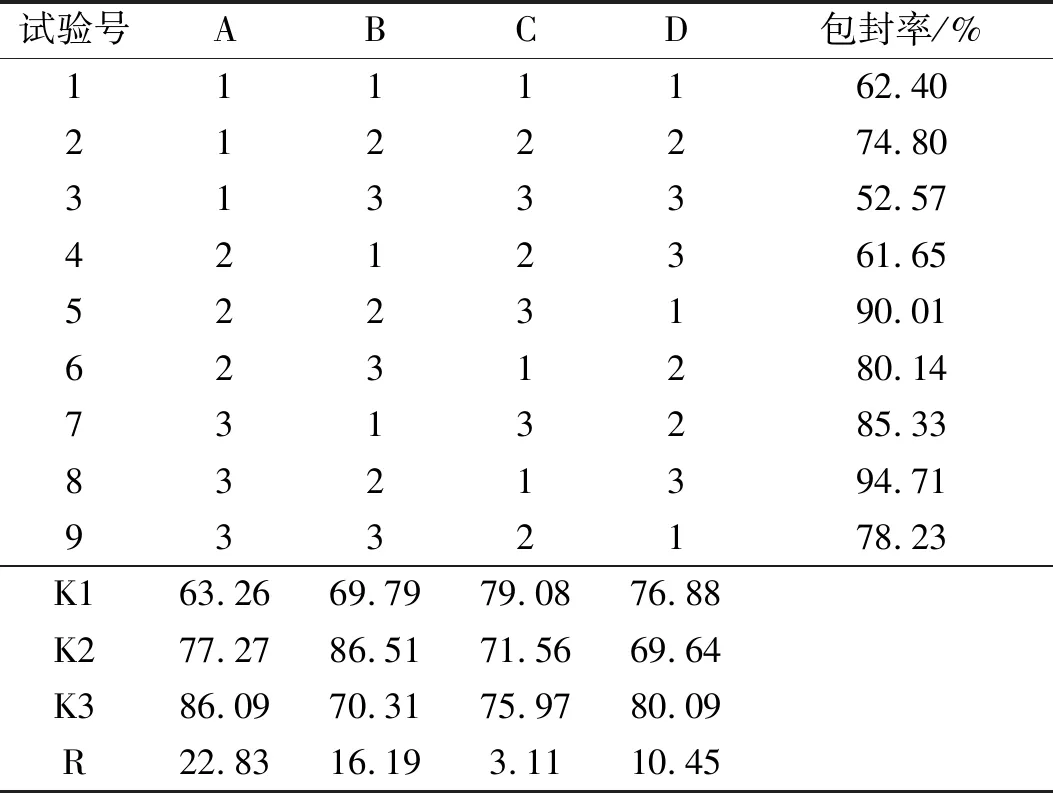
表3 正交试验结果

表4 正交试验结果方差分析
2.2 ZNMs体外性质评价
2.2.1 ZNMs表征结果 ZNMs可在水化作用下形成澄清透明的溶液,纳米混合胶束作为姜酮的载体可以使其溶解于水中。图1透射电镜结果显示,ZNMs形状规整,成均匀球形胶束包载药物。制备所得的ZNMs粒径为(50.62±0.25)nm,多分散指数为0.168±0.006,zeta电位值为(-28.07±0.33)mV。ZNMs含量测定的标准曲线为Y=18 790X+9 426.2(R2=0.996),计算得出ZNMs的包封率和载药量分别为(94.71±2.02)%和(4.58±0.06)%。

图1 ZNMs透射电镜图
2.2.2 临界胶束浓度测定 在极性条件下,芘在383 nm处强度最大;在非极性条件下,芘在373 nm强度较大;荧光强度之比对自身周围条件极其敏感,用于确定表面活性剂的临界胶束浓度[16]。从图2可以得出ZNMs对应的lgC值,经计算ZNMs临界胶束浓度为3.12×10-2mg/mL。已有研究测定二元混合胶束的临界胶束浓度为6.28×10-2mg/mL,ZNMs的临界胶束浓度小于二元混合胶束,说明ZNMs在稀释过程中具有更好的热力学稳定性[17]。

图2 I373∶I383与浓度对数值的拟合曲线
2.2.3 ZNMs体外释放曲线 姜酮与ZNMs体外释放结果如图3所示,姜酮在溶液中的累积释放率约为42%;ZNMs在PBS溶液中24 h累积释放率达到84%,在6~24 h内表现为缓慢释放,未出现突释效应。由此表明,纳米胶束体系对姜酮起到较好的增溶效果,可极大加速姜酮的体外释药。

图3 姜酮与 ZNMs体外释放曲线
2.3 ZNMs的体外血脂调节作用
2.3.1 姜酮和ZNMs细胞增殖实验 细胞增殖率检测结果显示(图4),不同浓度姜酮和ZNMs作用于HepG2细胞24 h后,对细胞活力影响不大,未出现显著性变化。由此可见,二者浓度在1~100 μg/mL范围时,对细胞存活率无显著影响,说明ZNMs符合药物制剂安全、低毒的条件,满足后续实验需要。

图4 不同浓度姜酮和ZNMs对 HepG2 细胞活性的影响
2.3.2 油红O染色检测血脂调节作用 油红O是一种脂溶性染料,广泛用于三酰甘油和脂质的鉴定和定量[18]。如图5所示,模型组带有泛红色表明肝细胞已有脂质蓄积。随着姜酮和ZNMs浓度增加,姜酮组和ZNMs组油红O阳性面积逐渐减少;姜酮和ZNMs高剂量组油红O阳性面积均分别高于相对应的低剂量组。与模型组相比,ZNMs高剂量组油红O阳性面积明显减少,表明ZNMs高剂量使脂质在肝细胞中的蓄积水平有效降低。

图5 各组细胞油红O染色结果(×100)
2.3.3 生化指标检测结果分析 如图6所示,与空白对照组相比,模型组细胞中TG、TC和LDL-C水平显著增高(P均<0.01),而HDL-C水平明显降低(P<0.01),表明油酸成功诱导细胞脂质蓄积模型。与模型组相比,ZNMs组TG、TC和LDL-C明显降低(P<0.05或P<0.01),HDL-C水平显著升高(P<0.05或P<0.01);与ZNMs低剂量相比,ZNMs高剂量组TG、TC和LDL-C降低且HDL-C升高;与姜酮高、低剂量组相比,ZNMs高、低剂量组各指标均优于姜酮组;ZNMs高剂量组结果接近阳性对照非诺贝特组;由此表明,ZNMs可有效调节细胞内脂质蓄积,ZNMs调节脂质蓄积效果优于姜酮组,其中ZNMs高剂量组调节水平最有效。
2.4 ZNMs对体内血脂的调节作用
2.4.1 对高脂小鼠体重及肝脏指数的影响 如表5和图7所示,模型组小鼠体重、肝脏重量和肝脏指数较空白对照组显著增加(P<0.01),表明建模成功。与模型组相比,第8周ZNMs高剂量组和姜酮高剂量组小鼠体重和肝脏重量明显降低(P均<0.01);ZNMs组肝脏指数均低于模型组(P<0.05或P<0.01),表明ZNMs和姜酮均可以降低小鼠体重及减少内脏脂肪的蓄积。此外,阳性对照非诺贝特组肝脏重量及指数与模型组无明显差异,说明非诺贝特引起肝脏肥大,有肝脏毒副作用。
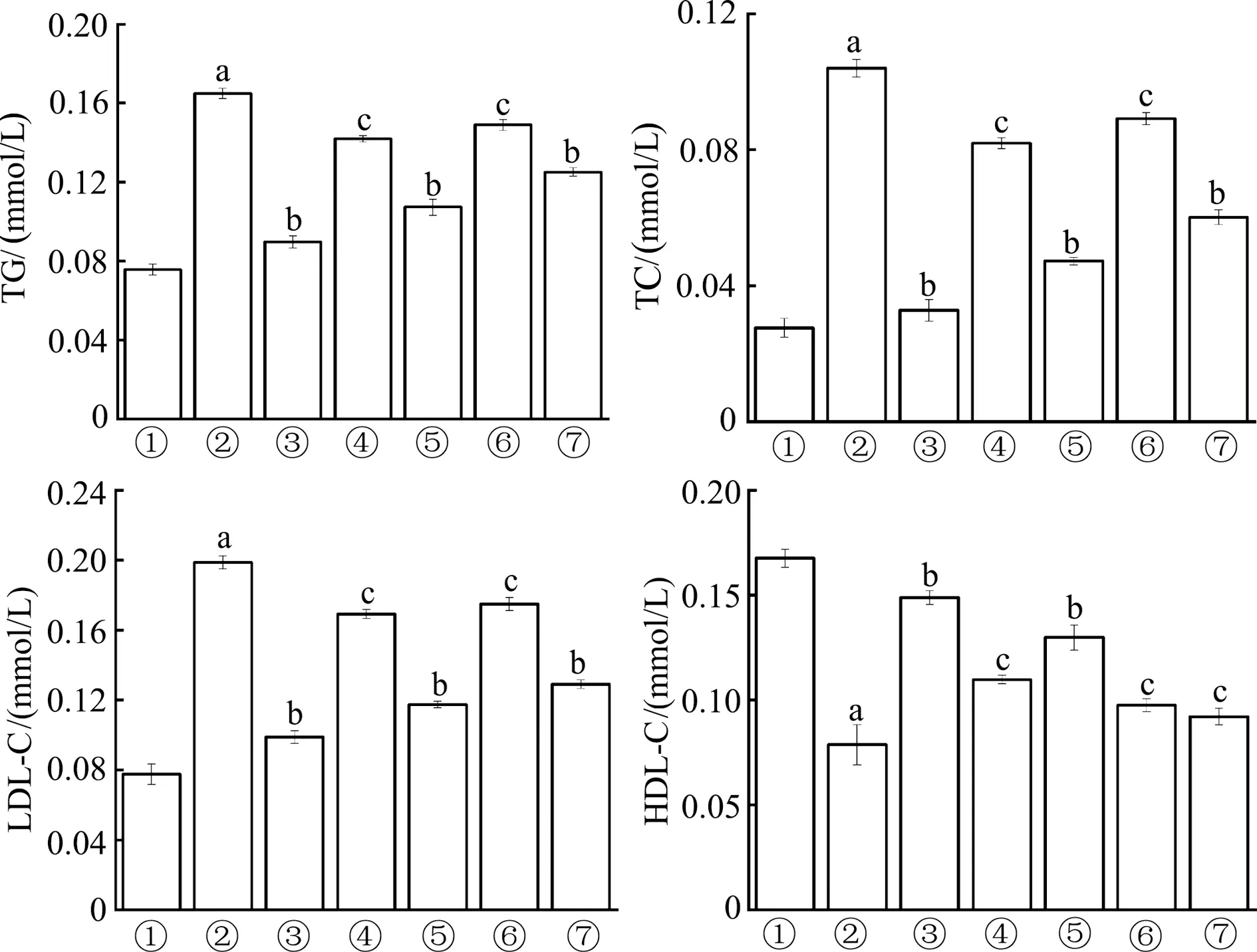
①:空白对照组;②:模型组;③:非诺贝特组;④:ZNMs低剂量组;⑤:ZNMs高剂量组;⑥:姜酮低剂量组;⑦:姜酮高剂量组。a:P<0.01,与空白对照组相比;b:P<0.01,c:P<0.05,与模型组相比图6 各组细胞血脂相关指标比较

表5 姜酮及ZNMs对高脂血症小鼠肝脏指数的影响
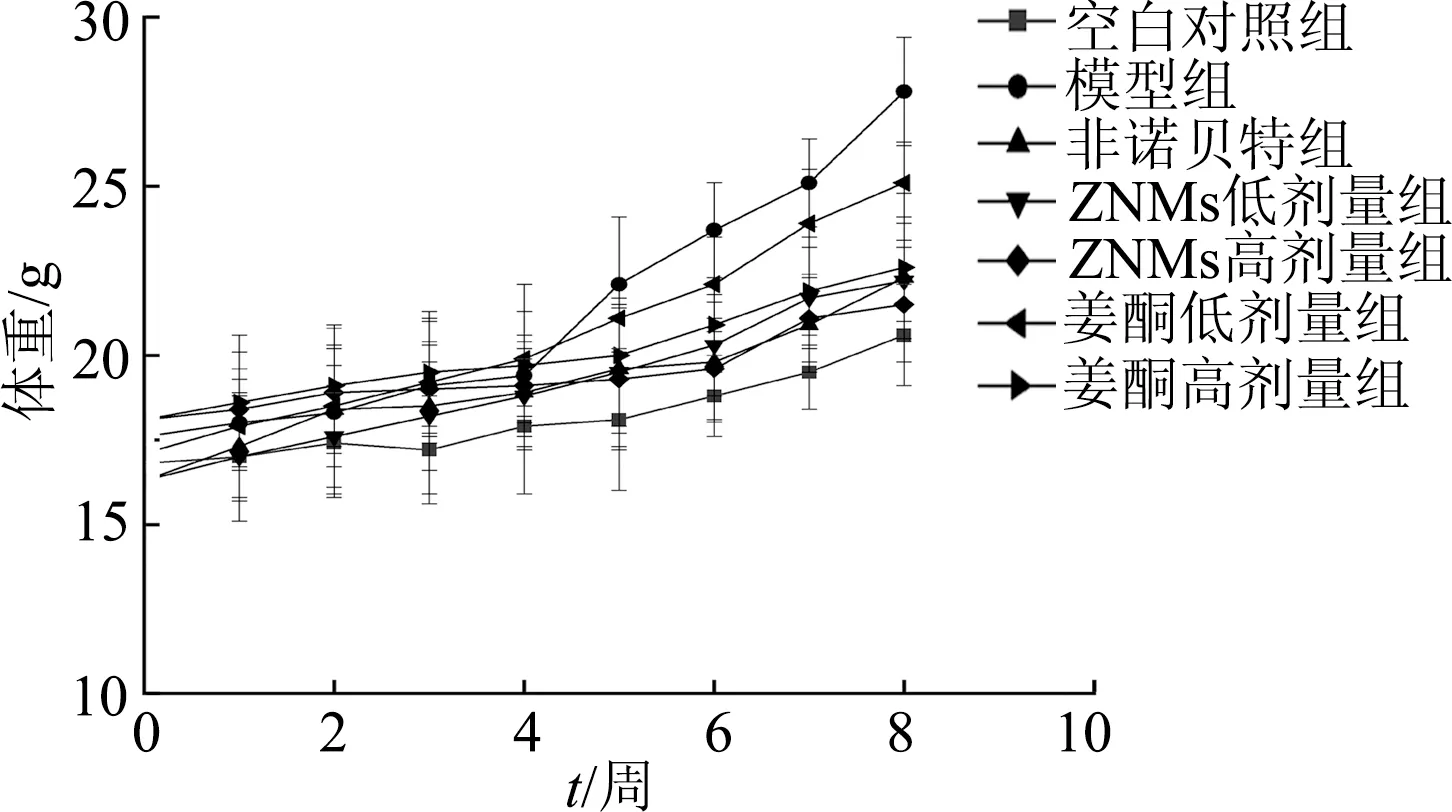
图7 各组小鼠体重变化比较
2.4.2 生化指标检测结果分析 如图8所示,与空白对照组相比,模型组TG、TC和LDL-C水平显著升高(P均<0.01),HDL-C水平显著降低(P<0.01),说明高血脂小鼠模型造模成功。与模型组相比,非诺贝特组、ZNMs组和姜酮组TG、TC和LDL-C水平均显著降低(P<0.05或P<0.01),HDL-C水平显著升高(P<0.05或P<0.01);与ZNMs低剂量相比,ZNMs高剂量组TC、TG和LDL-C降低,HDL-C升高;ZNMs各组指标均优于姜酮组,其中ZNMs高剂量组调节血脂相关指标接近阳性对照药非诺贝特,表明ZNMs可以有效调节高脂小鼠血脂,并且ZNMs调节血脂效果优于姜酮。此外,非诺贝特组血浆中ALT和AST水平明显高于空白对照组,ZNMs组血浆中ALT和AST较空白对照组无明显变化,说明阳性对照药非诺贝特会导致肝损伤病变,ZNMs能降低药物对肝脏组织的毒副作用。
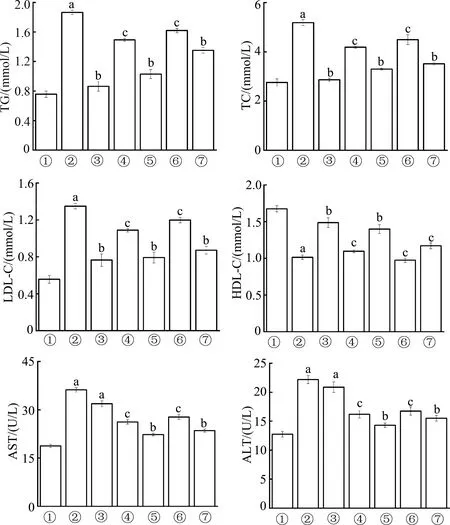
①:空白对照组;②:模型组;③:非诺贝特组;④:ZNMs低剂量组;⑤:ZNMs高剂量组;⑥:姜酮低剂量组;⑦:姜酮高剂量组。a:P<0.01,与空白对照组相比;b:P<0.01,c:P<0.05,与模型组相比图8 各组高脂血症小鼠血浆血脂相关指标比较
2.4.3 肝脏组织HE染色 如图9所示,肝脏组织HE染色表现出不同程度的脂肪变性。空白对照组可见丰富细胞质和突出核的肝细胞。其余组肝组织表现出广泛的球囊病变和典型高脂特征。与模型组相比,ZNMs高剂量组肝细胞未出现明显的变性、肿胀和坏死等现象,表明肝结构基本正常。然而,阳性对照药非诺贝特组肝脏细胞边界模糊化,出现细胞空泡化和肿胀样改变并伴有炎性细胞浸润现象,说明非诺贝特可引起肝脏损伤。
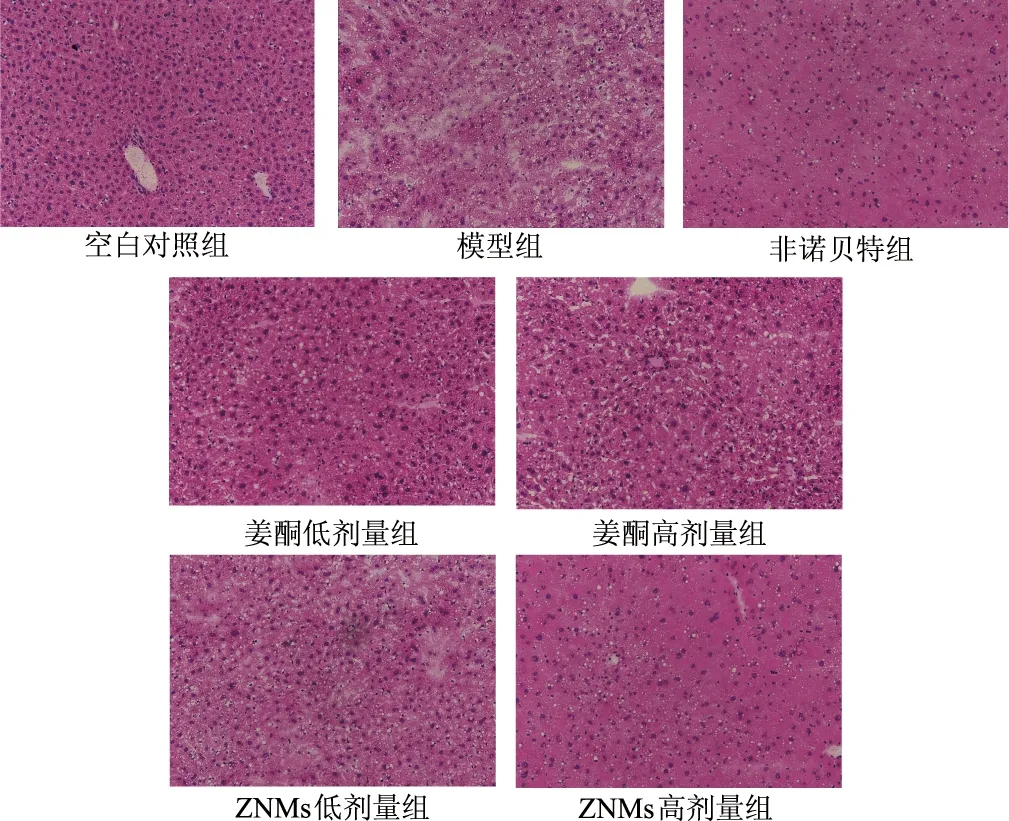
图9 各组小鼠肝脏组织HE染色(×200)
3 讨论
本研究在二元混合胶束的基础上加入PVP K30和TPGS,采用薄膜分散法制备磷脂-胆酸钠-PVP K30-TPGS四元纳米混合胶束包载难溶性成分姜酮。首先通过单因素试验筛选影响ZNMs包封率和粒径的因素,再以包封率为考察指标设计正交试验,筛选出ZNMs的最优处方。通过对优化条件进行质量评价,结果表明ZNMs形态圆整、粒径均一。在纳米药物递送系统中,粒径是评估纳米制剂质量的重要指标,粒径小能够促进药物在体内的释放和吸收[15]。本研究中ZNMs粒径约为(50.62±0.25)nm,粒径小且分散性良好,可促进姜酮释放;此外,实验中测得ZNMs具有较高的包封率和载药量,表明大量姜酮已成功整合到ZNMs中。在ZNMs释放药物研究中,与姜酮相比,ZNMs累积释放率相对较高,表明姜酮溶解性得到改善。ZNMs纳米级粒径在一定程度上促进药物释放速率。另外,由于制备ZNMs中的TPGS极性相对较大,促进ZNMs更容易向水相介质中迁移,从而加强ZNMs累积释放率[19-20]。
在调节高脂血症实验中,给药组分为ZNMs高低剂量组、姜酮高低剂量组和阳性对照药非诺贝特组[21],以考察姜酮制备成ZNMs调节高脂血症的药效。结果表明,与模型组相比,ZNMs组小鼠体重和肝脏重量明显下降,肝脏指数显著降低;ZNMs组细胞和小鼠血浆中TC、TG和LDL-C均明显降低,血浆中HDL-C显著升高;其中,ZNMs高剂量组与阳性对照药非诺贝特调节血脂水平接近,说明ZNMs调节血脂能力显著提高,可有效发挥抗高血脂作用。与ZNMs低剂量相比,ZNMs高剂量组各指标优于低剂量组,此外,与姜酮组相比,ZNMs各组肝脏细胞状态、调节血脂指标均优于对应的姜酮各组,表明ZNMs组的治疗效果优于姜酮组,ZNMs提高了姜酮的抗高血脂能力。通过HE染色切片观察到非诺贝特组小鼠肝脏细胞边界模糊化,出现细胞空泡化和肿胀样改变并伴有炎性细胞浸润现象,同时非诺贝特组小鼠血浆中AST和ALT水平高于正常组,表明小鼠肝脏出现损伤,非诺贝特对肝脏有毒副作用;ZNMs组肝脏细胞未出现明显的变性、肿胀和坏死等现象,说明ZNMs具有保肝活性,毒副作用大大降低。
综上所述,本研究制备的ZNMs具有性质稳定,生物相容性良好,毒副作用低的特性,在增强姜酮调节高血脂作用的同时,能降低其肝脏毒副作用。然而目前关于ZNMs调节高血脂具体作用机制以及体内药物动力学的研究并不完善,还有待后续研究进一步探索。
