穿心莲内酯对人乳腺癌细胞迁移和侵袭的抑制作用
2022-01-20傅鹤秀鹿蓓蓓陈秋云高静
傅鹤秀,鹿蓓蓓,陈秋云,高静
(江苏大学 1.药学院,2.化学化工学院,江苏 镇江 212013)
三阴性乳腺癌是一类雌激素受体、孕激素受体和人表皮生长因子受体表达均为阴性的特殊乳腺癌类型[1],由于肿瘤异质性高且缺乏有效治疗靶点,极易发生迁移复发,是预后最差、致死率最高的一种乳腺癌类型[2-3]。在正常细胞中,葡萄糖转化生成的丙酮酸进入线粒体,通过丙酮酸脱氢酶(pyruvate dehydrogenase,PDH)氧化脱羧生成乙酰辅酶A进入三羧酸循环,为细胞提供能量,而在肿瘤细胞中,葡萄糖转化生成的丙酮酸大部分会生成乳酸维持肿瘤细胞内环境的稳态[4]。尤其在具有迁移性的癌细胞中,糖酵解产生的大量乳酸最终排出胞外,堆积形成肿瘤生长局部的酸性环境,利于其自身对周围组织的侵袭和浸润性生长[5]。近年研究发现,位于线粒体内膜上的解偶联蛋白-2(uncoupling protein-2,UCP2)在肿瘤的代谢中发挥重要作用。有研究表明,通过转染构建稳定高表达UCP2的结肠癌HCT116细胞,与空白转染组相比,转染组细胞产生了更多的乳酸[6];此外,当UCP2被激活时,可以产生质子渗漏,降低线粒体在呼吸时形成的H+梯度,使氧化磷酸化解偶联,ATP合成降低,导致细胞代谢中的能量以钠泵的途径消耗和以热能的形式释放出来[7],可见UCP2在癌细胞中起到调节能量代谢的作用。
穿心莲内酯(Andrographolide)是一种从药用植物穿心莲(Andrographispaniculata)中分离出的二萜内酯,具有抗炎[8-9]、肝保护[10]和抗感染[11]作用。近年来,穿心莲内酯的抗癌作用引起研究者的广泛关注[12-13],在抑制肿瘤迁移与侵袭方面,穿心莲内酯能够通过促细胞凋亡抑制肾细胞癌786-0细胞的迁移能力[14];对于胃癌细胞来说,穿心莲内酯可能通过增加基质金属蛋白酶(MMPs)抑制剂的表达并降低MMPs的表达和活性来抑制其增殖和迁移[15];在以往研究中,穿心莲内酯主要通过抑制MMPs来抑制三阴性乳腺癌细胞的迁移与侵袭[16]。本文旨在研究穿心莲内酯是否可以通过调节UCP2抑制三阴性乳腺癌细胞的迁移与侵袭能力。
1 材料与方法
1.1 主要材料与试剂
穿心莲内酯(江西青峰药业);DMEM培养基(美国Gibco公司);胎牛血清(杭州四季青生物);二甲亚砜(DMSO,国药集团化学试剂有限公司);青霉素、链霉素(新赛美生物科技有限公司);Matrigel胶(美国Corning公司);TBST(北京索莱宝科技有限公司);甲基噻唑基四唑(MTT,美国Amresco公司);JC-1探针(德国Sigma-Aldrich 公司);Trizol试剂(美国Ambion公司);PrimeScriptTMRT Master Mix(日本TaKaRa公司);SYBR Green染料(北京天根生化科技有限公司);BeyoClickTMEdU-488试剂盒(上海碧云天生物公司);乳酸检测试剂盒(南京建成生物工程研究所);β-肌动蛋白小鼠单克隆抗体、UCP2兔单克隆抗体(上海碧云天生物公司);PDH兔单克隆抗体(美国Cell Signaling Technology公司);山羊抗小鼠IgG二抗、山羊抗兔IgG二抗(武汉三鹰生物公司);乳腺癌MDA-MB-231细胞购于上海中乔新舟公司。
1.2 仪器
细胞培养箱(上海赛默飞公司);SW-CJ-2FD型双人超净工作台(上海苏净实业有限公司);Mini-PROTEIN 3电泳系统、Bio-RAD 525电泳仪(美国Bio-RAD公司);TS100 Nikon 倒置相差显微镜、Ti-E显微镜活细胞工作站(日本Nikon公司);Spectra MaxGemini酶标仪(美国Molecular Device公司);Sigma 1-13高速台式离心机(德国Sigma公司)。
1.3 药物处理
称取适量穿心莲内酯,用DMSO稀释成100 mmol/L的母液,保存于4 ℃冰箱,母液仅可使用1周。进行实验时,将母液用培养基稀释1 000倍后配成需要的药物浓度进行细胞处理。
1.4 MTT法检测MDA-MB-231细胞活力
将MDA-MB-231细胞(5×104/mL)接种于96孔板中,每孔100 μL细胞悬液,待贴壁后给药组分别加入不同浓度穿心莲内酯(0,5,10,20,40和80 μmol/L),对照组仅更换培养基,继续培养24 h,每孔加入100 μL的 MTT溶液(1 g/L)继续培养4 h,弃上清液,每孔再加入100 μL的DMSO,放置摇床直至蓝紫色结晶消失,并使用酶标仪在562 nm处测量光密度(D)值,计算细胞存活率。细胞存活率(%)=(D给药组-D空白组)/(D对照组-D空白组)×100%
1.5 BeyoClickTM EdU-488试剂盒检测细胞增殖能力
将处于对数生长的细胞(5×104/mL)接种于24孔板中,每孔500 μL,培养24 h,待贴壁后分别加入不同浓度穿心莲内酯(0,5,10,20,40和80 μmol/L),继续培养24 h,给药结束后用移液枪将24孔板中原有培养基吸掉375 μL后加入 125 μL EdU工作液,37 ℃、5% CO2培养箱孵育2 h后,去掉板内的培养基,加入1 mL 4%的多聚甲醛室温固定15 min。每孔加入1 mL洗涤液洗涤细胞3次,每次3~5 min,再加入1 mL通透液,室温孵育15 min。再次洗涤细胞后每孔加入100 μL的Click反应液室温避光孵育30 min。用移液枪吸除Click反应液,洗涤细胞后每孔加1×Hoechst 33342溶液250 μL,室温避光孵育10 min。再次洗涤后每孔加入500 μL PBS,将24孔板置于倒置荧光显微镜下拍照,以荧光强度反映细胞增殖情况。
1.6 伤口愈合实验检测细胞迁移能力
将处于对数生长的细胞(5×104/mL)接种于6孔板中,待其铺满皿底后用10 μL移液管尖端制成恒定宽度的划痕,用PBS洗涤细胞2次以除去悬浮的细胞,不同浓度穿心莲内酯(0,10,20,40 μmol/L)作用于细胞,分别在给药后0,12,24 h于倒置显微镜下拍照,计算不同时间的划痕宽度。Δ划痕宽度(μm)=0 h划痕宽度(μm)-12 h或24 h划痕宽度(μm)。
1.7 Transwell小室实验检测细胞侵袭能力
取不同浓度穿心莲内酯(0,10,20,40 μmol/L)处理24 h后的细胞,用无血清DMEM培养基稀释的细胞混悬液作为上室,每小室加200 μL,预先用Matrigel凝胶覆盖板底的24孔板作为下室,每孔加500 μL含10% FBS DMEM培养基,37 ℃孵育24 h后取出 Transwell 小室,弃去孔中培养液,PBS洗2遍,用棉签轻轻擦掉上层未迁移细胞,再用4%多聚甲醛固定30 min,0.1%结晶紫染色1 h,PBS清洗至溶液澄清,高倍显微镜下每个浓度选择5个视野计数并取平均值,计算经不同浓度穿心莲内酯作用后,侵入到下室的细胞数。
1.8 蛋白质印迹检测细胞UCP2和PDH蛋白水平
用不同浓度的穿心莲内酯(0,10,20,40 μmol/L)处理后提取细胞总蛋白,进行蛋白定量后,加入5×SDS凝胶上样缓冲液,煮沸5 min。将等量的蛋白质进行15% SDS-PAGE,并将分离的蛋白质迁移到PVDF膜上。使用脱脂奶粉(5%)将膜封闭1 h,并将UCP2及PDH抗体以1∶ 1 000稀释度4 ℃过夜,TBST洗3次,二抗室温孵育1 h,TBST 清洗3次,ECL发光液发光,Minichemi 发光成像仪曝光,并使用Quantity One软件分析蛋白相对灰度值。
1.9 RT-PCR检测细胞UCP2 mRNA表达
使用Trizol试剂提取总RNA,用PrimeScriptTMRT Master Mix进行逆转录。按照说明书操作,使用SYBR Green染料进行RT-PCR。引物序列如下,GAPDH上游:5′-CAGGAGGCATTGCTGATGAT-3′,下游:5′-GAAGGCTGGGGCTCATTT-3′;UCP2上游:5′-GTGGTCAAGACGAGATACATGA-3′,下游5′-CTGCT-CATAGGTGACGAACATC-3′。热循环反应:95 ℃持续10 min,95 ℃循环40次,每次15 s,60 ℃延伸1 min。以GAPDH为内参,采用2-ΔΔCT法计算相对表达量。
1.10 乳酸试剂盒检测细胞内乳酸含量
将MDA-MB-231细胞在培养皿中培养,穿心莲内酯(0,10,20,40 μmol/L)处理24 h后,按照乳酸试剂盒说明书操作,将样品充分混匀,37 ℃反应30 min,置于1 cm玻璃比色皿中,空白管调零,用可见分光光度计测定530 nm处D值,绘制标准曲线,并计算样品细胞内乳酸含量。乳酸含量(mmol/L)=(样品D值-空白D值)/(标准D值-空白D值)×标准品浓度(mmol/L)×样品测试前稀释倍数。
1.11 JC-1探针染色检测线粒体膜电位
将MDA-MB-231细胞接种于96孔板中,用不同浓度穿心莲内酯(0,10,20,40 μmol/L)处理24 h后,每孔加入100 μL 稀释后的JC-1探针(5 g/L),37 ℃、5% CO2避光孵育30 min,通过荧光酶标仪检测细胞荧光强度(激发波长488 nm/发射波长535 nm用于JC-1绿色,激发波长488 nm/发射波长595 nm用于JC-1红色),用红、绿荧光比值反映线粒体膜电位。
1.12 统计学方法
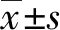
2 结果
2.1 穿心莲内酯对MDA-MB-231乳腺癌细胞存活率的影响
与0 μmol/L组相比,5 μmol/L穿心莲内酯的细胞存活率为79.99%(t=10.42,P<0.05)。随着浓度的升高,细胞存活率逐渐降低;当穿心莲内酯浓度为10,20,40,80 μmol/L时,细胞存活率分别为64.73%,43.55%,26.27%,24.83%,差异有统计学意义(t=18.91,t=57.75,t=64.02,t=80.08,P均<0.01),通过软件计算可得IC50为22.36 μmol/L。见图1。

a:P<0.05,b:P<0.01,与0 μmol/L穿心莲内酯组比较图1 穿心莲内酯对MDA-MB-231细胞存活率的影响
2.2 穿心莲内酯对MDA-MB-231乳腺癌细胞增殖的影响
除80 μmol/L穿心莲内酯对细胞有明显的抑制作用外(t=7.257,P<0.05),5,10,20,40 μmol/L组对细胞均无显著的抑制作用。结合MTT结果,其IC50为22.36 μmol/L,即选择10,20,40 μmol/L穿心莲内酯进行后续实验。见图2。

Hoechst染细胞核,EdU染细胞内的DNAa:P<0.05,与0 μmol/L穿心莲内酯组比较图2 穿心莲内酯对MDA-MB-231细胞增殖的影响(×20)
2.3 穿心莲内酯对MDA-MB-231乳腺癌细胞迁移与侵袭能力的影响
在单层培养细胞间制作划痕以产生愈伤区域,然后观察该伤口周围细胞向划痕迁移的现象,即伤口愈合。细胞迁移能力越弱,意味着伤口愈合速度减慢,也就是划痕宽度减少。伤口愈合实验结果显示,随着药物浓度的增加或处理时间延长,其细胞的伤口愈合速度逐渐减慢;给予不同浓度的穿心莲内酯后,Transwell小室结果显示,MDA-MB-231细胞侵袭到下室的数量随着药物浓度的增加逐渐减少(t=5.237,P<0.05;t=12.66,P<0.01;t=18.08,P<0.01)。见图3。

a:P<0.05,b:P<0.01,与0 μmol/L穿心莲内酯组比较;标尺=100 μm图3 穿心莲内酯对MDA-MB-231细胞迁移与侵袭能力的影响
2.4 穿心莲内酯对UCP2 mRNA以及蛋白表达的影响
从蛋白质数据库查到人UCP2的编码为PDB:2LCK,使用AutoDock 4.2程序进行分子对接,通过计算机分子模拟显示,穿心莲内酯与UCP2有一定的结合力,且与UCP2的Gly151结合力较强。随后收集穿心莲内酯(0,10,20,40 μmol/L)处理的蛋白和RNA检测UCP2的表达水平。RT-PCR结果显示,随着药物浓度的升高,UCP2mRNA表达下调(t=7.267,P<0.05;t=24.23,P<0.01;t=15.53,P<0.01)。蛋白质印迹结果显示,不同浓度的穿心莲内酯(0,10,20,40 μmol/L)处理细胞24 h后,实验组中UCP2的蛋白表达下调(t=9.435,P<0.05;t=14.76,P<0.01;t=19.73,P<0.01)。见图4。
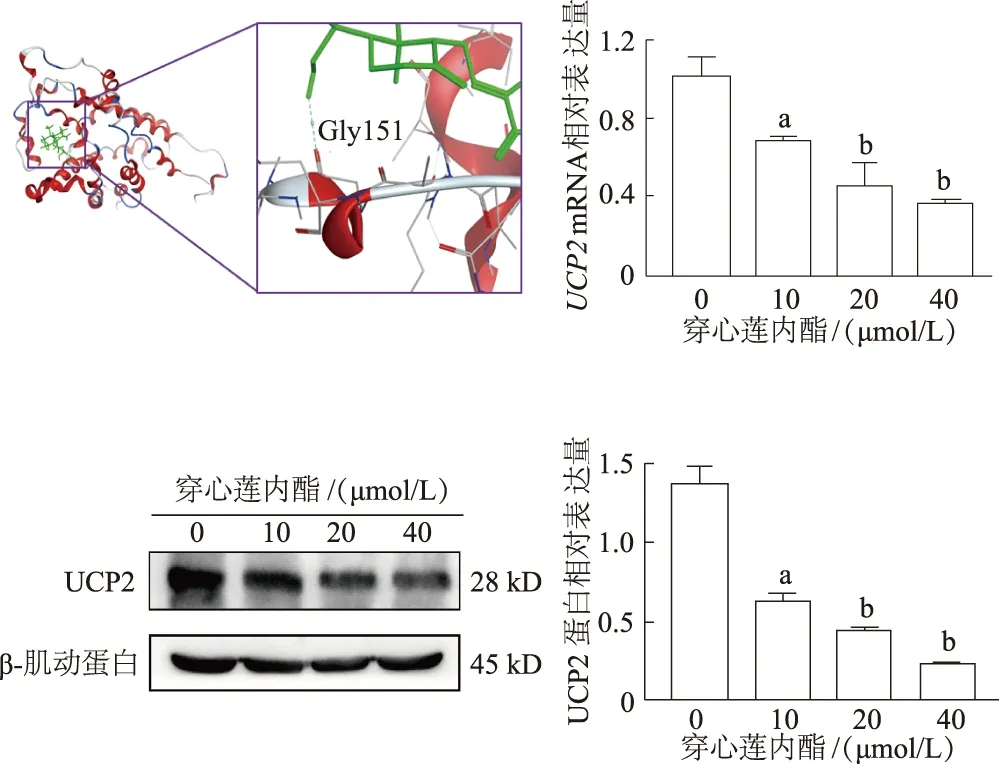
a:P<0.05,b:P<0.01,与0 μmol/L穿心莲内酯组比较图4 穿心莲内酯对UCP2 mRNA以及蛋白表达的影响
2.5 穿心莲内酯对MDA-MB-231乳腺癌细胞能量代谢的影响
给予穿心莲内酯(0,10,20,40 μmol/L)后,与0 μmol/L组相比,细胞内乳酸水平降低(t=7.559,P<0.05;t=10.04,P<0.05;t=19.4,P<0.01);细胞的红绿荧光比呈显著性升高(t=11.74,P<0.05;t=8.416,P<0.05;t=30.51,P<0.01)。此外,蛋白质印迹结果显示,实验组中PDH蛋白表达上调(t=8.012,t=11.07,t=11.69,P均<0.05),提示MDA-MB-231细胞的氧化磷酸化水平升高。见图5。

a:P<0.05,b:P<0.01,与0 μmol/L 穿心莲内酯组比较图5 穿心莲内酯对MDA-MB-231细胞能量代谢的影响
3 讨论
恶性肿瘤细胞代谢的重要特征之一就是以糖酵解作为主要的能量获取方式,主要表现为细胞内的葡萄糖转化生成的丙酮酸通过乳酸脱氢酶转变成乳酸,供自身合成时的能量需要,这种代谢方式称为Warburg效应[17]。三阴性乳腺癌可以利用糖酵解产生的大量乳酸促进迁移与侵袭能力,使其死亡率较其他类型乳腺癌高。因此,探究通过调节三阴性乳腺癌代谢方式来抑制其迁移与侵袭能力成为研究的重点方向。
本研究首先通过MTT法检测发现,穿心莲内酯在较低浓度下能够抑制三阴性乳腺癌MDA-MB-231细胞的活力,通过EdU试剂盒检测可以看出高浓度的穿心莲内酯(40 μmol/L)不会抑制细胞的增殖作用,并且伤口愈合以及Transwell小室实验初步证明了穿心莲内酯可以抑制MDA-MB-231细胞的迁移与侵袭能力。
Pelicano等[18]研究表明,与非三阴性乳腺癌细胞相比,三阴性乳腺癌细胞的耗氧量显著降低,而葡萄糖的摄取和乳酸的产生则显著增加,说明糖酵解在三阴性乳腺癌中发挥重要作用。本研究结果表明,穿心莲内酯能够下调三阴性乳腺癌细胞内乳酸含量,并且用穿心莲内酯处理后的细胞线粒体膜电位升高,PDH的蛋白表达升高,PDH表达的上调预示着有较多的丙酮酸进入线粒体进行氧化磷酸化,穿心莲内酯改善了乳腺癌细胞的代谢方式。因此推测穿心莲内酯抑制三阴性乳腺癌细胞的迁移与侵袭能力可能是通过下调糖酵解实现的。
UCP2作为线粒体内膜上的解偶联蛋白,在许多人类癌症中高表达,包括胰腺癌、前列腺癌、乳腺癌、肺癌和皮肤癌[19]。Ohkouchi等[20]研究表明,UCP2在肿瘤中的高表达能够提高肿瘤利用糖酵解水平,促进其生成更多的乳酸。而利用葡萄糖类似物2-脱氧葡萄糖作用于UCP2过表达的HCT116细胞,则明显抑制了肿瘤细胞糖酵解进程,从而抑制肿瘤细胞生长[21]。由此可见,UCP2参与肿瘤细胞的能量代谢与糖酵解密切相关。
为进一步探究这种下调糖酵解作用是否与UCP2相关,本研究采用分子对接软件分析,发现穿心莲内酯能与UCP2的多个蛋白位点结合,其中与Gly151结合力最强。RT-PCR以及蛋白质印迹结果表明,穿心莲内酯处理后的细胞UCP2mRNA和蛋白表达下调。因此推测穿心莲内酯下调糖酵解的作用可能与UCP2有关。
综上所述,穿心莲内酯可能通过抑制三阴性乳腺癌的糖酵解和改变能量代谢的方式抑制MDA-MB-231细胞的迁移与侵袭,其机制可能与UCP2有关。
