食品中志贺氏菌检测技术研究进展
2022-01-19王立娟马晓燕伟3
卢 鑫,王立娟 ,郭 威,马晓燕,张 伟3,4,
(1.河北农业大学理工学院, 河北沧州 061100;2.河北农业大学食品科技学院, 河北保定 071001;3.河北农业大学生命科学学院, 河北保定 071001;4.河北省人畜共患病原微生物分析与防控重点实验室,河北保定 071001)
志贺氏菌(Shigella)是引起人类肠道疾病的主要致病菌之一,具有很强的感染力和致病力,严重危害人们的身体健康[1]。志贺氏菌存在于乳制品、肉制品和蔬菜瓜果中,食用被志贺氏菌污染的食物或水可导致腹泻、发热、呕吐以及脱水等临床症状,甚至会导致死亡。全球64%的细菌性腹泻疾病是由该细菌感染所致,每年约有1.6亿人感染志贺氏菌,死亡人数高达110万,其中大部分为五岁以下儿童及免疫缺陷人群[2]。在发展中国家由福氏志贺氏菌引起的腹泻疾病位居前列。在我国,每年由志贺氏菌引起的疾病占食源细菌性疾病总数的8.5%,其死亡病例占食源性疾病死亡病例的5.9%[3]。因此,探究出一种快速灵敏、简便高效的检测志贺氏菌的方法迫在眉睫。
随着检测技术的发展,志贺氏菌的检测方法可分为:传统培养方法、免疫学方法、分子生物学方法和生物传感器方法。自1897年发现志贺氏菌以来,其分离培养与常规鉴定技术已经相当成熟[4]。但是传统培养方法操作繁琐,耗时费力,不能满足现场快速检测的需要。免疫学方法能够实现快速检测,缩短了检测时间,但该方法的灵敏度较低[5]。分子生物学方法可分为变温扩增技术如聚合酶链式反应(Polymerase chain reaction,PCR)及其衍生技术和等温扩增技术如滚环扩增技术(Rolling circle amplification,RCA)、环介导等温扩增技术(Loopmediated isothermal amplification,LAMP)和单引物等温扩增技术(Single primer isothermal amplification,SPIA)等。分子生物学方法利用聚合酶反应,具有高灵敏、高特异、简便快速的特点,被广泛应用于食源性病原菌的检测。传感器技术因其高灵敏度、操作简单的特点,使该技术在致病菌检测中具有广阔前景。新兴的检测技术包括无酶信号放大技术和适配体技术,使检测方法更加灵敏、特异,为病原菌检测技术的发展提供了参考。
1 传统检测方法
食源性致病菌的传统检测技术在现行的食品安全国家标准里均有规范。作为食品微生物检测的“金标准”,《GB 4789.5-2012食品安全国家标准·食品微生物学检验·志贺氏菌检验》在志贺氏菌检测中具有举足轻重的地位。国标检测[6]方法包括前增菌、选择性分离、生化鉴定和血清学鉴定,整个过程需要4~5 d,检测限为1×104CFU/mL[7]。国标方法的准确性高且稳定,但操作繁杂,灵敏度较低。Jung等[8]针对目标菌株选择性问题采用噬菌体扩增测定法在多种混合细菌中成功地检出鲍氏志贺氏菌。志贺氏菌的检出率与增菌液和显色培养基的选择以及培养基灭菌的方式有密切关系。在普通培养基上培养痢疾志贺氏菌和鲍氏志贺氏菌,有杂菌时无法生长,容易产生假阴性结果。李志明等[9]在增菌培养基中加入新生霉素、胰胨葡萄糖肉汤及含表面活性剂吐温,可以形成很好的厌氧环境培养志贺氏菌;在显色培养基中加入抗生素,抑制了杂菌生长,保证了培养的准确性。针对灵敏度低的问题,Tang等[10]将qPCR与传统培养方法结合检测沙门氏菌和志贺氏菌,使传统培养方法的灵敏度提高了100倍。传统培养方法作为其他检测方法的基础,将逐渐满足实际检测的需要。
2 免疫学检测方法
免疫学方法的基本原理:抗原与抗体特异性结合[11],其在食源性致病菌检测应用中最大的优点在于检测目标的多样性,不仅可以检测样品中痕量致病菌,还能检测细菌毒素[12]。目前应用最广泛的免疫学快速检测技术包括酶联免疫吸附(Enzyme-linked immunosorbent assays,ELISA)技术[13]、免疫磁珠(Immunomagnetic beads,IMB)技术[14]和免疫层析(Immunochromatography assay,ICA)技术[15],近年来免疫学方法不断发展,实现了志贺氏菌的高通量、快速灵敏检测,大大提高了检测效率,如表1所示。
免疫学方法操作简便,可在15 min内,实现致病菌多重检测,如表1所示。Gupta[19]开发并标准化了检测志贺毒素(STxB)的Dot-ELISA和夹心ELISA方法,其检测限分别为9.75、9.7 ng/mL,该检测方法特异性高,经济高效且可现场检测。胶体金免疫色谱带(ICS)大多采用胶体金作为比色检测的报告剂,不需要特殊的仪器和试剂,使ICS的结果可视化。Song等[16]使用一步侧流ICS方法对鲍氏志贺氏菌和大肠O157:H7进行多重分析,与ELISA结果一致。Yahaya等[17]对侧流免疫分析法(LFIAs)进行研究,确定使用NC-HF135硝酸纤维素膜可提高LFIAs灵敏度。Chen等[20]将荧光微球和免疫色谱试纸(FMs-ICTS)方法与PCR结合进行志贺氏菌的定量检测,并且将其与多种定量方法进行比较,结果显示该方法具有高特异性和灵敏度,可以快速检测病原体。为了简化免疫学方法,Gene Fields® EHEC/SS试剂盒[18]应运而生,其原理如图1所示,用两种引物进行PCR扩增:一种引物带有标记间隔序列,另一种引物带有生物素标记。PCR产物的标记序列和与试纸上标记序列互补的寡核苷酸(蓝线)进行杂交。利用核酸色谱成分可同时检测肠沙门氏菌、志贺氏菌属和肠出血性大肠杆菌的特异性基因,与传统培养方法结果一致,说明该方法可代替实时PCR试剂盒用于致病菌基因的筛查。
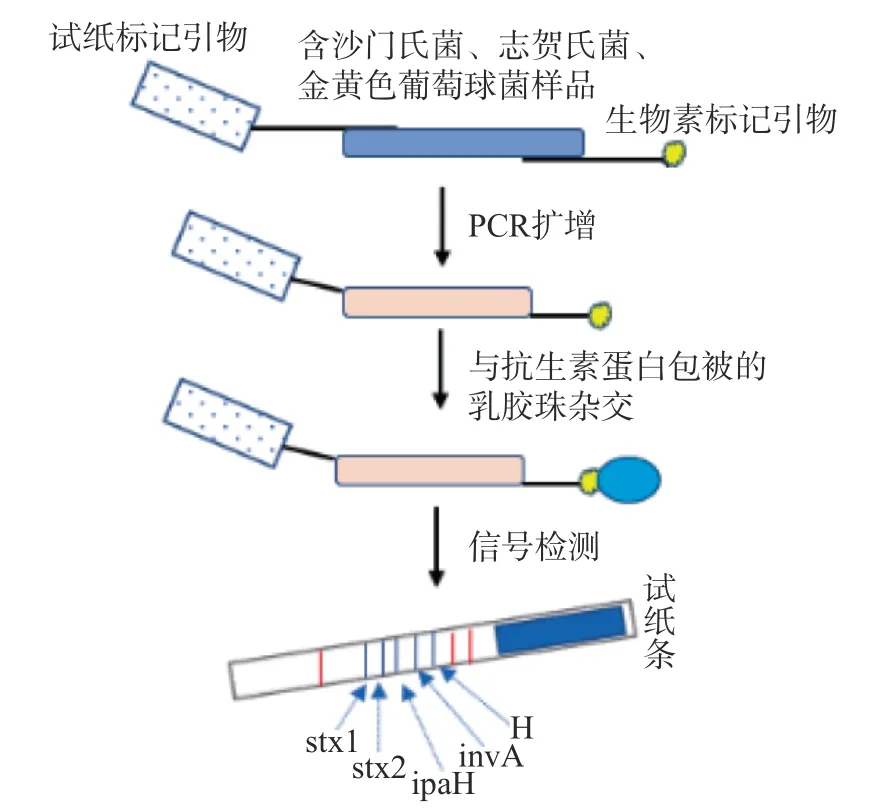
图1 Gene Fields® EHEC/SS的原理图Fig.1 Schematic diagram of Gene Fields® EHEC/SS

表1 免疫学方法检测志贺氏菌Table 1 Detection of Shigella by immunological methods
3 分子生物学检测方法
随着微生物学和分子生物学的迅速发展,根据形态结构和生理特性对病原微生物进行鉴定已不能满足实际检测的需要,从分子水平上对生物大分子进行分析逐渐成为研究热点之一,特别是核酸结构及其组成部分。近几年,分子生物学方法包括变温扩增技术和等温扩增技术,已被广泛的应用于食源性病原菌的快速检测。
3.1 变温核酸扩增技术
变温核酸技术(Alternating temperature nucleic acid testing,ATNAT)一般经过高温变性、低温退火和适温延伸三个步骤。基于ATNAT的技术以PCR技术及其衍生技术为主,目前在各个领域得到了广泛的应用。ATNAT技术缩短了检测时间,其高灵敏度和特异性使鉴定多种靶标和病原体(包括新出现的菌株)成为可能[21]。但ATNAT需要昂贵的热循环装置,在资源有限的环境中进行应用及分析具有一定的局限性。如表2所示,近年来人们对PCR技术进行了各方面的改进,克服了常规PCR技术的不足,使检测方法更加灵活、准确。

表2 PCR及其衍生技术检测志贺氏菌Table 2 PCR and its derivative technology of Shigella detection
3.1.1 实时荧光PCR技术 1996年美国Applied Biosystems公司提出了一种定量核酸检测技术—实时定量PCR(qPCR)[27],该技术简化了检测步骤,减轻了劳动强度。实时荧光技术通过荧光染料或荧光标记探针对PCR产物进行标记跟踪,可实时在线监控反应过程。常见的荧光染料以SYBR Green染料为主,使用简便,成本低,且随着产物DNA增多,荧光增强[28],但浓度高时会抑制PCR反应。荧光染料EvaGreen和LC Green Plus因高灵敏度和低抑制性,而得到广泛应用[29]。陈智瑾等[30]使用荧光染料EvaGreen结合实时荧光定量PCR检测类志贺邻单胞菌,灵敏度为2.5 CFU/mL,较SYBR Green检测志贺氏菌的灵敏度(1000 CFU/g)高[31]。荧光标记探针(TaqMan)方法虽拥有高特异性和灵敏度,对扩增没有抑制[23],但是其成本要较染料法更高,而且探针设计复杂。分子生物学方法无法区分死菌DNA和活菌DNA而易造成假阳性结果,Mei等[32]建立了叠氮溴化乙锭(Ethidium monoazide bromide,EMA)实时荧光PCR技术检测食品中志贺活菌的方法,检测结果更加准确。RTQ-PCR和数字PCR是目前对食源性病原体进行定量检测的方法。与其他定量方法不同的是,数字PCR[26]是一种不需要建立标准曲线就可以定量检测致病菌的方法,检测时间短、特异性高、重复性好、准确度高。
3.1.2 多重PCR(MPCR)技术 MPCR技术是可以同时检测多种致病菌的技术,具有高灵敏、高通量的特点,能够实现对致病菌的高效、准确检测。现有很多技术与MPCR结合,He等[25]将荧光染料EvaGreen与MPCR结合检测志贺氏菌,可达到实时高通量检测的目的,且检测方法简便易操作;Ma等[24]将免疫磁珠分离(Immunomagnetic separation,IMS)技术和多重实时PCR(RT-MPCR)结合,同时检测新鲜猪肉中的志贺氏菌、沙门氏菌和金黄色葡萄球,其中志贺氏菌的检出限为6.8 CFU/g,特异性高达100%,敏感性和准确性高于99%。MPCR技术满足了实际样品检测的需要,对样品中的病原菌有较全面的检测。
3.2 基因芯片
基因芯片技术又称为寡核苷酸阵列或寡核苷酸芯片技术,其原理基于分子杂交。基因芯片可进行高通量检测,更加简单快捷。王磊等[33]发明了一种检测志贺氏菌血清型的基因芯片试剂盒,通过将待测样品基因组DNA的引物进行扩增和标记,检测杂交信号从而判定志贺氏菌的血清型。Guo等[34]使用液态基因芯片对金黄色葡萄球菌、单增李斯特菌和志贺氏菌三种食源性致病菌进行检测,其中志贺氏菌的检测限低至21 CFU/mL。该方法为快速检测食源性致病菌提供了高通量检验方法,从而实现快速、高通量检测致病菌的目的。Fang等[35]用基因芯片同时检测7种致病菌,将视觉微孔板芯片与MPCR结合,使检测结果实现了可视化。Li[36]建立了视觉DNA微阵列并将其用于检测食物中常见的致病菌,视觉微孔板芯片和MPCR组合用于检测食品中福氏志贺氏菌,灵敏度为102CFU/mL。基因芯片技术可批量处理样本,且耗时较短,特异性较强,对致病菌的检测有较大的应用价值。基因芯片检测志贺氏菌相关技术如表3所示。

表3 基因芯片检测志贺氏菌分析Table 3 Analysis of Shigella detected by gene chip
3.3 等温核酸扩增技术
自20世纪90年代以来,等温扩增技术(Isothermal nucleic acid testing,INAT)用于检测DNA、RNA、细胞、蛋白质等目标,通过恒定的温度控制,使信号放大,从而检测出目的菌。等温扩增技术不仅包括滚环扩增(Rolling circle amplification,RCA)技术、环介导等温核酸扩增(Loop-mediated isothermal amplification,LAMP)技术,还包括一些新的技术:重组聚合酶扩增反应(Recombinase polymerase amplification,RPA)、跨越式滚环等温扩增技术(Saltatory rolling circle amplification,SRCA)和交叉引物扩增(Cross priming amplification,CPA)等。
将6种常见的等温扩增技术进行归纳,如表4所示,等温扩增技术的检测时间相差甚微,通过与实时荧光结合,检测时间缩短到40 min左右。王建昌等[43]建立了实时荧光SPIA技术检测牛奶中的志贺氏菌,在44 min内完成检测。刘立兵等[44]使用实时荧光RPA技术检测志贺氏菌,能够在20 min内完成反应,其检测限低至0.36 CFU/g。等温技术在酶和引物设计方面,SRCA技术仅在BstDNA聚合酶和一对引物的作用下即可完成反应。Wang等[45]使用SRCA方法检测志贺氏菌,扩增产物通过荧光可视化方法进行验证,检测限为47 CFU/g。等温技术可对多种致病菌同时进行检测,贾甜甜[46]建立了多重LAMP检测牛奶中志贺氏菌、沙门氏菌和单增李斯特菌的方法,其中志贺氏菌的检测限为53.3 CFU/mL。综上,等温扩增技术在一定程度上缩短了检测时间,提高了扩增效率,降低了检测限,在志贺氏菌的实际检测中得到了广泛的应用。然而RCA和CPA技术在检测志贺氏菌的研究中还需要进一步探索。
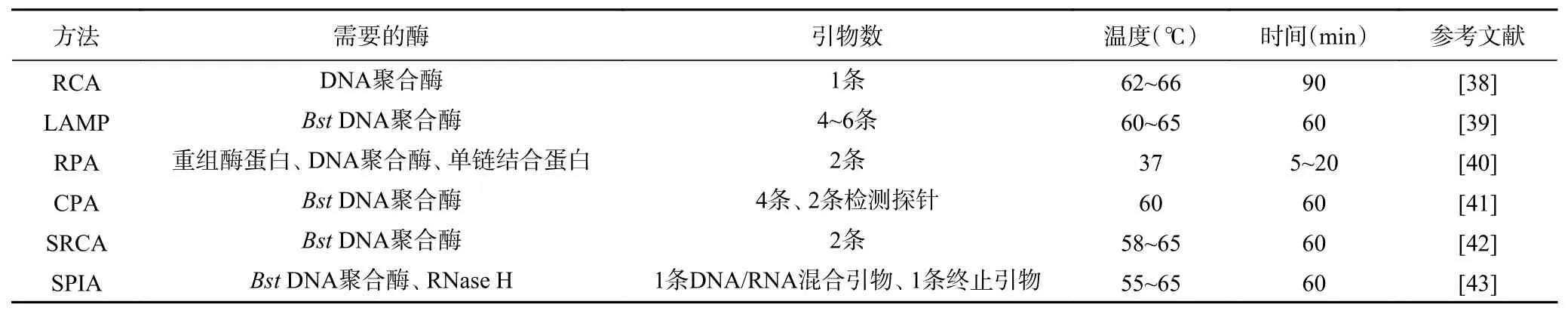
表4 等温扩增技术比较Table 4 Comparison of isothermal amplification techniques
4 生物传感器技术
生物传感器是生物技术中较为先进的检测技术,可以快速、检测微量致病菌。它是一种将生物感应元件和物理化学检测器结合,通过信号传导和信号扩大使结果以具体、形象的方式展现出来,包括光学生物传感器、电化学生物传感器、压电生物传感器和生化传感器等种类。Xiao等[47]研发了便携式倏逝波光纤生物传感器,可快速、高灵敏度地检测志贺氏菌,将DNA探针固定在可以与荧光标记的互补DNA杂交的光纤生物传感器上,可以检测到低至10-2CFU/mL的志贺氏菌,其检测限与实时PCR一致。Zarei等[48]无标记阻抗适体传感器检测痢疾志贺氏菌,检出限低至1 CFU/mL。Feng等[49]使用新型金纳米粒子比色适体传感器,首先将具有高亲和力的适体固定在AuNPs表面,通过目标菌诱导AuNPs聚集进行检测,并与NaCl作用后,出现可视的颜色变化,可高效检测实际样品中的志贺氏菌,整个检测过程在20 min内完成。生物传感器检测时间短,设备逐渐趋于小型化、自动化。这些特性使其优于传统的细菌培养和其他分子检测方法,非常适合现场检测。另外生物传感器方法满足了现代工业对检测技术应用的需求,除具有高稳定性、低成本高效益、高灵敏度和广选择性的特性外,它们还能够在低目标菌浓度下完成检测。一方面生物传感器技术在检测志贺氏菌方面提供了先进的技术支持,另一方面其操作复杂,且需要选择出高灵敏度的检测识别组件和准确的读取组件,在研发使用方面仍然存在瓶颈(表5)。

表5 生物传感器技术检测志贺氏菌Table 5 Biosensor technology of Shigella detection
5 新兴检测技术
5.1 无酶信号放大技术
现阶段大多数扩增反应都需要酶的催化作用,如在目的序列扩增中DNA聚合酶起重要作用。无酶技术包括催化发夹组装(Catalyzed hairpin assembly,CHA)和杂交链反应(Hybridization chain reaction,HCR),能使细胞内mRNA或miRNA的成像信号增强。CHA仅需要杂交和链交换反应即可将信号放大,既不需要蛋白酶也不用DNA聚合酶,反应仅涉及杂交过程。当目标DNA与发夹DNA结合形成新的核酸序列时,在传感器中建立一个立足点,启动CHA的循环扩增反应[53]。HCR需要稳定的DNA单链暴露在目标DNA片段后才能组装,两种稳定的DNA发夹共存于溶液中,直到加入引发链杂交,产生类似于交替共聚物的刻痕双螺旋[54]。利用HCR进行扩增和捕获,使用产生的DNA聚合物从溶液中除去分析物。这两种方法具有良好的重复性和可接受度,为食品、环境和医药等检测提供了一个无标记、无酶、低成本、直观、简单的平台。有研究已将CHA与信号传感器结合,用于肺炎链球菌的检测,检测限为156 CFU/mL。Duan等[55]利用无酶信号放大的DNA电路和核苷酸碱基类似物的固有荧光,基于CHA系统和吡咯并脱氧胞苷(P-DC)对寡核苷酸序列进行检测,较常规基于荧光核苷酸碱基类似物方法提高了3个数量级。Dai等[56]建立了基于自我复制催化发夹装配(SRCHA)的快速信号放大DNA检测微量DNA方法,15 min内即可完成反应,为实时快速生物分子分析提供了一种潜在的技术支持。
5.2 基于适配体的检测技术
1990年Tuerk等[57]首次提出指数富集配体的系统进化技术(Systematic evolution of ligands by exponential enrichment,SELEX)并成功筛选出能够与T4 DNA聚合酶特异性结合的单链RNA。适配体(Aptamer)是基于SELEX从人工合成的核酸序列文库中筛选出的一段与相应的配体高度亲和的特异寡核苷酸序列。作为信号识别原件,适配体经活性基团修饰可被开发成传感器,以实现高灵敏、特异性地识别蛋白质和小分子物质。基于适配体的传感器技术在医疗诊断方面应用较多,较少的应用在食源性致病菌检测方面。李聪[58]建立了适体与荧光定量PCR联用检测食源性蜡样芽孢杆菌和志贺氏菌的新方法,志贺氏菌检出限为3.0×10-2CFU/mL,为食源性致病菌检测提供了新方法和技术参考。
6 结语与展望
随着社会各界对食品安全的密切关注,对食品的检测标准也不断提高,开发出简便快捷、准确的检测方法至关重要。志贺氏菌的检测技术众多,然各有利弊。目前检测志贺氏菌的方法以传统方法和分子生物学方法较常见,生物传感器技术和新兴检测技术为志贺氏菌的检测提供了技术参考。在实际检测过程中,需根据实际情况的需要选择合适的方法,或者将两种甚至多种方法结合,弥补技术之间的不足。或将新兴技术与原有的方法(培养方法、分子生物学方法等)结合,简单快捷、灵敏特异、低成本的检测方法将会是未来检测志贺氏菌技术发展的方向。
