基于酿酒酵母体系的人参皂苷抗衰老活性筛选及评价
2022-01-19陈静静白雪媛吉世禹王思明
陈静静,白雪媛,边 帅,吉世禹,王思明
(长春中医药大学吉林省人参科学研究院,吉林长春130000)
酿酒酵母是抗衰老研究中最为简单的生物模型[1],也是最成熟的真核生物表达系统。其正常细胞的衰老新陈代谢反应机制与人体正常细胞的衰老新陈代谢反应机制很相似[2]。它生长周期短、易大规模培养,具有相对较短、易于测量的时间和复制寿命,并已完成基因组测序,有完整的核苷酸序列[3],并与哺乳动物有高度的同源性。酿酒酵母衰老模型作为一种单细胞生物模型,不仅能够高通量筛选药物活性,更能够进一步从细胞水平探寻衰老的机制[4]。目前国内外用酿酒酵母作为研究衰老的模式生物已有30余年,基于酵母模式生物,相关研究已经发现了多酚白藜芦醇和天然多胺亚精胺可作为潜在的抗衰老剂[5]。酵母细胞同哺乳动物类似,其中存在着超氧化物歧化酶、过氧化氢酶等抗氧化酶[6-11]。蛋白质组学是在大规模水平上研究蛋白质的特征,包括蛋白质的表达水平、翻译后的修饰、蛋白与蛋白相互作用等,由此可以获得蛋白水平上的关于酿酒酵母衰老发生及给药后细胞的整体而全面的认识[12]。
人参被誉为“百草之王”,具有很大的药用价值[13]。人参皂苷是人参中的重要活性成分之一,它也已经被证明是具有抗衰老作用的药物之一,在抗衰老过程中起非常重要的作用[14-16]。经查阅文献资料,最终确定选用较多人使用研究的和人参中含量较高的人参皂苷单体进行实验,因此前期筛选使用了八种人参皂苷Rb1、Rb2、Rg1、Rg2、Rg3、Rh1、Rh2、Rd[17-19]。然而人参皂苷抗衰老涉及到多种作用机制,目前尚不清楚,其中,具有明显抗衰老作用的单体皂苷也不甚明晰,本实验旨在探究人参皂苷减弱氧化应激从而达到延缓酿酒酵母衰老的作用及确定出效果最为明显的一种或多种单体皂苷对其进行活性评价[20]。
以往研究人参皂苷的抗衰老作用,用动物或细胞作为研究模型较多,但研究不够深入,未清楚其作用机制[21],以酿酒酵母作为抗衰老模型,不仅可说明人参皂苷在不同物种上的保守性,也能为后期人参皂苷的作用机制研究提供方便。本文以酿酒酵母作为模型生物进行实验,为人参皂苷更进一步的有效使用提供一定参考。以比较有代表性的SOD作为抗氧化指标,筛选出较为有效的单体皂苷。后面再通过ROS含量、MDA含量以及多种抗氧化酶活性进行验证人参皂苷是否具有抗氧化作用从而达到抗衰老作用。通过对酿酒酵母的正常组及给药组的蛋白质组比较分析,找到某些“衰老特异性的蛋白质分子”与药物产生抗衰老作用的主要途径。
1 材料与方法
1.1 材料与仪器
酿酒酵母BY4742 淼灵生物公司;YPD培养基:1%酵母膏、2%蛋白胨、2%葡萄糖,溶于蒸馏水中,121 ℃灭菌20 min,YPD固体培养基是在液体培养基中加入2%的琼脂;人参皂苷标准品 源叶生物科技有限公司;酵母膏、蛋白胨、葡萄糖、琼脂、MTT、二甲基亚砜、DNS、卡那霉素、磷酸盐缓冲液、愈创木酚、TCA、过氧化氢酶检测试剂盒 索莱宝科技有限公司;BCA试剂盒、活性氧检测试剂盒、MDA检测试剂盒 碧云天生物试剂公司;SOD试剂盒 南京建成生物工程研究所。
EYELA恒温培养箱 东京理化公司;infinite M200PRO酶标仪 瑞士TECAN公司;SCIENTZ超声波细胞粉碎机 宁波新芝生物有限公司;SX-700蒸汽灭菌器 日本Tomy Digital Biology公司;SW-CJ-2D型双人净化工作台 苏州净化设备有限公司;innova40全温振荡培养箱 德国Eppendorf公司;KQ-600E型超声清洗器 昆山超声仪器有限公司。
1.2 实验方法
1.2.1 酿酒酵母活化与培养 将购买的菌种在YPD固体培养基上进行划线或涂布,于28 ℃培养箱倒置培养48 h活化[22]。再进行单克隆培养即挑单菌落于灭完菌的小体积YPD液体培养基里扩大培养,再进行大体积的二次扩大培养,培养条件为28 ℃、180 r/min,每次培养24 h即可连续传代培养使用。培养基中均加入卡那霉素50 mg/mL作抗生素,避免染菌[23]。
1.2.2 酵母细胞生长曲线的绘制及降糖能力测定取经两次扩大培养后的菌液,以2%的接种量接种于新的培养基中置于合适条件下培养,将此时记为0 h(初始接种期),每隔4 h从中取样,用MTT法测定OD600值。菌浓度以OD600值表示。取样测定绘制酿酒酵母的生长曲线[24]。
采用二硝基水杨酸(DNS)法测定菌液中的残糖含量,先绘制出葡萄糖标曲,测定OD540值,用空白管进行调零,即可绘制出检测还原糖的标准曲线。
样品测定:取发酵液1 mL,8000 r/min离心10 min取上清液,加入0.75 mL的DNS混匀,煮沸5 min,立即冷却,加入蒸馏水稀释到10 mL,测定OD540值,将结果带入标曲即可得到各时间点菌液的残糖含量。若OD值不在标曲内,可以先稀释样品找出合适的浓度。
1.2.3 酿酒酵母不同时期凝絮能力比较 根据1.2.2的生长曲线,选出分别处于稳定前期、稳定中期和衰老期的三个时间点,将菌液浓度用生理盐水稀释至2.0×104~3.0×104CFU/mL,摇匀,取等体积稀释后样品1 mL于Ep管中,用PBS定容至20 mL,室温静置,每隔30 min从管中取样,测定其OD600值。
1.2.4 最适给药浓度筛选 查阅文献,选出药物浓度为100、150、180、200、250 μg/mL给药[25-26],确定较合适的给药浓度。进行后续实验,每隔6 h取样测定,绘制给药后酵母细胞生长曲线,与未给药的正常生长曲线进行对比,观察是否延长酵母细胞的时序寿命,实验做三组平行。
1.2.5 有效人参皂苷初步筛选 根据前期药物浓度筛选确定药物浓度,于酵母菌刚进入稳定期时进行,分别给药人参皂苷Rb1、Rb2、Rg1、Rg2、Rg3、Rh1、Rh2、Rd。之后隔12 h取样,根据MTT实验结果确定细胞浓度,绘制生长曲线,进行比较。同时在将要进入衰老期时测定不同皂苷作用的酵母菌抗氧化酶超氧化物歧化酶(SOD)含量,以确定效果较好的人参皂苷单体进行后续实验。
1.2.6 不同时期酵母细胞的形态观察 取经磷酸盐缓冲液洗涤2次的酵母细胞,用PBS稀释细胞悬液到适当浓度,置于干净的聚酰胺玻片上,进行爬片,洗涤,固定,用扫描电镜观察细胞形态。
1.2.7 粗酶液制备 取1 mL菌液,用反复冻融加超声波破碎细胞法进行处理,3000 r/min离心6 min得到的细胞沉淀用PBS洗涤三次,再加入0.5 mL PBS,功率300 W,工作3 s,间歇9 s,置于冰水浴中持续10 min进行超声处理。得到的细胞破碎液于4 ℃,12000 r/min的条件下离心10 min,取上清即得到粗酶液。由于蛋白易降解失活,要将粗酶液置于-20 ℃下并分装保存,避免反复冻融。
1.2.8 抗氧化指标测定
1.2.8.1 ROS含量的测定 采用荧光探针DCFHDA检测法[9]进行测定。YPD液体培养基稀释DCFH-DA探针使终浓度为10 μmol/L,收集细胞悬浮于稀释好的DCFH-DA中,细胞浓度为1.0×106~2.0×106CFU/mL,37 ℃孵育20 min,PBS清洗三次,使用荧光酶标仪在488 nm激发波长和525 nm发射波长下测定。
1.2.8.2 POD酶活性的测定 采用愈创木酚法[9]进行测定。依次加入2 mL 0.2 mol/L的磷酸盐缓冲液、0.1 mL 0.05 mol/L愈创木酚溶液、0.1 mL的粗酶液、1.0 mL的2% H2O2,充分摇匀,在37 ℃水浴保温15 min,立即加入2%的TCA溶液 2 mL终止反应,混匀,用双蒸水调零,在470 nm处测吸光度值,以每分钟吸光度值变化0.01为一个酶活单位(U)。使用BCA试剂盒测定粗酶液中的蛋白含量。

式中:ΔA470表示样品在470 nm下的吸光度值;N表示加酶量,mL;C表示蛋白浓度,mg prot/mL;T表示反应时间,1 min。
1.2.8.3 SOD 酶活性的测定 采用WST-1法[23]进行测定。取1.2.7得到的粗酶液稀释10倍,测定孔接20 μL稀释好的粗酶液,再加入酶工作液20 μL和200 μL底物应用液,混匀后,37 ℃孵育20 min,450 nm测吸光度A。测定空白孔同测定孔用酶稀释液代替酶工作液,其余步骤相同。在反应体系中SOD抑制率达50%时所对应的酶量为一个SOD活力单位(U)。按公式计算SOD抑制率:

式中:Ah表示对照孔450 nm下的吸光度值;Ai表示空白对照孔450 nm下的吸光度值;Aj表示测定孔450 nm下的吸光度值;Ak表示空白测定孔450 nm下的吸光度值;K表示反应体系稀释倍数;C待测表示待测样本蛋白浓度,mg prot/mL。
1.2.8.4 CAT 酶活性的测定 采用微量法[23]进行测定。取30 μL菌液加1 mL CAT提取液,超声破碎,离心取上清(与1.2.7相同)。取10 μL粗酶液加入190 μL检测工作液,记录每min样品在240 nm下的吸光度变化值。使用BCA试剂盒测定粗酶液中的蛋白含量。CAT活力计算公式如下:
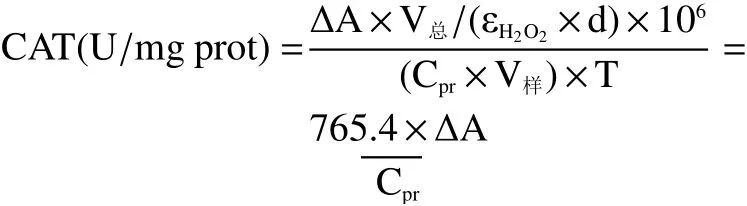
式中:ΔA表示每分钟样品在240 nm下的吸光度变化值;V总表示反应总体积,mL; εH2O2表示H2O2的摩尔消光系数,43.6 L/mol/cm;d表示孔板光径,0.6 cm;Cpr表示样品蛋白浓度,mg prot/mL;V样表示样品体积,mL;T表示反应时间,min。
1.2.8.5 MDA含量测定 TBA显色法[27]。取1.2.7得到的粗酶液100 μL,加入0.2 mL MDA检测工作液,混匀,沸水浴15 min,水浴冷却至室温,1200 r/min离心10 min后取200 μL上清加入到96孔板中,随后用酶标仪在535 nm测定吸光度。由此通过比色法对样品中的MDA进行定量检测。
1.2.9 蛋白质组学分析 取68 h的给药与空白样品各3个,离心回收沉淀,清洗两次,液氮研磨成细胞粉,加入四倍体积裂解液,超声三次,收集上清液进行蛋白质提取,再以1:50的比例进行胰酶酶解,再用TMT肽段标记,标记的肽段用高pH反向液相色谱进行分离,质谱检测分子量进行成分分析和结构分析,最后进行蛋白质的定性与定量分析。
1.2.9.1 TMT标记及肽段分级 将各样品得到的所有蛋白进行酶解,肽段定量。按照TMT标记试剂盒说明书,每份样品分别取100 μg肽段进行标记,标记试剂解冻后用乙腈溶解,与肽段混合后室温孵育2 h,标记后的肽段混合后除盐,真空冷冻干燥。首先采用乙腈和0.1%三氟乙酸 (TFA) 进行柱平衡,然后将混合的标记肽段样品上样,将其脱盐处理、梯度洗脱、真空干燥后用适量0.1% FA溶液复溶冻干样品,在吸光度280 nm处测定肽段浓度。
1.2.9.2 液相色谱-串联质谱(LC-MS/MS)分析 采用纳升流速的HPLC 液相系统对每份分级样品进行分离;样品经色谱分离后用Q-Exactive质谱仪进行质谱分析,正离子检测方式,母离子扫描范围300~1800 m/z。多肽和多肽碎片的质量电荷比采集方式:每次全扫描后采集20个碎片图谱(MS2 scan,HCD)。
1.2.9.3 蛋白质鉴定和定量分析 LC-MS/MS质谱分析原始数据使用软件Mascot 2.2和 Proteome Discoverer 1.4进行查库鉴定及定量分析,最后生物信息学分析得到差异蛋白筛选和GO功能集分析。
1.3 数据处理
数据处理均采用Prism 8软件作图,结果用“平均值±标准差”表示,数据用ANOVA方法作差异分析(P<0.05)。实验均做3次平行。
2 结果与分析
2.1 酿酒酵母的生长曲线和残糖变化
由图1可知,酿酒酵母的迟滞期为0~4 h,对数生长期在4~16 h,并在16 h进入稳定期(静止期),说明这个时期的酵母菌个体形态及生理指标都较为稳定,是菌种采样留种的好时期。在68 h开始进入衰亡期(也叫衰老期)。与此对应的培养基残糖变化也表明在对数生长期16 h之前残糖含量快速下降,说明此时酵母菌生长消耗大量的葡萄糖,16~68 h进入稳定期,残糖含量下降缓慢,说明随着酿酒酵母培养时间的增加,酵母细胞对葡萄糖的代谢能力逐渐变慢,当培养到68 h时,残糖浓度下降极度缓慢基本保持不变,由此可见细胞衰老使得酿酒酵母对糖的代谢能力减弱。

图1 酿酒酵母的生长曲线和残糖变化图Fig.1 Growth curve and residual sugar diagram of Saccharomyces cerevisiae
2.2 不同时期的酵母菌凝絮能力变化
凝絮能力测定要选用比较有代表性的时间点样品进行实验,因此选用了刚到达稳定期的16 h、稳定期中点的44 h和进入衰亡期的68 h的菌液进行絮凝能力对比实验,由图2可知,16 h的酿酒酵母凝絮曲线斜率为0.0006,44 h凝絮曲线的斜率为0.001,68 h斜率为0.0015。随着酵母细胞培养时间的增加,其絮凝速率明显加快,这可能是由于酵母在衰老过程中,细胞经多次出芽繁殖,表面细胞壁褶皱程度增加,导致了细胞间表面粘附力增强,从而促进了细胞聚集引起絮凝速率加快,也有可能是由于菌体在衰老过程中胞内活性氧积累,脂质过氧化加剧,产生氧化应激,导致细胞损伤,从而导致细胞絮凝速率加快[28]。还有可能是细胞衰老过程中,细胞活力下降,导致絮凝能力增强。

图2 酿酒酵母不同时间凝絮能力变化Fig.2 Changes of flocculation ability of Saccharomyces cerevisiae at different time
2.3 筛选最适给药浓度
使用人参皂苷Rg1根据酵母菌的生长曲线筛选出最适的给药浓度。根据图3生长曲线结果得出当给药浓度是150、180、200 μg/mL时,均在84 h进入衰亡期,有明显延长酵母菌稳定期的作用。而浓度为100 μg/mL、250 μg/mL和空白组一样于72 h进入衰老期,但由结果可知180 μg/mL时对酵母还具有明显的增殖效果,说明当给药浓度为180 μg/mL时,既能延长酵母的稳定期同时具有明显增殖效果,作用最佳。因此选定给药浓度为180 μg/mL进行后续实验。
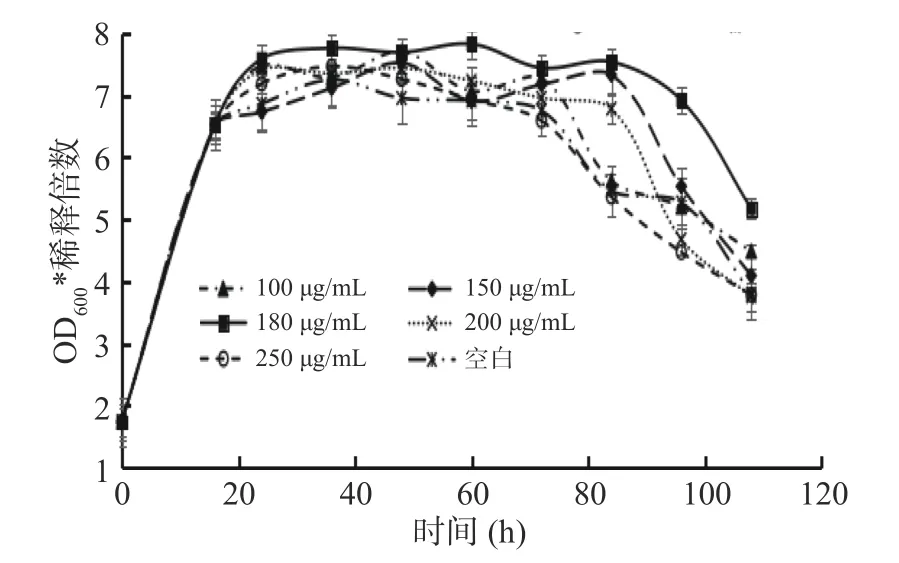
图3 不同给药浓度的生长曲线Fig.3 Growth curve of different drug concentration
2.4 不同人参皂苷对酿酒酵母作用结果
据图4可以比较直观的得出人参皂苷Rb1、Rb2、Rg1、Rg2、Rg3、Rh1均有延缓酵母衰老的作用,均延长了酿酒酵母进入衰老拐点的时间:空白组是在72 h附近开始有菌浓度下降的趋势,而给药组Rg1在96 h附近开始下降,Rb2是在84 h处出现下降趋势。同时,Rg3有非常明显的酵母菌增殖效果,Rb1、Rg2、Rh1也都有一定的增殖作用。为了使结果更清楚,选用了拐点附近的5个时间点64、68、70、72、76 h进行抗氧化酶SOD活性的检测,以便观察哪些药物有明显增强抗氧化酶活性的效果。由图5可以得出,人参皂苷Rg1、Rg3有明显增强抗氧化的作用,在各时间点均增大SOD活力(P<0.05)。人参皂苷Rb1、Rb2、Rh1也有增加抗氧化酶活性的作用,但效果不如Rg1和Rg3。人参皂苷Rg3造价较为昂贵且效果较Rg1稍低。由此,结合这两个实验结果,最终确定使用人参皂苷Rg1进行接下来的活性研究实验。

图4 不同人参皂苷作用下的酵母菌生长曲线Fig.4 Growth curve of yeast under the action of different ginsenosides
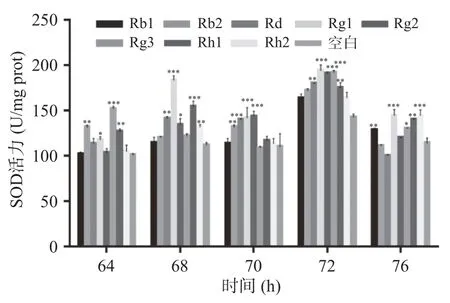
图5 不同人参皂苷作用下的酵母细胞SOD活力比较Fig.5 Comparison of SOD activity in yeast cells under different ginsenosides
2.5 人参皂苷Rg1给药组与空白组的生长曲线对比
由图6 给药组与空白组比较可知,给药后显著延长了酵母细胞的时序寿命,约延长了24 h。空白组在84 h时已经进入衰老期,而给药组还处于稳定期,且给药组于96 h进入衰亡期,细胞浓度较空白组有较显著提升(P<0.01)。由此可以看出给药人参皂苷Rg1使酿酒酵母稳定期延长,进入衰老期的时间点延缓,且菌浓度较未给药的正常培养的酵母菌浓度较高,说明人参皂苷Rg1具有延缓酿酒酵母衰老的作用并能够促进酵母增殖。

图6 给药与未给药的生长曲线对比图Fig.6 Comparison of growth curve between drug administration and non drug administration
2.6 不同时期细胞形态对比
图7 是不同时期的酵母细胞扫描电镜图。A是正常对照组在刚进入稳定期时的细胞形态,其形态稳定,细胞呈不规则球状,表面光滑无皱褶。B是正常对照组在刚进入衰亡期的细胞状态,细胞经过多次出芽生殖,表面粗糙产生大量絮状物,表面褶皱增加,出现核仁碎片,细胞有明显衰亡痕迹。C是在正常培养基础上给药人参皂苷Rg1,同样是68 h的细胞状态,从图中可以看出细胞正在进行分裂,细胞表面虽有芽痕,但细胞形态保留较为完好,与未给药组对比有明显改善,因此可知人参皂苷Rg1在一定程度上可以改善酵母细胞的衰老情况。

图7 酿酒酵母不同时期细胞形态Fig.7 Cell morphology of Saccharomyces cerevisiae at different stages
2.7 抗氧化指标测定
细胞内的活性氧含量越高,说明抗氧化能力越弱。POD和CAT是主要的抗氧化酶之一,含量越高,说明抗氧化能力越强。SOD水平与自由基含量呈负相关,其水平的高低可间接反映机体内自由基的含量。测定MDA含量即可得到细胞氧化脂质的情况[29]。由图8可以看出,空白组酿酒酵母随培养时间的增加,胞内活性氧含量出现先升高后下降的趋势,而给药组能明显降低酵母的活性氧含量,特别在刚给药后存在极显著差异(P<0.0001)。POD也是酵母中的主要抗氧化酶之一,随时间的延长,POD出现先上升后下降的趋势,同时给药后显著提升酵母细胞内的POD活性(P<0.01)。由图c可知酿酒酵母SOD活力随培养时间的增加而增强,给药后能使酵母细胞SOD活性更强,结果有显著性差异(P<0.05)。CAT同POD一样,都呈现先上升后下降的趋势,进入衰老期后抗氧化酶活力便开始下降。由图e可知MDA含量随培养时间的增加而增大,在68 h进入衰老期后细胞数减少所以MDA含量总体有所减少,但给药后能显著降低细胞内MDA的含量,说明细胞抗氧化能力显著增强(P<0.05)。从图中可以看出,给药后不仅细胞中的活性氧含量有所降低,各抗氧化酶的活力增强,在酵母进入衰老期抗氧化酶活力开始下降后也能抵御活性氧或超氧阴离子带来的氧化损伤,尤其是POD和SOD酶活力有明显增强,MDA含量也有明显降低。因此可以说明人参皂苷Rg1具有延缓酿酒酵母衰老的作用,并且可以降低酿酒酵母的活性氧含量,同时增加胞内抗氧化酶的活力,抑制脂质过氧化率,可为后续的研究提供数据支撑。人参皂苷Rg1可能是通过抗氧化达到抗衰老的目的。

图8 给药与未给药的抗氧化酶活性及活性氧含量对比图Fig.8 Comparison of antioxidant enzymes and reactive oxygen content between drug administration and non drug administration
2.8 蛋白组学分析结果
在差异蛋白质筛选中,以表达倍数>1.5 倍(上调大于1.5倍或下调小于0.67倍)且P-value<0.05(Ttest)为标准,得到比较组间的上调、下调的蛋白质数目。将比较组间蛋白质以表达差异倍数和Pvalue(T-test)两个因素为标准绘制火山图(图9),无差异的蛋白质为灰色,显著下调的蛋白质以蓝色标注(FC<0.67 且P<0.05),下调蛋白质数量为10个。显著上调的蛋白质以红色标注(FC>1.5且P<0.05),上调蛋白质数量为4个,人参皂苷延缓酿酒酵母衰老可能与14个显著差异蛋白有关。

图9 酿酒酵母的差异蛋白筛选Fig.9 Screening of differential protein in Saccharomyces cerevisiae
为了全面了解蛋白在生物体中的功能、定位及参与的生物学途径,通过基因本体对蛋白质进行注释。GO 是一个标准化的功能分类体系,GO 功能注释主要分为 3 类:生物过程,分子功能和细胞组分。蛋白质可以根据ID序列注释的方法找到与之对应的蛋白的功能以及组成。根据图10发现它们主要包含细胞、细胞器等细胞组分(CC),具有结合和催化活性等分子功能(MP),并参与细胞转化和代谢等生物过程(BP)。一般情况下,某一功能类别对应的差异表达蛋白质数目越多,说明该功能越重要,需要重点关注或者进行后续深入的机制探讨,为后续的研究提供思路。因此,酿酒酵母的差异蛋白在细胞组分和分子功能的改变中较多,可能与细胞代谢有密切关系。

图10 酿酒酵母差异表达蛋白GO的分类及注释Fig.10 Classification and annotation of differentially expressed protein GO in Saccharomyces cerevisiae
3 讨论与结论
酿酒酵母的寿命包括时序寿命和复制寿命,此次实验以其时序寿命为研究对象。本实验以酿酒酵母体系为实验模型,在酵母刚进入稳定期时进行给药,筛选确定药物浓度为180 μg/mL。查阅文献可知很多药物均被证明有抗衰老作用,例如姜黄素衍生物(500 μg/mL),柳树提取物(0.1%)等[30-31],相比较来说,人参皂苷Rg1的给药浓度(180 μg/mL)要更小一些也具有抗衰老作用。本文筛选的人参皂苷Rb1、Rb2、Rg1、Rg2、Rg3、Rh1均有延缓酵母衰老的作用,但人参皂苷Rg1的效果最为显著,据酵母生长曲线得出Rg1可明显延缓酵母进入衰老期时间。结合酿酒酵母空白组和给药人参皂苷Rg1组的生长曲线图对比结果以及电镜下的细胞状态对比,加上给药组与空白组的抗氧化指标对比结果,可以证明人参皂苷Rg1有显著的延缓酿酒酵母衰老作用。
ROS水平可以决定不同的生物学结果。低水平的ROS可诱导细胞增殖和适应氧化,而高水平的ROS可促进衰老,造成DNA、蛋白质或脂质损伤,最终导致细胞死亡和疾病[32]。在酿酒酵母培养过程中添加人参皂苷Rg1,可显著提高细胞内抗氧化酶类SOD、CAT 及 POD 活性并且降低活性氧的含量,减少脂质氧化,从而降低胞内活性氧对细胞的氧化损伤情况。说明人参皂苷Rg1是通过上调了内源性抗氧化系统组成部分CAT、POD与SOD的酶活水平并且降低了酵母细胞内的ROS和MDA含量,从而达到有效减缓氧化应激,延长酵母的存活时间的目的[33]。结果也表明人参皂苷Rg1既可抑制自由基的产生,也可直接对抗自由基对组织及细胞的损伤作用,或直接清除自由基,还可增强机体本身抗氧化系统的功能,从多个环节阻断自由基的损伤作用。蛋白组学分析结果的差异蛋白筛选和GO富集分析为后续进一步验证研究人参皂苷Rg1抗衰老提供理论与实验基础。人参皂苷延缓酿酒酵母衰老可能与14个显著差异蛋白有关,并且药物通过作用在细胞组分和细胞器中产生疗效,同时很大部分作用在代谢过程中。
因此人参皂苷Rg1用来作为抗衰老药物前景较好,具有治疗各种氧化或衰老所致疾病的巨大潜力,也可以用来作为某些药物的辅助药物来使用。本实验也为抗衰老与抗氧化之间的关系依据进一步进行了验证。同时也为人参药物、保健、美容等系列产品的开发利用提供了一定的理论指导。
