甜叶菊有效成分动态积累分析及水提液澄清工艺初探
2022-01-19王雪铭张红艺梁建生
谢 虹,王雪铭,张红艺,陈 云,梁建生
(1.扬州大学生物科学与技术学院, 江苏扬州 225009;2.巴州正达绿源生物科技有限公司, 新疆和静 841303)
甜叶菊(Stevia rebaudianaBertoni)是一种发源于南美洲的多年生草本植物[1],我国于1977年试种成功后,甜叶菊种植面积居世界首位,近年来主要集中在安徽、甘肃和新疆等地种植[2]。甜菊糖苷(Steviol glycosides,SGs)是甜叶菊叶中含量最高的一类二萜类化合物的总称,具有甜度高、热量低、性质稳定等特点,可作为“甜味剂”应用于食品和药品领域[3-4]。甜叶菊所含有的SGs达30多种,各糖苷虽结构相似但性质各异。甜菊苷(Stevioside,ST)的甜度是蔗糖的近200倍,有明显的后苦味;瑞鲍迪苷A(Rebaudioside A,RA)的甜度为蔗糖甜度的350倍,但其甜味呈现较慢,有一定的后苦味;瑞鲍迪苷D(Rebaudioside D,RD)和瑞鲍迪苷M(Rebaudioside M,RM)的甜度是蔗糖甜度的350倍,苦涩后味明显减少,最接近蔗糖的感官特征[5-8]。酚类是甜叶菊中另一类含量较高的化合物,总量可达甜叶菊干叶质量的15.12%,其中绿原酸类含量达12.85%[9]。绿原酸类亦被称为咖啡酰奎宁酸类,包括单咖啡酰奎宁酸、二咖啡酰奎宁酸和三咖啡酰奎宁酸[10],主要从绿咖啡豆、金银花和杜仲叶中提取,生产成本较高[11]。研究表明,甜叶菊中二咖啡酰奎宁酸(异绿原酸A)占比最高,咖啡豆、金银花、杜仲中以单咖啡酰奎宁酸(绿原酸)为主要组成成分,而绿原酸类的抗氧化活性随着其分子结构中咖啡酰基数量的增加而增强[12]。除了绿原酸类外,甜叶菊还含有多种类黄酮化合物,含量达2.27%[9]。以往关于甜叶菊原料的品质评价和采收期的研究,以ST和RA的含量为考察指标[13-15],将SGs、绿原酸类和类黄酮同时作为质量评估指标的研究报道较少。
尽管我国拥有丰富的甜叶菊资源,但目前对甜叶菊的利用主要集中在SGs的生产上[2]。SGs的制备工艺主要包括水浸提、澄清除杂、大孔吸附树脂选择性吸附、离子交换树脂去除离子和结晶等工序[4]。甜叶菊水提液含有大量蛋白质、色素和可溶性多糖等杂质,为了提高SGs产品的质量和延长树脂的使用寿命,对水提液进行除杂预处理是SGs分离纯化的必要环节。工业化生产通常采用硫酸亚铁作为絮凝剂,以氢氧化钙作为助凝剂进行酸碱中和反应形成絮凝沉淀,从而除去甜叶菊水提液中80%的杂质[16]。研究表明,酚类化合物随SGs一同浸出,但在澄清过程中随废渣被处理[17]。如能在SGs生产工艺的基础上同时采用大孔吸附树脂提取绿原酸类化合物,可以降低生产成本,提高甜叶菊的综合利用效率。
本实验以新疆巴州地区产甜叶菊叶为研究材料,通过探讨其中SGs、绿原酸类和类黄酮的积累规律,为甜叶菊的规范化栽培和合理采收提供依据;以甜叶菊水提液的澄清率和9种有效成分保留率为指标对澄清工艺进行考察,为甜叶菊水提液同时保留SGs和绿原酸类的除杂预处理提供一定的参考。
1 材料与方法
1.1 材料与仪器
甜叶菊叶 新疆巴州正达绿源生物科技有限公司种植基地(东经82°28'~87°52',北纬42°06'~43°33')采收,甜叶菊水浸提用实验材料为10月初公司大面积采收的干叶;RA 对照品,Tokyo化学工业有限公司;ST、木犀草素-7-O-葡萄糖苷、槲皮素-3-O-鼠李糖苷 对照品,Solarbio生物科技有限公司;瑞鲍迪苷B(Rebaudioside B,RB)、瑞鲍迪苷C(Rebaudioside C,RC)、杜克苷A(Dulcoside A,DA)、甜茶苷(Rubusoside,Ru)、甜菊双糖苷(Steviolbioside,SBio) 对照品,ChromaDex公司;新绿原酸、隐绿原酸、1,3-二咖啡酰奎宁酸、异绿原酸A、异绿原酸B、异绿原酸C 对照品,成都曼思特生物科技有限公司;绿原酸、芹菜素-7-O-葡萄糖苷、芦丁 对照品,成都瑞芬思生物科技有限公司;槲皮素-7-O-葡萄糖苷 对照品,上海源叶生物科技有限公司;槲皮素-3-O-木糖苷、山奈酚-3-O-鼠李糖苷、山奈酚-3-O-阿拉伯糖苷 对照品,四川省维克奇生物科技有限公司;以上对照品均为色谱纯(质量分数均≥98%);RD、RM 对照品(质量分数为95%),新疆巴州正达绿源生物科技有限公司;甲酸 色谱纯,天津市科密欧化学试剂有限公司;磷酸(色谱纯)、甲醇(分析纯)、磷酸二氢钠(分析纯) 国药集团化学试剂有限公司;乙腈 色谱纯,瑞典欧普森公司;壳聚糖季铵盐、壳聚糖盐酸盐(脱乙酰度≥90%) 南通绿神生物工程有限公司;聚合氯化铝(白色和黄色) 河南众邦环保科技有限公司;硫酸亚铁、氢氧化钙 分析纯,上海凌峰化学试剂有限公司。
1200高效液相色谱仪 安捷伦科技有限公司;Sepax GP-C18色谱柱(4.6 mm×250 mm,5 μm) 苏州赛分科技有限公司;AL204电子天平、320pH计梅特勒-托利多公司;SP-2001分光光度计 美国Hoefer公司;DHG-9141A电热鼓风干燥箱 德国美墨尔特公司;5804R冰冻离心机 德国艾本德公司;纯化水器 南京优普环保设备有限公司;AP-01P真空抽滤装置 天津奥特赛恩斯仪器有限公司;KQ-100TDE高频数控超声波清洗器 昆山市超声仪器有限公司;JB300-D强力电动搅拌机 上海标本模型厂;HH-4水浴锅 金坛城东新瑞仪器厂。
1.2 实验方法
1.2.1 甜叶菊采集 2018年5月15日完成甜叶菊谱星6号扦插苗的移栽定植,种植密度1万株/666.7 m2,于7月24日(70 d)、8月7日(84 d)、8月21日(98 d)、9月4日(112 d)、9月18日(126 d)、10月2日(140 d)、10月16日(154 d)每隔14 d采摘1次叶片,每次选取高度相近的5个单株,采摘方式为全株采摘,5个叶样本在55 ℃烘箱干燥24 h,每个叶样本分别称重和粉碎后过40目筛备用。
1.2.2 甜叶菊甲醇浸提液的制备 称取不同时期采收制备的叶粉末0.50 g,加入30 mL甲醇,室温超声(80 kHz)辅助浸提30 min,6000 r/min离心6 min,取上清液,沉淀重复超声浸提2次,合并上清液并用甲醇定容至100 mL,得到甲醇浸提液,用以考察甜叶菊中有效成分的动态积累规律。每个样本同时取3份进行超声辅助浸提。
1.2.3 甜叶菊水提液制备温度的考察 每份称取大面积采收干叶制备的粉末15.00 g,加入300 mL纯化水,分别在25、45、65、85 ℃温度下搅拌浸提60 min,分别离心,取上清液,补足纯化水至300 mL。测定各温度条件下浸提液中指标成分的含量,以选择适宜的浸提温度。每个温度下取2份叶粉末同时搅拌浸提。
1.2.4 甜叶菊水提液的制备 取一定量的甜叶菊干叶(不粉碎),按料液比1:20(g/mL)加纯化水,浸泡30 min,在65 ℃下搅拌浸提60 min,减压抽滤,即得深褐色甜叶菊水提液。
1.2.5 最佳絮凝剂的选择 设置5组,每组2份,每份甜叶菊水提液400 mL。25 ℃条件下,在每组水提液中分别加入1%壳聚糖季铵盐水溶液16 mL、1%壳聚糖盐酸盐水溶液16 mL、白色聚合氯化铝7.20 g、黄色聚合氯化铝7.20 g、硫酸亚铁3.60 g +氢氧化钙1.80 g(pH9.50),先以300 r/min的转速搅拌30 s,再以100 r/min搅拌20 min,静置10 min,分别取各澄清液过滤,取滤液测定pH、吸光度和指标成分含量。
1.2.6 壳聚糖盐酸盐投加量对澄清效果的影响 设置5组,每组2份,每份甜叶菊水提液400 mL。25 ℃条件下,每组水提液分别按0.35、0.45、0.55、0.65、0.75 g/L(壳聚糖盐酸盐质量/水提液体积)的投加量加入壳聚糖盐酸盐溶液,按“1.2.5”项下的条件进行澄清操作,计算澄清率。
1.2.7 体系温度对壳聚糖盐酸盐澄清效果的影响设置5组,每组2份,每份甜叶菊水提液400 mL。每组水提液分别于25、35、45、55、65 ℃恒温水浴中,按0.45 g/L投加量加入壳聚糖盐酸盐溶液中,按“1.2.5”项下的条件进行澄清操作,计算澄清率。
1.2.8 SGs含量的测定 参照GB 8270-2014《食品添加剂 甜菊糖苷》规定的方法进行含量的测定与计算[18]。色谱条件:色谱柱:Sepax GP-C18(4.6 mm × 250 mm,5 μm);流动相:A-NaH2PO4缓冲液(10 mmol/L,pH2.60),B-乙腈,A:B=68:32(V/V);流速:0.9 mL/min;柱温:40 ℃;检测波长:210 nm;进样量:20 μL。用30%乙腈水溶液将精密称量置于10 mL容量瓶中RD、RM、RA、ST、RC、RB、DA、Ru、SBio对照品溶解定容,得到混合对照品溶液,进入高效液相色谱(High performance liquid chromatography,HPLC)仪用于确定各糖苷在样品中的相对保留时间。精密称取RA和ST对照品各10 mg左右,置于25 mL容量瓶中,30%乙腈溶解定容,将制得混合对照品溶液进入HPLC仪4针以上,记录RA和ST的峰面积并计算各自峰面积的相对标准偏差(Relative standard deviation,RSD),当RSD<2%,将用30%乙腈水溶液稀释成合适浓度的待测样品溶液进入HPLC仪进行分析。RM与ST分子质量比值为1.60。
1.2.9 绿原酸类和类黄酮含量测定 参照谢虹等[19]建立的方法,以外标法计算甜叶菊中绿原酸类和类黄酮含量。色谱条件:色谱柱:Sepax GP-C18(4.6 mm ×250 mm,5 μm);流动相:0.5%甲酸水溶液(A)-乙腈(B),梯度洗脱程序(0~5 min,95%~90% A;5~40 min,90%~66%A;40~45 min,66%~5%A;45~50 min,5%~95%A);柱温:35 ℃;流速:0.9 mL/min;检测波长:330 nm;进样量:20 μL。因无木犀草素-7-O-芸香糖苷的对照品,其含量的计算以木犀草素-7-O-葡萄糖苷对照品的峰面积及浓度为基准,参照文献[19]的公式计算。
1.2.10 指标成分含量的保留率计算 用HPLC分别对澄清前后溶液中的RA、ST、RC、新绿原酸、绿原酸、隐绿原酸、异绿原酸B、异绿原酸A、异绿原酸C等指标成分含量进行测定,计算公式如下:

水浸提样品中,由于RD和RM极性较大,在C18色谱柱上保留时间短,不能与其他杂峰有效分离从而影响定量准确性,因此以RA、ST和RC作为衡量SGs保留率的指标成分。
1.2.11 甜叶菊水提液澄清率的计算 参照谢捷等[16]的方法测定水提液澄清率,以纯化水为参比,测定经过滤后的甜叶菊水提液在660 nm处的吸光度A0及絮凝剂处理的澄清液经过滤后在660 nm处吸光度A1,计算公式如下:
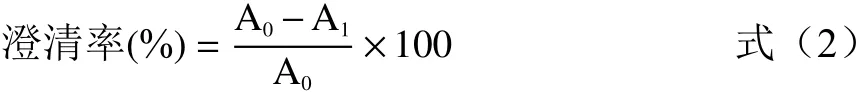
1.3 数据处理
实验数据使用Microsoft excel软件和SPSS 16.0统计分析软件进行整理与分析,采用Origin 9软件进行画图。
2 结果与分析
2.1 甜叶菊叶中有效成分和干物质累积动态
由图1可知,甜叶菊谱星6号所含糖苷主要包括RD、RM、RA、ST和RC等5种。在取样期内,糖苷总量介于153.73~168.74 mg/g之间,其中RA含量介于101.28~115.20 mg/g之间;RD含量介于17.38~22.16 mg/g之间;RC含量介于14.08~17.33 mg/g之间;ST含量介于8.88~11.62 mg/g之间;RM含量介于5.26~9.03 mg/g之间。由上述结果和图2a可知,甜叶菊叶中各糖苷和总糖苷含量相对稳定、波动小,罗庆云等[14]以5个品种甜叶菊叶为研究材料也得出RA和ST含量在生长发育阶段变化幅度小的结论。与已有研究[14,20-23]采用的守田系列、新光3号、鑫农4号、同心、绿源、菊隆、GT-1、GY系列、鑫丰3号、江甜3号、谱星1号、中山8号等甜叶菊品种中SGs相比,本研究选用的甜叶菊谱星6号中RA和RD的含量较高,这可能是由于甜叶菊品种的差异所导致的。甜叶菊中ST、RA、RD和RM均由起始底物甜菊醇经UGTs(UDP-糖基转移酶,UDPglycosyltransferases)多步糖苷化反应而形成,首先形成ST,ST在UGT76G1催化下形成RA,RA在UGT 91D催化下形成RD,RD在UGT76G1催化形成RM[24]。ST含量于112 d升至最高,此后呈现下降态势,而RA、RD和RM在140~154 d时段含量升至最高;ST、RA、RD和RM在甜叶菊中的动态积累趋势与它们的合成规律相一致。
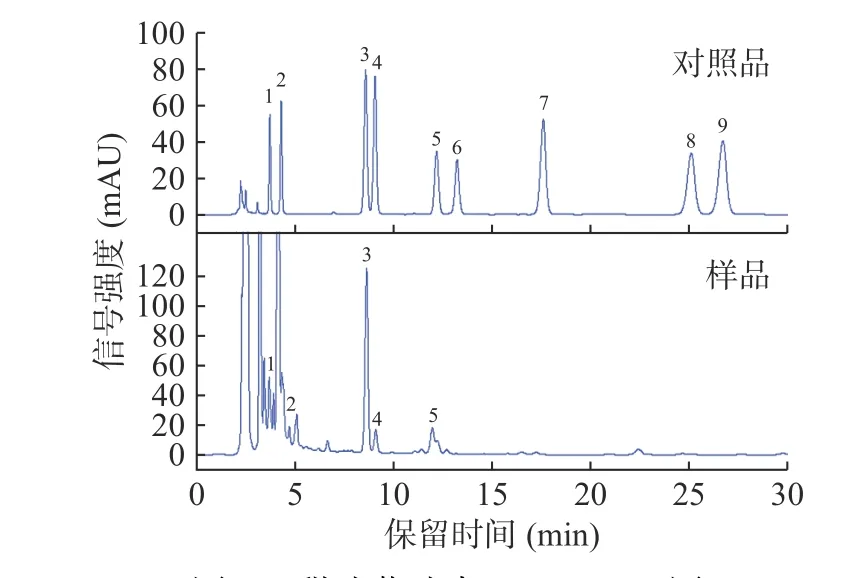
图1 甜叶菊叶中SGs HPLC图Fig.1 HPLC chromatograms of SGs in the leaf of Stevia rebaudiana Bertoni

图2 甜叶菊叶中有效成分和干物质动态积累图Fig.2 Dynamic accumulation charts of effective components and dry matter in the leaf of Stevia rebaudiana Bertoni
甜叶菊谱星6号所含绿原酸类主要包括3种单咖啡酰奎宁酸(新绿原酸、绿原酸、隐绿原酸)和3种二咖啡酰奎宁酸(异绿原酸A、异绿原酸B、异绿原酸C)(图3),与郭志龙等[11]和李云聪等[12]的研究结果相同;异绿原酸A占比最高为46.14%,其次是异绿原酸C和绿原酸,分别占22.21%和18.16%。在取样期内,甜叶菊中绿原酸类含量呈现降低-升高-稳定-降低的变化趋势(图2b),绿原酸类总量介于40.99~73.78 mg/g之间,其中异绿原酸A含量介于19.13~34.04 mg/g之间;异绿原酸C含量介于11.05~19.19 mg/g之间;绿原酸含量介于5.53~13.40 mg/g之间;新绿原酸含量介于2.98~7.94 mg/g之间;异绿原酸B含量介于1.05~1.82 mg/g之间;隐绿原酸含量介于1.22~1.71 mg/g之间。由于1,3-二咖啡酰奎宁酸在取样期内含量较少为0.10~0.20 mg/g,未列入图中。
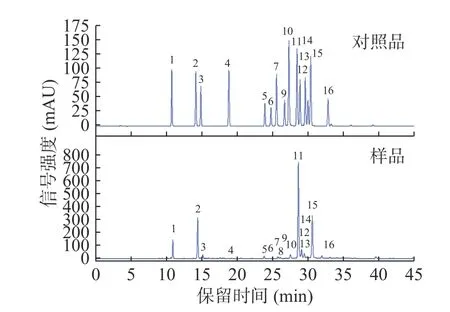
图3 甜叶菊叶中绿原酸类和类黄酮HPLC图Fig.3 HPLC chromatograms of chlorogenic acids and flavonoids in the leaf of Stevia rebaudiana Bertoni
甜叶菊谱星6号中主要含有9种类黄酮的糖苷衍生物(图3),其中槲皮素-3-O-鼠李糖苷占比最高,为62.43%;其次是芦丁,占比为15.25%。在取样期内,类黄酮总量同样呈现降低-升高-稳定-降低的变化趋势(图2c)。类黄酮总量介于11.20~14.88 mg/g,其中槲皮素-3-O-鼠李糖苷含量介于6.64~9.29 mg/g;芦丁含量介于1.83~2.29 mg/g;木犀草素-7-O-葡萄糖苷含量介于0.71~1.06 mg/g;山奈酚-3-O-鼠李糖苷含量介于0.55~0.66 mg/g;芹菜素-7-O-葡萄糖苷含量介于0.41~0.62 mg/g;槲皮素-7-O-葡萄糖苷含量介于0.28~0.53 mg/g;木犀草素-7-O-芸香糖苷含量介于0.32~0.52 mg/g;槲皮素-3-O-木糖苷含量介于0.18~0.35 mg/g;山奈酚-3-O-阿拉伯糖苷的含量介于0.05~0.17 mg/g。
谱星6号绿原酸类和类黄酮含量变化趋势的结果表明,甜叶菊中酚类积累与生长期密切相关。植物合成次生代谢产物是为了适应环境的需要[25],当甜叶菊苗移栽成活后,应立即打顶促进侧芽生长以增加分枝和叶片的数量。为了抵御微生物的侵染、植食性昆虫及打顶造成的机械损伤,在70 d甜叶菊中酚类含量已达较高水平(68.95 mg/g)。从70 d之后,酚类含量呈现下降态势,推测此时段初级代谢相关酶的基因表达活跃,用于合成构成细胞壁的半纤维素、纤维素和果胶等多糖物质,因为干叶质量从70 d 开始呈现增加趋势(图2d),在84~98 d时段维持在稳定水平,而酚类含量在98 d降至最低。从98 d开始,干叶质量和酚类含量快速增加,推测与木质素合成相关酶的基因表达变化密切相关。木质素是细胞次生壁主要组成成分,占生物量的25%~30%,以维持细胞一定机械强度[25]。木质素、绿原酸和类黄酮均为苯丙素生物合成途径的产物,为了合成木质素,该途径上游的催化酶例如苯丙氨酸解氨酶基因表达上调为下游分支途径上绿原酸、类黄酮和木质素等的合成提供大量的底物,从而导致三者在126~154 d时段内积累达到最高量。因此,新疆巴州甜叶菊适宜的采收期在9月中旬至10月初时段。
研究表明,氮肥能够促进甜叶菊叶干物质、SGs和酚类积累[1,26],机械损伤亦能够刺激植物酚类的合成[27]。8月中旬之后,干叶质量和酚类含量快速增加,此时需给甜叶菊追肥,适当增加氮肥的量;同时在甜叶菊的栽培过程中可以适当增加打顶的次数。当前企业按照含水量<10%、泥沙和枝条等杂质含量<10%、总糖苷含量>13%的质量标准收购甜叶菊干叶,本研究建议将绿原酸类含量纳入企业收购干叶标准中。
2.2 甜叶菊水提液澄清工艺初探
2.2.1 不同温度对甜叶菊中指标成分浸提效率的影响 国内工业化生产通常采用常温水浸提甜叶菊叶中的SGs,从表1可知,25 ℃水提液中RA、ST和RC的含量已达到85 ℃水提液中RA、ST和RC的含量的60%,但6种绿原酸类化合物的含量较低,表明低温状态下,绿原酸类化合物的浸提效率不高。随着浸提温度的升高,新绿原酸、绿原酸及隐绿原酸的含量逐渐增加,异绿原酸B、异绿原酸A和异绿原酸C的含量也显著增加(P<0.05)。提高温度可以增加甜叶菊中有效成分的浸出率,但相应地增加了蛋白质、多糖等杂质的溶出[28]。考虑生物活性成分在高温下易变性失活的特性[29],因此选择在65 ℃条件对甜叶菊叶进行水浸提。

表1 不同温度水提液中指标成分的含量Table 1 Contents of indicative components in water extract under different temperatures
2.2.2 不同絮凝剂对甜叶菊水提液澄清效果的影响从表2可知,SGs工业化生产中采用硫酸亚铁和氢氧化钙絮凝的澄清液淡黄清亮,澄清效果最好,但绿原酸类在澄清液中基本无保留。额尔敦巴雅尔等[30]的研究显示采用硫酸亚铁+氢氧化钙絮凝方法去除甜叶菊水提液中绿原酸类和类黄酮物质效果较为显著,而赵磊等[17]的研究显示甜叶菊絮凝废渣中富含绿原酸和类黄酮化合物。因此,硫酸亚铁+氢氧化钙不适合作为从甜叶菊水提液中进一步提取分离绿原酸类的絮凝剂。聚合氯化铝属于无机高分子絮凝剂,具有较高的电荷密度,通过电性中和及吸附桥架交联作用促使胶体微粒絮凝沉淀[31]。白色聚合氯化铝絮凝的澄清液中RA和ST的保留率较高,但RC和6种绿原酸类的保留率低;黄色聚合氯化铝的澄清率虽然高于白色聚合氯化铝的澄清率,但RA、ST和绿原酸类的保留率更低,尤其是异绿原酸基本无保留。壳聚糖作为阳离子线性高分子絮凝剂,通过螯合、电中和与吸附架桥作用除去植物浸提液中大量杂质[16]。尽管RA、ST和RC在壳聚糖季铵盐絮凝处理的澄清液中全部保留,但异绿原酸损失率较大;壳聚糖盐酸盐的澄清效果优于壳聚糖季铵盐的澄清效果,尽管ST和RC有一定的损失,6种绿原酸类基本保留在澄清液中。甜叶菊水提液pH为5.82,加入聚合氯化铝和硫酸亚铁+氢氧化钙均使水提液pH产生较大变化。因此,选择壳聚糖盐酸盐作为甜叶菊水提液的最适絮凝剂。
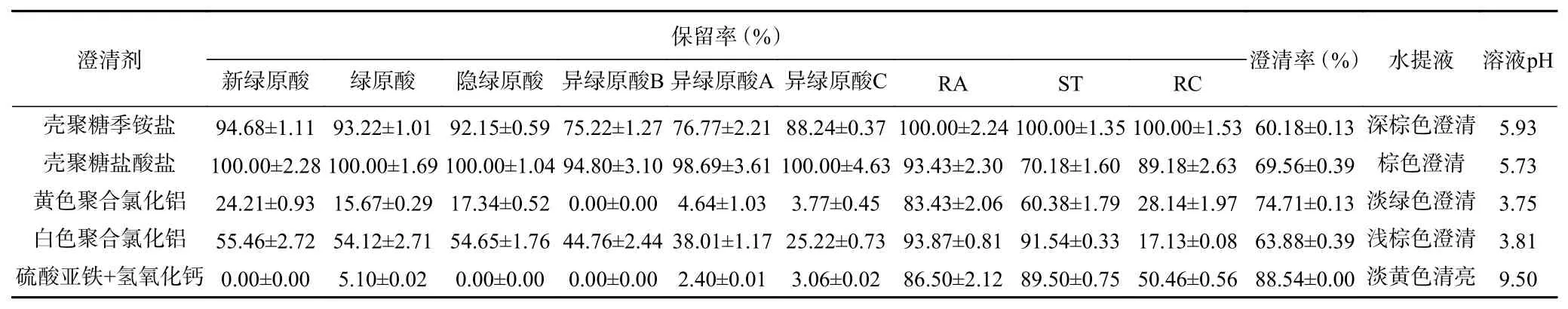
表2 25 ℃条件下不同絮凝剂对水提液的澄清效果Table 2 Clarification effects of different flocculants on water extract under 25 ℃
2.2.3 壳聚糖盐酸盐投加量对澄清效果的影响 从表3可知,25 ℃条件下,随着絮凝剂加入量的增大,水提液的澄清率逐渐增加,当添加量超过0.55 g/L时,虽有絮状沉淀,但水提液由澄清变为不透明状态。这是因为过量的絮凝剂使胶粒表面发生二次吸附而覆盖了一层絮凝剂,胶粒处于再稳定状态,溶液变浑浊[16]。因此,综合考虑澄清效果和生产成本等因素,选择壳聚糖盐酸盐的合适投加量为0.45 g/L。
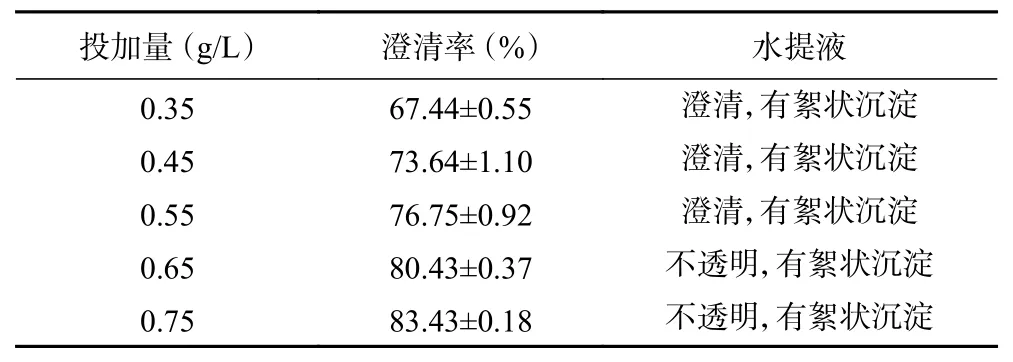
表3 25 ℃条件下壳聚糖盐酸盐的投加量对澄清效果的影响Table 3 Effects of different dosages of chitosan hydrochloride on clarification rate under 25 ℃
2.2.4 体系温度对壳聚糖盐酸盐澄清效果的影响由表4可知,当水浴温度低于55 ℃时,水提液中的杂质微粒与絮凝剂分子相互碰撞的几率增大,加速了絮凝沉淀的过程[16],因此,在45 ℃条件下,当加入絮凝剂搅拌2 min左右时,水提液出现明显的絮状沉淀且液体呈清亮状态,澄清效果与硫酸亚铁+氢氧化钙组合的效果相当;当温度升至55 ℃时,壳聚糖盐酸盐分子发生老化[16],澄清率开始下降,65 ℃条件下水提液底部虽出现絮状沉淀,但静置30 min后液体仍呈浑浊状态。因此,澄清操作温度选择在45 ℃左右为宜。

表4 体系温度对壳聚糖盐酸盐澄清效果的影响Table 4 Effects of different flocculation temperatures of chitosan hydrochloride on clarification rate
3 结论
以甜叶菊叶为材料,测定了不同生长期甜叶菊中SGs、绿原酸类、类黄酮三类有效成分的含量。分析结果表明,各种糖苷以及总糖苷含量变化幅度小;甜叶菊中绿原酸类和类黄酮总量呈现降低-升高-稳定-降低的变化趋势,于126 d达到最高值后趋于稳定。结合三类有效成分含量和产量因素分析,确定新疆巴州甜叶菊谱星6号叶采收的最佳时期为9月中旬~10月初。在甜叶菊的栽培过程中,可以适当增加氮肥施量和打顶次数,以促进叶中有效成分和生物量的积累。
以澄清率和水提液中RA、ST、RC、新绿原酸、绿原酸、隐绿原酸、异绿原酸B、异绿原酸A、异绿原酸C含量的保留率为考察指标,采用不同的絮凝剂对甜叶菊水提液进行澄清处理。研究结果表明,以壳聚糖盐酸盐絮凝处理的澄清液中,3种糖苷和6种绿原酸类物质的保留率高,有利于后续工艺中大孔吸附树脂分别从澄清液中选择性吸附SGs和绿原酸类。温度为45 ℃、壳聚糖盐酸盐的添加量为0.45 g/L的絮凝条件下,水提液的澄清效果与硫酸亚铁+氢氧化钙絮凝处理的澄清效果相当。本研究为甜叶菊进一步开发和利用提供一定的理论基础。
