木瓜皮多酚和黄酮提取工艺优化及酪氨酸酶与胰脂肪酶抑制活性研究
2022-01-19裴文清吕泸楠王靖宇浦思琦王春丽
裴文清,吕泸楠,王靖宇,浦思琦,雷 霜,王春丽
(华东理工大学药学院, 制药工程与过程化学教育部工程研究中心,上海市新药设计重点实验室, 上海 200237)
木瓜是一种常见的热带水果,被认为是类胡萝卜素、叶酸、矿物质和抗坏血酸等的重要营养来源[1]。据报道,木瓜各部位都具有药用价值,如花可用于治疗黄疸和高血压,果肉可用于预防风湿病,叶子可用于治疗癌症[2-3]。SILVA等[4]认为木瓜皮含有的酚类物质可能极为丰富,因此木瓜皮作为果实加工过程中产生的废渣,其相当于果实重量的12%[5],若不能合理利用,将会对环境和经济造成一定负担,但是针对木瓜皮多酚类物质研究较少,主要集中在功能性食品开发上,如JIANG等[6]通过添加一定量的木瓜籽与果皮制备小麦饼干,HIRAGA等[7]研究将未成熟木瓜皮和果肉变为功能性食品的可能性。
黑色素在保护皮肤免受紫外线辐射方面具有重要作用。然而,黑色素的过量产生会导致各种皮肤疾病,如雀斑、黄褐斑、老年斑和黑色素瘤[8]。酪氨酸酶(EC 1.14.18.1)在黑色素生成过程中起着关键作用,其催化左旋酪氨酸(L-Tyr)羟基化为左旋多巴(LDopa),后者氧化为多巴醌,进而自发转化为多巴色素,随后转化为5,6-二羟基吲哚并进一步氧化和聚合生成黑色素[9],因此,抑制酪氨酸酶可有效阻止黑色素的生成,并可用于美白化妆品、临床、制药等行业。曲酸作为美白化妆品中的酪氨酸酶抑制剂,由于可能会致癌已经被一些国家禁用[10],因此,追求毒性较低且有效的酪氨酸酶抑制剂仍是研究热点。多酚类化合物副作用小,毒性低,是最常见的酪氨酸酶抑制剂[11-12],黄酮类化合物因含有酚羟基同样具有酪氨酸酶抑制作用[13],如柳伟等[14]发现木瓜皮具有较好地酪氨酸酶抑制活性,可能与其多酚含量有关。
肥胖和超重会引起各种疾病,如糖尿病、心血管疾病、癌症和神经退行性疾病[15]。胰脂肪酶(EC 3.1.1.3)是由胰腺合成和分泌的,可水解肠腔中50%~70%的脂肪,并将其水解成甘油和脂肪酸,因此抑制胰脂肪酶将有助于降低体重、降低高脂血症以及预防与肥胖相关的疾病[16-17]。皂苷类、萜类和酚类都是抑制胰脂肪酶的活性成分,但是酚类是研究最多的胰脂肪酶抑制剂,比如乌龙茶、白茶、绿茶和红茶多酚均抑制胰脂肪酶[18-19]。
近年来,针对木瓜皮酚类化合物抗氧化活性的研究较多[20-21],然而缺乏对酪氨酸酶及胰脂肪酶抑制活性的研究,基于此,本文一方面优化木瓜皮多酚和黄酮提取工艺,另一方面评价木瓜皮抑制酪氨酸酶及胰脂肪酶的活性,从而为综合利用木瓜皮提供思路。
1 材料与方法
1.1 材料与仪器
新鲜木瓜 购买于河南平顶山牛家村农贸市场;抗坏血酸(VC) 分析纯,上海源聚生物科技有限公司;奥利司他、曲酸、棕榈酸对硝基苯酯 分析纯,上海阿拉丁生化科技股份有限公司;芦丁、福林-酚试剂、亚硝酸钠、碳酸钠 分析纯,上海麦克林有限公司;九水硝酸铝、过硫酸钾、氢氧化钠 分析纯,国药试剂;2, 2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸[2, 2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS] 分析纯,Sigma-Aldrich公司;没食子酸 分析纯,国安试剂;胰脂肪酶(100 U/mL)、1, 1-二苯基-2-三 硝 基 苯 肼 (2, 2-diphenyl-1-picrylhydrazy,DPPH) 分析纯,上海源叶生物科技有限公司;酪氨酸酶(73 U/mL) 美国Worthington公司;左旋酪氨酸、左旋多巴 分析纯, Aladdin公司。
JY5002电子天平 上海复平仪器仪表有限公司;UV-1900PC紫外分光光度计 上海奥谱勒仪器有限公司;SK331OHP型超声波清洗仪 上海科导超声仪器有限公司;WK-400B型高速药物粉碎机山东精诚机械有限公司;多功能酶标仪 美国伯腾仪器有限公司;SHZ-3循环水多用真空泵 上海予华分析仪器有限公司;RE-52AA型旋转蒸发仪 上海振捷实验设备有限公司。
1.2 实验方法
1.2.1 原料预处理 新鲜木瓜洗净削皮,将果皮切成丝状,50 ℃烘干至恒重,粉碎过30目筛,于-20 ℃保存备用。
1.2.2 提取工艺 称取2.0 g木瓜皮粉末,加入一定量一定浓度的乙醇,在一定温度下以180 W超声提取一定时间后,抽滤,滤渣重复提取一次,旋转蒸发除去乙醇,定容,备用。
1.2.3 单因素实验
1.2.3.1 超声温度对木瓜皮多酚与黄酮提取的影响称取2.0 g木瓜皮粉末,按超声功率180 W,料液比1:20 g/mL,超声时间30 min,乙醇浓度50%,分别在30、40、50、60、70 ℃超声温度下进行提取,探究不同超声温度对木瓜皮多酚和黄酮提取量的影响,并确定最佳超声温度。
1.2.3.2 超声时间对木瓜皮多酚与黄酮提取的影响称取2.0 g木瓜皮粉末,按超声功率180 W,料液比1:20 g/mL,超声温度40 ℃,乙醇浓度50%,分别在15、30、45、60、75 min超声时间下进行提取,探究不同超声时间对木瓜皮多酚和黄酮提取量的影响,并确定最佳超声时间。
1.2.3.3 乙醇浓度对木瓜皮多酚与黄酮提取的影响称取2.0 g木瓜皮粉末,按超声功率180 W,料液比1:20 g/mL,超声温度40 ℃,超声时间 60 min,分别在40%、50%、60%、70%、80%乙醇浓度下进行提取,探究不同乙醇浓度对木瓜皮多酚和黄酮提取量的影响,并确定最佳乙醇浓度。
1.2.3.4 料液比对木瓜皮多酚与黄酮提取的影响称取2.0 g木瓜皮粉末,按超声功率180 W,超声温度40 ℃,乙醇浓度50%,超声时间60 min,分别在1:10、1:15、1:20、1:25、1:30 g/mL料液比的条件下进行提取,探究不同料液比对木瓜皮多酚和黄酮提取量的影响,并确定最佳料液比。
1.2.4 正交试验 在单因素实验基础上,以多酚和黄酮含量为评价指标,设计L9(34)正交试验用以确定提取木瓜皮多酚和黄酮的最佳工艺条件,实验因素设计见表1。

表1 正交试验因素水平设计Table 1 Factors and levels of orthogonal experiment
1.2.5 多酚含量测定 参照文献[20]并略作修改:取样品溶液1.5 mL,加入1.0 mL福林酚试剂,混匀后静置5 min后加入2.0 mL 10% Na2CO3,混合后定容到25 mL,25 ℃放置1 h后于765 nm处测定吸光度。以(0~16 μg/mL)没食子酸为标准品,绘制标准曲线y=0.1208x-0.0022(R2=0.9996)。多酚含量(以没食子酸计)用mg/g表示。
1.2.6 黄酮含量测定 参照文献[21]并略作修改:取样品溶液0.2 mL,分别加5%亚硝酸钠溶液0.4 mL,摇匀放置6 min后加10%硝酸铝溶液0.4 mL,摇匀放置6 min,加入4%氢氧化钠溶液4 mL,最后用50%乙醇溶液加至刻度线,摇匀放置15 min后,分别于510 nm处测定吸光度。以( 0~80 μg/mL)芦丁为标准品,绘制标准曲线y=0.0145x+0.0008(R2=0.9996)。黄酮含量(以芦丁计)用mg/g 表示。
1.2.7 抗氧化活性测定
1.2.7.1 DPPH自由基清除能力参考文献[20]并略作改动。取一系列浓度(0.2~1.0 mg/mL)的样品溶液1 mL及4 mL 0.02 mg/mL DPPH 溶液加入试管中,混匀后放置30 min,并在517 nm处测定吸光度A1。测定用无水乙醇代替DPPH溶液时的吸光度A2,用50%乙醇代替样品溶液时的吸光度A0;VC作同样处理,DPPH自由基的清除率按公式1计算。

1.2.7.2 ABTS自由基清除能力测定 参照文献[22]配制ABTS储备液,并用无水乙醇调整使其在734 nm处 的 吸 光 值 处 在(0.7000±0.005),即 得ABTS工作液。取一系列浓度(0.2~1.0 mg/mL)的样品溶液1 mL及4 mL的ABTS工作液中放入试管中,充分混匀,暗处反应6 min 后在734 nm下测定吸光值A1,同时测定用无水乙醇代替ABTS时的吸光度A2,用蒸馏水代替样品溶液时的吸光度A0。VC作同样处理,ABTS自由基的清除率参考公式1计算。
1.2.8 抑制酶活性测定
1.2.8.1 抑制酪氨酸酶活性参考文献[23]并略作改动,按表2进行反应,分别以左旋酪氨酸和左旋多巴作为底物,将50 μL磷酸盐缓冲液(0.2 mol/L,pH6.8),20 μL酪氨酸酶溶液和50 μL样品提取液添加到96孔板中,在37 ℃下恒温10 min。随后,加入80 μL底物,在37 ℃下恒温5 min。最后,通过使用酶标仪测量在475 nm下的溶液吸光值。曲酸作同样处理。酪氨酸酶抑制率按公式2计算。
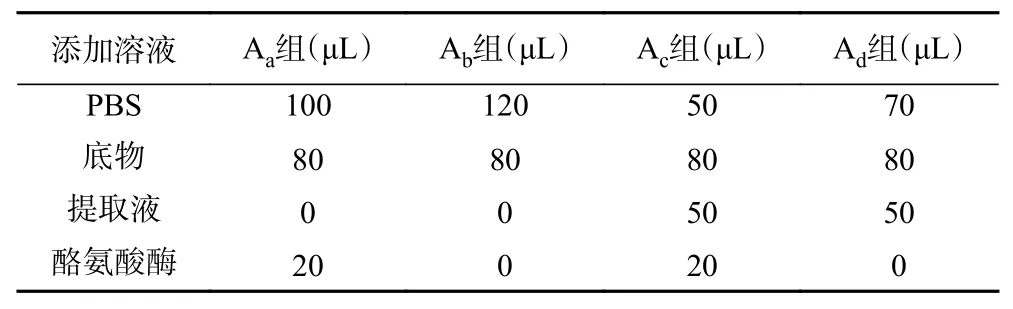
表2 反应体系组成Table 2 Composition of reaction system

式中:Aa代表无样品的对照组的吸光度;Ab代表不含样品和酶的空白对照组的吸光度;Ac代表样品含有酶的吸光度;Ad代表不含酶的样品对照组的吸光度。
1.2.8.2 抑制胰脂肪酶活性 棕榈酸对硝基苯酯作为脂肪酶的水溶性底物,被酶水解可得黄色产物4-硝基苯酚,因此本实验使用棕榈酸对硝基苯酯作为底物,参考文献[24]并略作改动,按表3进行反应,将30 μL磷酸缓冲液、50 μL胰脂肪酶溶液和20 μL样品提取液加到96孔板中,在37 ℃恒温15 min,随后,加入100 μL底物,在37 ℃恒温15 min。最后,通过使用酶标仪测量在405 nm下的溶液吸光值。奥利司他作同样处理。胰脂肪酶抑制率参考公式2计算。
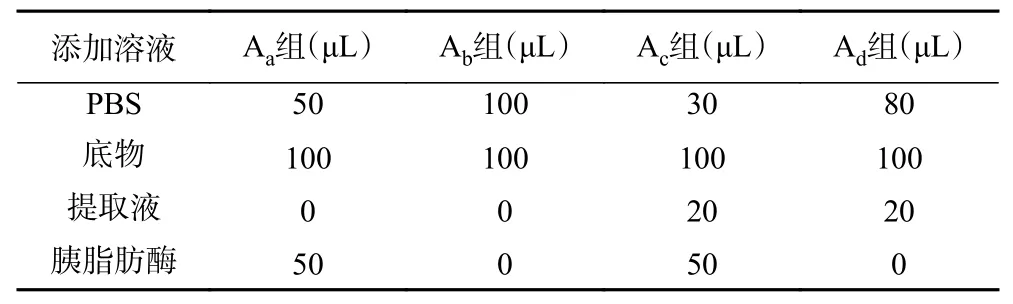
表3 反应体系组成Table 3 Composition of reaction system
1.3 数据处理
所有试验均重复测定三次,数值表示为平均值±标准差。利用Origin 8.0作图,采用正交设计助手进行实验设计和方差分析。
2 结果与分析
2.1 单因素实验结果
2.1.1 超声温度对提取木瓜皮多酚和黄酮的影响由图1可知,多酚和黄酮含量整体呈先上升后下降的趋势,当温度从30 ℃升高到 40 ℃时,木瓜皮多酚和黄酮含量缓慢增长,当提取温度为40 ℃时,多酚和黄酮含量均达到最高,分别为(75.79±1.42)mg/g和(153.56±3.25)mg/g,当温度超过40 ℃时,多酚和黄酮含量开始减少,说明多酚和黄酮含量受温度影响较大,当温度升高时,分子运动剧烈,扩散性增大,随之含量增加,但当温度过高时,可能影响到分子的稳定性,导致结构遭到破坏,致含量下降[25]。因此,选择40 ℃为最佳超声温度。
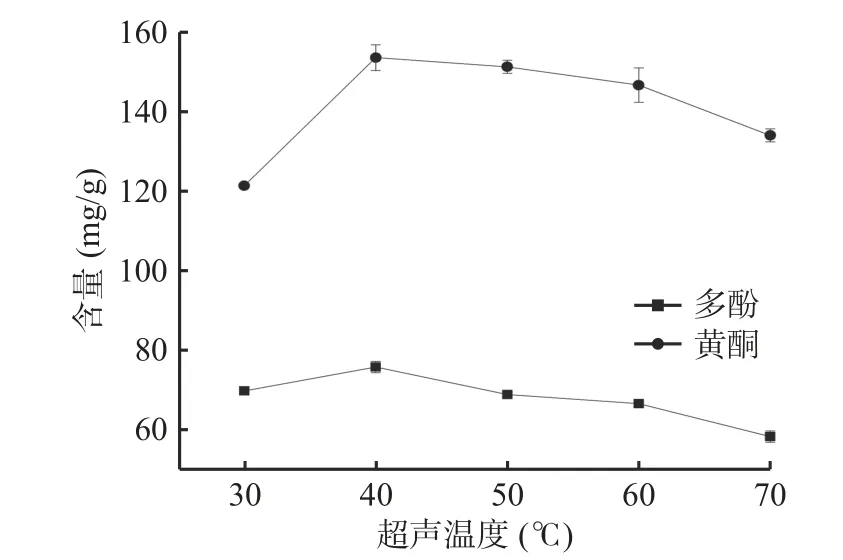
图1 超声温度对木瓜皮多酚和黄酮含量的影响Fig.1 Effect of ultrasonic temperature on polyphenols and flavonoids contents of papaya peel
2.1.2 超声时间对提取木瓜皮多酚和黄酮的影响由图2可知,随着超声时间的延长,木瓜皮多酚和黄酮含量整体上一直有所增加,当时间为60 min时,多酚和黄酮含量均达到最高,分别是(72.34±0.33)mg/g和(157.01±3.25)mg/g,而当超声时间超过60 min,多酚和黄酮含量下降趋势较大,可能是由于时间延长,伴随着超声过程中溶液温度的升高,导致酚类物质发生氧化、降解,致使其含量下降[26]。因此选择60 min作为超声时间比较合适。
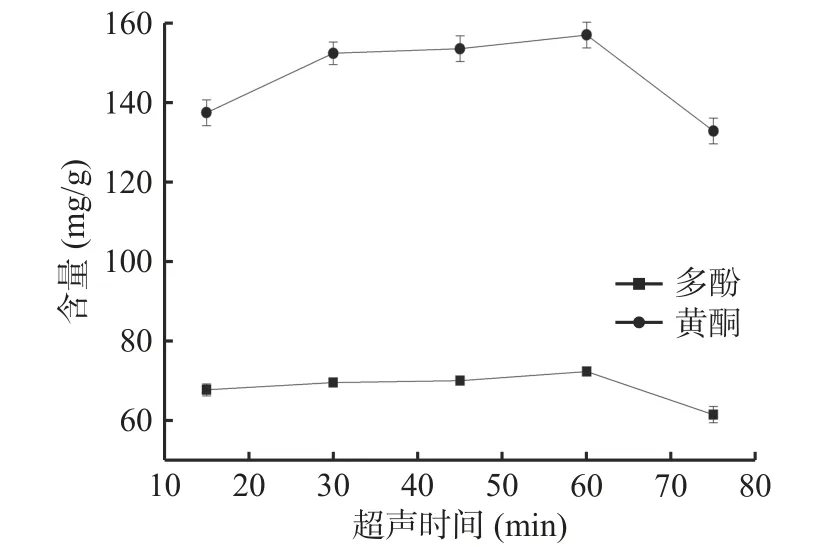
图2 超声时间对木瓜皮多酚和黄酮含量的影响Fig.2 Effect of ultrasonic time on polyphenols and flavonoids contents of papaya peel
2.1.3 乙醇浓度对提取木瓜皮多酚和黄酮的影响由图3可知,乙醇浓度在40%~50%范围内时,木瓜皮多酚和黄酮含量随着浓度的增大而增大,当乙醇浓度为50%时,木瓜皮多酚和黄酮含量均达到最高,分别是(80.85±0.56)mg/g和(159.31±4.88)mg/g。当乙醇浓度超过50%时,木瓜皮多酚和黄酮含量逐渐减少。乙醇浓度会影响木瓜皮中多酚和黄酮含量,考虑到水与乙醇互溶,因此需要选择合适的比例[27]。此外,当乙醇浓度较小时,不能完全溶解木瓜皮中的多酚和黄酮类物质,当浓度过大时,又可能使木瓜皮中其他溶于醇的杂质流出,而导致其含量降低[28]。因此选择50%乙醇浓度比较合适。

图3 乙醇浓度对木瓜皮多酚和黄酮含量的影响Fig.3 Effect of ethanol concentration on polyphenols and flavonoids contents of papaya peel
2.1.4 料液比对提取木瓜皮多酚和黄酮的影响 由图4可知,随着料液比的增大,木瓜皮多酚和黄酮含量开始逐渐增大,当料液比为1:20 g/mL时,多酚和黄酮含量均达到最大值,分别为(79.70±0.86)mg/g和(160.46±4.30)mg/g,超过1:20 g/mL时,多酚和黄酮含量开始减少,可能是当料液比为1:20 g/mL时,木瓜皮中多酚和黄酮已全部溶出,再增大料液比可能使其他醇溶性杂质析出,与活性成分共同竞争溶出空间从而导致含量下降[29]。因此,选择1:20 g/mL为最佳料液比。

图4 料液比对木瓜皮多酚和黄酮含量的影响Fig.4 Effect of solid-liquid ratio on polyphenols and flavonoids contents of papaya peel
2.2 正交试验结果
通过单因素实验,可知木瓜皮多酚与黄酮含量受超声温度(A)、超声时间(B)、乙醇浓度(C)和料液比(D)的影响较大,故而设计L9(34)正交试验,考察多酚与黄酮的最佳提取工艺,并进行分析,结果见表4,表5。
结合表4与表5,可知4个因素影响木瓜皮多酚和黄酮含量趋势一致,均为D(料液比)>B(超声时间)>A(超声温度)>C(乙醇浓度),此外木瓜皮多酚和黄酮通过正交试验得到的最优组合一致,均为A2B2C3D3,即超声温度40 ℃、超声时间60 min、乙醇浓度60%、料液比1:25 g/mL。

表4 正交试验结果Table 4 Results of orthogonal experiment
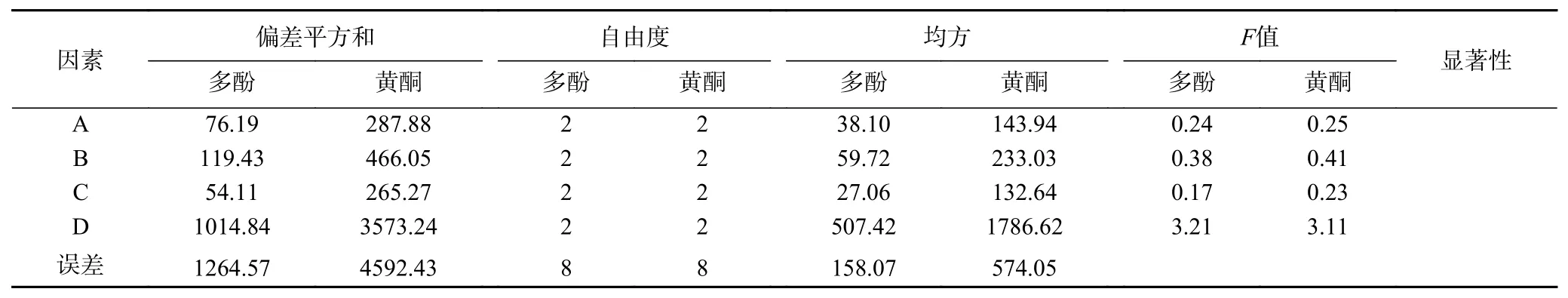
表5 方差分析结果Table 5 Results of variance analysis
2.3 验证实验
按照最佳提取工艺条件A2B2C3D3进行三次平行实验,结果得到多酚含量平均为(82.00±0.65)mg/g,黄酮含量平均为(162.76±2.82)mg/g,均高于上述9个实验组合,说明经过正式试验优化得到的木瓜皮提取工艺组合较为可行。
2.4 抗氧化活性测定结果
2.4.1 DPPH自由基清除率测定 DPPH是一种稳定的自由基,当接受电子或自由基时,溶液颜色由紫色逐渐变淡,同时伴随着在最大波长处吸光值的降低,故可根据吸光值的变化评价物质的抗氧化活性[30]。结合图5,木瓜皮提取物有较强的清除DPPH自由基的能力。当浓度为0.2 mg/mL时,清除率为(67.74%±0.27%),高于ASGHAR等[31]研究中木瓜皮对DPPH自由基的清除率,这可能是因为木瓜皮提取物中含有较高的多酚和黄酮类物质。当浓度从0.2 mg/mL增加到0.8 mg/mL时,清除率整体增长较快,而当浓度超过0.8 mg/mL时,清除率增长缓慢甚至基本不变,当处于最大浓度时,木瓜皮提取物和VC对DPPH自由基的清除率分别为(94.79%±0.10%)和(96.00%±0.10%),故木瓜皮提取物抗氧化活性较强。

图5 DPPH自由基清除实验结果Fig.5 Results of DPPH free radical scavenging capacity
2.4.2 ABTS自由基清除率测定 由图6可知,木瓜皮提取物具有清除ABTS自由基的能力。当浓度处于0.2 mg/mL时,木瓜皮提取物和VC对ABTS自由基清除率分别达到(93.27%±0.23%)和(98.35%±0.17%),说明在较低浓度范围就具有较强的抗氧化活性。当浓度高于0.6 mg/mL时,清除率增长缓慢直至基本不变,当浓度达到最大时,木瓜皮提取物对ABTS自由基清除率为(96.94%±0.23%),略高于澳洲坚果青皮(89.14%±0.33%)[32],接近于香芋皮(99.82%±0.07%)[33],说明木瓜皮提取物有较强的抗氧化活性,具有应用于天然抗氧化剂的潜力。
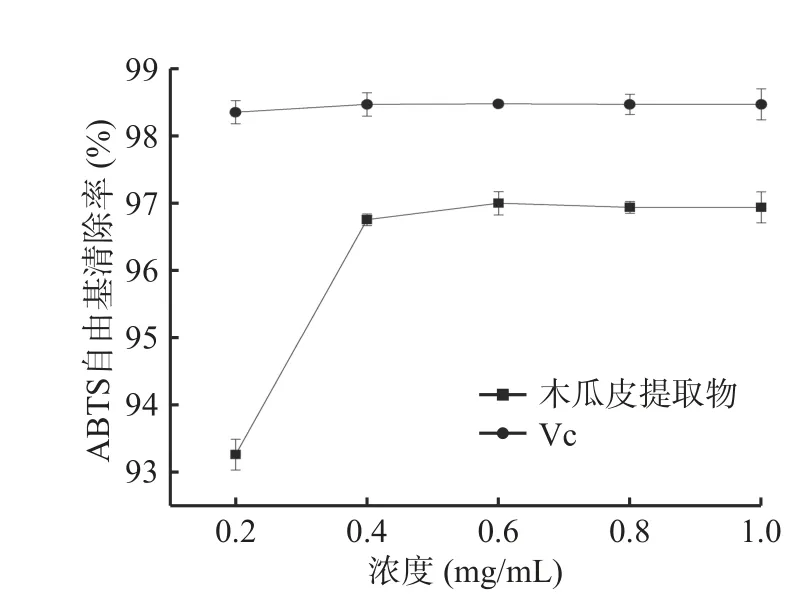
图6 ABTS自由基清除实验结果Fig.6 Results of ABTS free radical scavenging capacity
2.5 抑制酶活性测定结果
2.5.1 酪氨酸酶抑制活性测定 本文分别以L-Tyr和L-Dopa作为底物,发现木瓜皮提取物具有酪氨酸酶抑制活性,结果见图7。在2.0~10.0 mg/mL浓度范围内,木瓜皮提取物对酪氨酸酶抑制活性随着浓度的增大而增强,并呈现较好的线性关系和剂量效应关系。当浓度为8.0 mg/mL时,木瓜皮提取物以L-Tyr为底物的酪氨酸酶抑制率达到(69.44%±3.93%),略高于LEE等[34]研究中木瓜对酪氨酸酶的抑制率。在质量浓度为10.0 mg/mL 时,以L-Tyr作为底物,木瓜皮提取物抑制率为(83.33%±6.80%);以L-Dopa作为底物,木瓜皮提取物抑制率为(67.12%±0.32%),结果表明,木瓜皮提取物能在一定程度上抑制酪氨酸酶活性,可能会阻止或者中断黑色素形成,揭示木瓜皮或许可作为潜在的酪氨酸酶抑制剂,成为美白化妆品的天然原料。
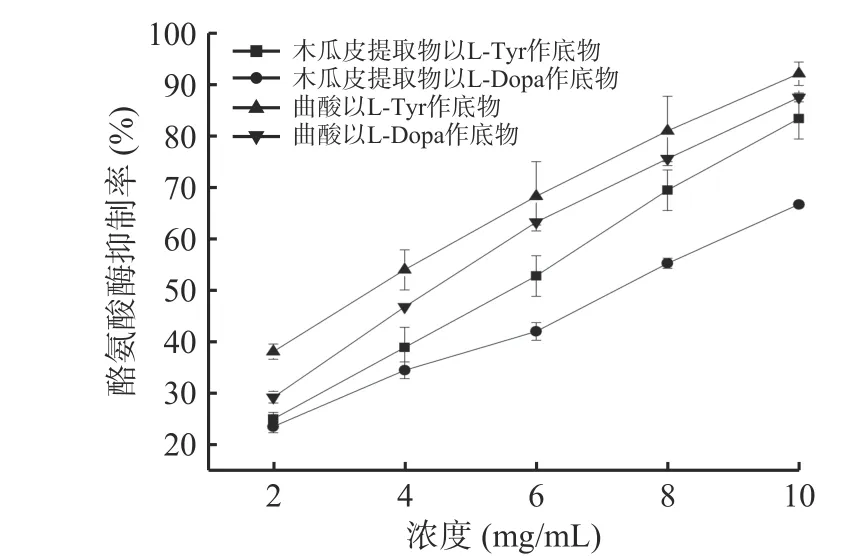
图7 酪氨酸酶抑制活性实验结果Fig.7 Results of tyrosinase inhibitory activity
2.5.2 胰脂肪酶抑制活性测定 木瓜皮提取物具有良好的胰脂肪酶抑制活性,结果如图8所示。在2.0~10.0 mg/mL浓度范围内,木瓜皮提取物对胰脂肪酶抑制率随着浓度的增大而增加,表现出较好地线性关系。在最大浓度时,木瓜皮提取物对胰脂肪酶抑制率为(82.78%±1.28%),高于木瓜汁对胰脂肪酶的抑制率[35],说明木瓜皮具有开发为胰脂肪酶抑制剂的潜力。
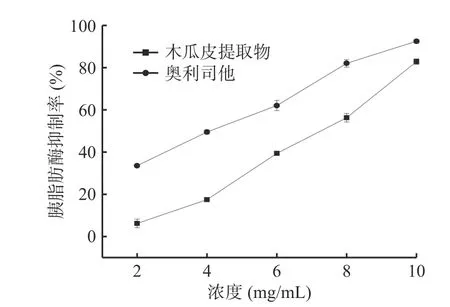
图8 胰脂肪酶抑制活性实验结果Fig.8 Results of pancreatic lipase inhibitory activity
3 结论
本实验对木瓜皮多酚和黄酮的提取工艺进行了优化,发现两者最佳提取条件一致,即超声温度40 ℃、超声时间60 min、乙醇浓度60%、料液比1:25 g/mL,在此条件下多酚和黄酮的含量分别为(82.00±0.65)mg/g和(162.76±2.82)mg/g。
在最优提取条件下,评价木瓜皮提取物的抗氧化、酪氨酸酶和胰脂肪酶抑制活性。木瓜皮提取物对DPPH自由基、ABTS自由基的清除率分别可达(94.79%±0.10%)和(96.94%±0.23%),接近VC对这两种自由基的最大清除率,说明木瓜皮具有较好地抗氧化活性。
以L-Tyr为底物,发现木瓜皮提取物对酪氨酸酶具有较强地抑制活性,说明木瓜皮提取物可能会阻止酪氨酸酶将L-Tyr羟基化为L-Dopa,而以LDopa为底物,发现木瓜皮提取物仍具有一定的酪氨酸酶抑制活性,说明木瓜皮提取物可能会阻止酪氨酸酶将L-Dopa氧化为多巴醌。此外,木瓜皮提取物还具有较强地胰脂肪酶抑制活性,抑制率可达(82.78%±1.28%),表明木瓜皮可能是较好地胰脂肪酶抑制剂,能阻止或中断胰脂肪酶将脂肪水解为甘油和游离脂肪酸从而减少肠道吸收。由此可知,木瓜皮具有开发为酪氨酸酶和胰脂肪酶抑制剂的潜力,并可应用于美白化妆品、医学美容、减肥和医疗等行业。
