一种新型绵羊乳酪蛋白ACE抑制肽结构鉴定及分子结合机制分析
2022-01-19汤海霞王爽爽宋宇轩葛武鹏
汤海霞,王爽爽,郝 果,宋宇轩,张 磊,葛武鹏,
(1.西北农林科技大学食品科学与工程学院, 陕西杨凌 712100;2.陕西省羊乳产品质量监督检验中心, 陕西富平 711700;3.西北农林科技大学动物科技学院, 陕西杨凌 712100)
高血压以体循环动脉血压(收缩压或舒张压)升高为主要特征(收缩压≥140 mmHg,舒张压≥90 mmHg)。高血压病人会出现清晨头痛、流鼻血和耳朵嗡嗡作响等症状,如果不及时治疗,会导致持续的胸痛(也称为心绞痛)、心脏病发作、心力衰竭和心律不齐,从而导致猝死[1]。血管紧张素转换酶(Angiotensin-I-Converting Enzyme,ACE)是血管紧张素系统中的一种关键酶,可以催化血管紧张素Ⅰ转化为具有强大的血管收缩作用的血管紧张素Ⅱ,并且使具有降血压作用的缓激肽失活[2]。因此,可以通过抑制ACE活性来治疗高血压。血管紧张素转换酶抑制剂(Angiotensin-I-converting enzyme inhibitors,ACEI)已被广泛研究用于预防和控制高血压。但人工合成的ACEI具有不良副作用,例如持续性干咳、皮疹和味觉障碍等[3]。为了解决上述问题,越来越多的学者开始聚焦于天然来源的ACE抑制肽研究,目前人们已经从乳[4]、豌豆[5]、鸡蛋[6]、刺参[7]和红松仁[8]等天然食物中分离得到ACE抑制肽。
很多研究已经从不同乳源来源的酪蛋白中分离得到ACE抑制肽,例如,CHEN等[9]使用复合蛋白酶水解牛乳,鉴定得到2条新的ACE抑制肽VLPVPQ和VAPFPE;ESPEJO-CARPIO等[10]利用枯草杆菌蛋白酶和胰蛋白酶水解羊乳酪蛋白,结果发现1条新ACE抑制肽WY。UGWU等[11]将胃蛋白酶和胰蛋白酶混合分别水解驼乳和马乳来源的酪蛋白,得到的酪蛋白水解液有显著的ACE抑制率。我国绵羊乳产量位居世界第二位,绵羊乳中酪蛋白平均含量为4.5%,乳清蛋白仅占1%左右[12],目前关于绵羊乳酪蛋白的研究较少。酶解法因其设备要求简单,条件温和易于控制并且可以根据蛋白酶的酶切位点得到特定的肽类等特点,常用于活性肽的制备[13]。
因此,本文首次以绵羊乳酪蛋白为原料制备ACE抑制肽,为开发绵羊乳降血压功能性食品提供了理论依据及技术参考。本文选择碱性蛋白酶、胰蛋白酶、胃蛋白酶和蛋白酶K水解绵羊乳酪蛋白,筛选ACE抑制率最高的酪蛋白水解物进行氨基酸结构鉴定,最后采用Linewaver-Burk作图和分子对接模拟对肽段抑制机理进行研究。
1 材料与方法
1.1 材料与仪器
绵羊乳 采自甘肃省金昌奶绵羊试验示范基地;胰蛋白酶(2500 U/mg) 上海源叶公司;蛋白酶K(40 mAnsom U/mg) 德国默克公司;碱性蛋白酶(2.4LFG) 诺维信公司;胃蛋白酶(≥250 U/mg)、邻苯二甲醛(OPA)、L-丝氨酸 北京索莱宝有限公司;马尿酸-组氨酸-亮氨酸(HHL) 上海麦克林公司;血管紧张素转换酶(ACE≥2.0 U/mg)、乙腈 色谱级,美国Sigma公司。
ÄKTA蛋白纯化系统 美国GE公司;5417R高速冷冻离心机 德国Eppendorf公司;LGJ-25C真空冷冻干燥机 北京四环科学仪器厂有限公司;LTQ Orbitrap Velos 赛默飞世尔科技;1100型高效液相色谱 美国Agilent公司;UV-1900紫外分光光度计 日本岛津。
1.2 实验方法
1.2.1 分离制备绵羊奶酪蛋白 绵羊乳离心脱脂(5000 r/min,15 min,4 ℃)重复两次,用2 mol/L的HCl调节pH至4.2,室温静置30~60 min后离心(4700 r/min,10 min,4 ℃)弃上清液,得到的沉淀即为酪蛋白粗品,依次用酸性水(pH4.2)清洗3次,用蒸馏水清洗3次[14],然后进行真空冷冻干燥。
1.2.2 蛋白酶的筛选 将绵羊乳酪蛋白粉末配成底物浓度为5%的溶液,调节溶液到每种酶的最适酶解条件(蛋白酶K,pH7.5,37 ℃;碱性蛋白酶,pH7.0,55 ℃;胃蛋白酶,pH3.0,37 ℃;胰蛋白酶,pH8.0,37 ℃),试验前期查阅文献[15],综合考虑选择酶添加量为3%,用1 mol/L NaOH维持酶解体系的pH不变,反应1 h取一次样品,在95 ℃下灭活15 min,冷却至室温调pH到7.0,离心(10000 r/min,15 min,4 ℃)取上清液,测定样品的水解度和ACE抑制率。
1.2.3 绵羊乳酪蛋白水解液水解度的测定 水解度(Degree of hydrolysis,DH)的测定采用OPA法[16]。向1 mL的OPA试剂(40 mg OPA溶解在1 mL的甲醇中,加入0.95 g的四硼酸钠,0.5 g的SDS,100 μL的β-疏基乙醇,去离子水定容到50 mL)中加入100 μL的丝氨酸标准液(浓度为0.9516 meqv/L)、样品和去离子水涡旋5 s,室温避光条件下精确反应2 min后在340 nm下测吸光度(OD)。DH的计算方程如式(1)~式(3):
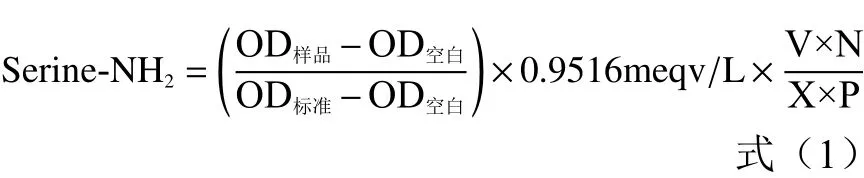
式中:Serine-NH2:每克蛋白中Serine-NH2的量;V:样品的总体积;N:样品的稀释倍数;X:样品的质量;P(%):样品中蛋白质的含量。
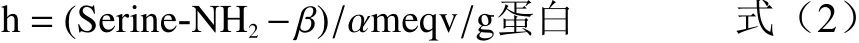
式中:h:样品水解过程中每克酪蛋白被断裂的肽键数;α、β:是常数分别为1.039、0.383。

式中:htot:每克酪蛋白所含的总肽键数为8.2。
1.2.4 ACE抑制率的测定 ACE抑制率的测定在CUSHMAN等[15]的方法上稍作修改。向离心管中加入10 μL样品和30 μL 2.5mmol/L HHL,37 ℃培养5 min,加入20 μL的50 mU/mL ACE,37 ℃振荡培养60 min,加入60 μL的1 mol/L HCl终止反应。HHL释放的马尿酸(HA)浓度通过HPLC测定。通过公式4计算
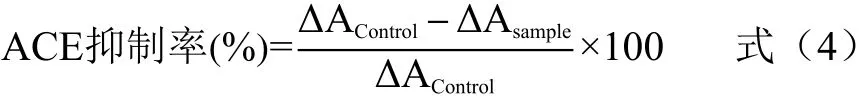
式中:ΔAControl和ΔAsample分别代表空白(缓冲液)和样品中HA的峰面积。
HPLC检测条件:分析柱:C18柱(150 mm×4.6 mm,5 μm);柱温:25 ℃;流速:0.5 mL/min;上样量:10 μL;流动相A:含有0.05% TFA的超纯水;流动相B:乙腈;洗脱条件:78%流动相A和22%流动相B等度洗脱30 min;检测器波长:228 nm。
1.2.5 酪蛋白酶解液中分子量的测定 将冷冻干燥后的多肽样品配成浓度为20 mg/mL的溶液,过0.22 μm的滤膜,试验采用ÄKTA pure 100蛋白纯化系统,分离凝胶柱为:SuperdexPeptide10/300GL柱(300 mm×10 mm,GE公司)。洗脱条件:流动相:乙腈:水:三氟乙酸=30:70:0.1 (v/v),上样量:500 μL,流速0.5 mL/min,检测波长为220 nm。同时,选择牛乳白蛋白 (6800 Da)、α-乳白蛋白 (14186 Da)、维生素B12(1355 Da)、氧化型谷胱甘肽(612.63 Da)、甘氨酸(75 Da)为标准品测定标准曲线,标准曲线方程为:y=-0.1192x+7.2412(R2=0.9963)。
1.2.6 绵羊乳酪蛋白酶水解液超滤分离 使用10 kDa和3 kDa的超滤管在4 ℃对酪蛋白水解液进行初步分离,获得>10 kDa、10~3 kDa、<3 kDa 3个组分,冷冻干燥后测各组分ACE抑制活性的IC50。
1.2.7 酪蛋白酶解液中肽段结构鉴定 将小于3 kDa组分的多肽粉末重新溶解在0.1%三氟乙酸中,用Thermo-DionexUltimate3000高效液相色谱和LTQOrbitrapVelos质谱仪分析多肽结构。分析柱是石英毛细管柱(15 mm×75 μm);流动相A为含有0.1%甲酸的水,流动相B含有0.1%甲酸和80%乙腈的水;梯度洗脱程序为0~2 min,8%~18%B;2~32 min,18%~35%B;32~34 min,35%~100%B;34~42 min,100%B;进样量:6 μL;流速:0.3 μL/min,全扫描质谱(350~1500 m/z,60000分辨率)。
1.2.8 化学合成ACE抑制肽及其IC50的测定 筛选和预测的潜在的ACE抑制肽在上海生工生物工程股份有限公司采用固相合成法进行合成,经高效液相色谱法验证,该肽的纯度≥98%。将合成的肽配成浓度为2、5、10、15、25 μmol/L的溶液,按照1.2.4的方法测定肽的ACE抑制率。
1.2.9 ACE抑制动力学测定 使用1/V和1/HHL的Linewaver-Burk做图分析KYIPIQY对血管紧张素转换酶抑制模式,方法在SUTOPO等[17]基础上稍有修改。将KYIPIQY(0、3、8 μmol/L)和不同浓度的HHL(0.5、2、2.5、3.5 mmol/L)与ACE按1.2.4方法混合培养,测定马尿酸的含量,根据主图的Y轴和X轴截距计算Vmax和Km。
1.2.10 分子对接肽KYIPIQY的结构 由Discovery-Studio2019clien软件生成,用CHARMm力场对配体进行能量最小化;从RCSB蛋白质数据库下载ACE晶体结构(代码:1O8A,PDB),用软件中的Clean-Protein模块对ACE进行加氢、去水处理,定义活性坐标为(X: 38.977,Y: 38.645,Z: 50.183),对接半径为 10Å,选择程序CDOCKER进行半柔性分子对接[18],根据对接结果中“-CDOCKEREnergy”和“-CDOCKERInteractionEnergy”的值确定肽与ACE结合最佳方式,然后分析肽与ACE的相互作用位点和相互作用力类型评估分子对接的结果。
1.3 数据分析
所有数据重复三次并采用Origin 2018进行数据分析并作图。
2 结果与分析
2.1 最适蛋白酶的筛选
在一定范围内,水解度的大小与蛋白质水解释放的肽段含量成正比,蛋白质的水解程度影响着水解产物的功能和生物活性,因此测定酶解过程中水解物的水解度具有重要意义。图1a显示,四种蛋白酶在水解60、120、180 min后酪蛋白水解液的水解度都随着酶解时间的延长而增大,水解度在2.02%和16.69%之间。其中碱性蛋白酶的绵羊乳酪蛋白水解液的水解度最大,胰蛋白酶和蛋白酶K没有显著差异(P>0.05),胃蛋白酶的酪蛋白水解液的水解度最小。四种蛋白酶的酪蛋白水解液的水解度的显著差异(P<0.05)可能与酶促反应的速率或酶和底物亲和力的特定作用有关[19]。
4种蛋白酶在不同水解时间获得的水解产物的ACE抑制率为78.3%至94.3%(图1b)。除蛋白酶K的酪蛋白水解液ACE抑制率最大值在60 min为92.6%,其余3种蛋白酶的酪蛋白水解液的ACE抑制率都随着酶解时间的延长呈现出先增大后减小的趋势,这些结果表明,酶处理的程度影响水解物的ACE抑制率,与舒国伟等[20]使用蛋白酶水解山羊乳酪蛋白制备ACE抑制肽结果类似,可能是肽段的分子量在酪蛋白水解液降血压中发挥重要作用。碱性蛋白酶120 min的ACE抑制率最大为94.3%。因此,试验测定了四种酪蛋白水解物在不同水解时间的分子量分布,结果如图1c所示,虽然所有水解产物中仍含有>10 kDa的蛋白,但与未水解的酪蛋白对比,蛋白质分解明显,并且随着酪蛋白水解液水解度的增大小分子肽逐渐分解,将具有ACE抑制活性的肽逐渐水解为不具有ACE活性的肽段,导致酪蛋白水解液的抑制活性降低。
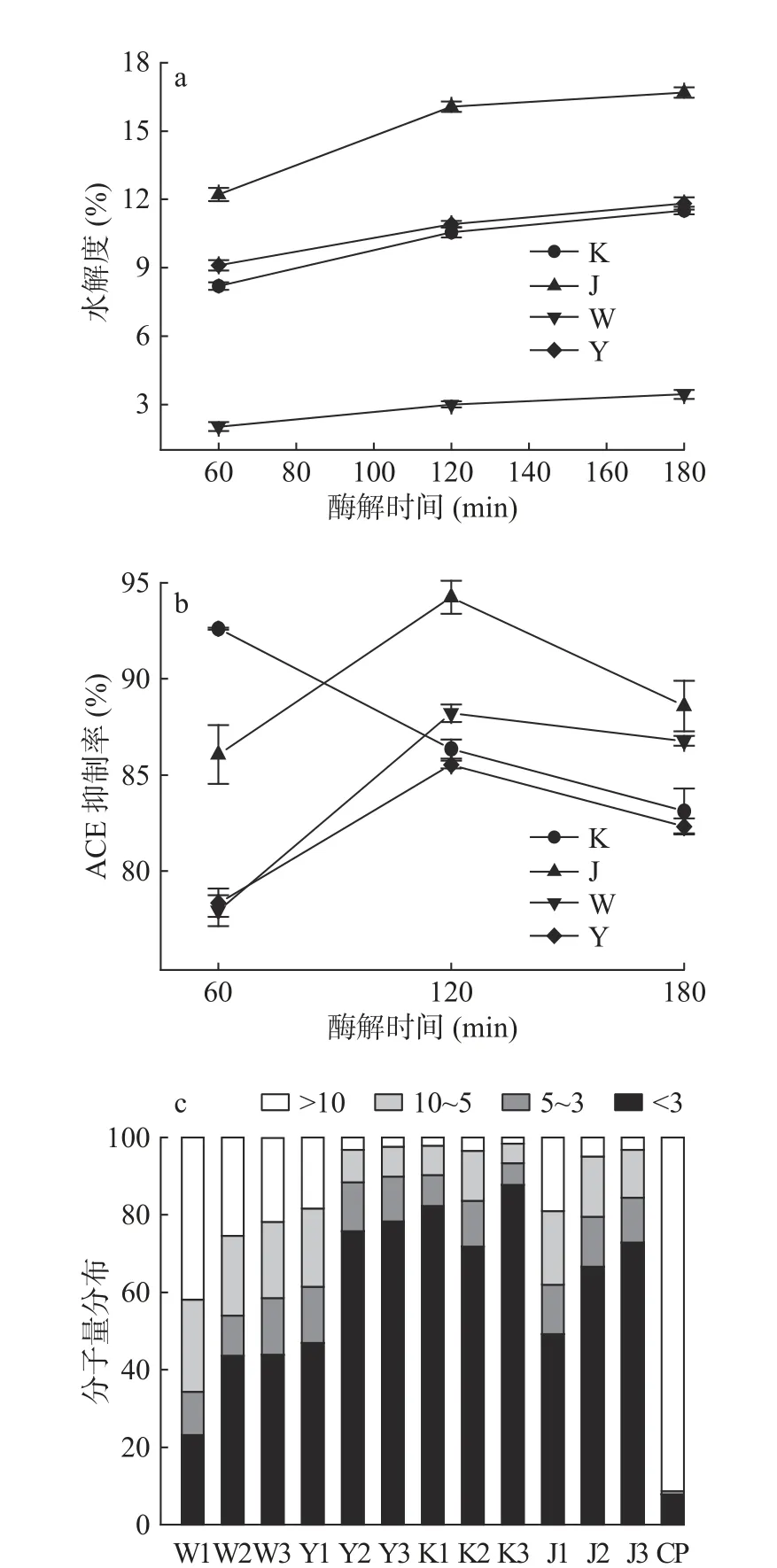
图1 不同蛋白酶水解对酪蛋白水解度(a)、ACE抑制率(b)和分子量分布(c)的影响Fig.1 Effects of different proteases on degree of hydrolysis (a),ACE inhibition rate (b) and molecular weight distribution(c) of casein hydrolysate
2.2 不同分子质量酪蛋白肽组分对ACE抑制率的影响
使用超滤管对J120 绵羊乳酪蛋白水解液进行截留,得到组分I(>10 kDa)、组分II(3~10 kDa)和组分III(<3 kDa),冷冻干燥后配成浓度800 μg/mL的溶液测ACE抑制率。结果如图2所示,各组分均有ACE抑制活性,但随着组分分子量减小,ACE抑制率增高,其中组分III的ACE抑制率为84.5%。马莹等[21]用超滤管对乳清蛋白水解液进行超滤分离,显示<3 kDa组分的ACE抑制活性最高。本研究结果与YU等[22]的研究结果相一致,相比于大分子量的多肽,小分子量的多肽显示出更高的ACE抑制活性。因此选择<3 kDa的组分进行下一阶段实验。
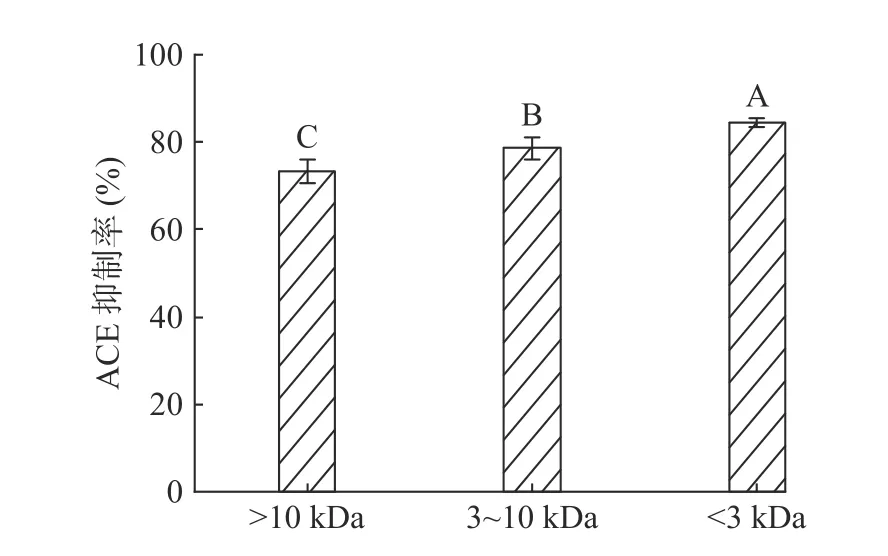
图2 不同分子质量多肽组分对ACE抑制率的影响Fig.2 Effect of casein peptides with different molecular weights on ACE inhibition rate
2.3 ACE抑制肽质谱鉴定分析
使用LTQOrbitrapVelos质谱仪对小于3 kDa的组分进行肽鉴定,共鉴定出411条肽段,其中源自αs1-、αs2-、β-和κ-酪蛋白分别为84、116、137和74,表1列出了分子量小于1300 Da的肽,经过在BIOPEP和SwePep数据库搜索比对,发现已经验证ACE抑制活性的肽段有19条,是酪蛋白水解液具有高ACE抑制率的主要原因。
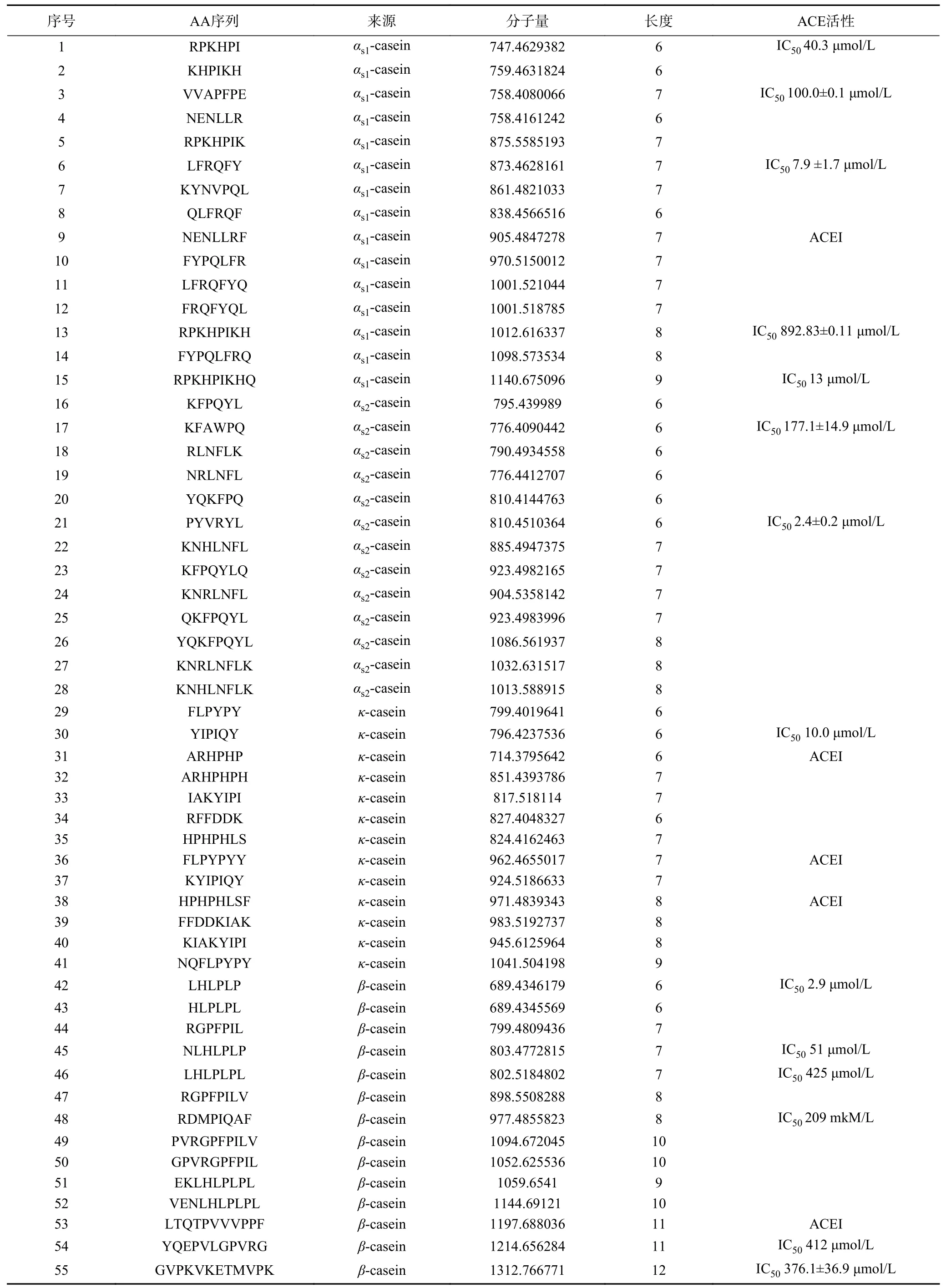
表1 酪蛋白水解物肽谱的质谱鉴定Table 1 Identification of peptide spectrum of casein hydrolysate by mass spectrometry
通过阅读文献发现,当一条肽段含有ACE抑制活性肽的片段,那么这条肽段也可能具有ACE抑制活性。例如,KAI等[23]证明了来自牦牛κ-酪蛋白的肽KYIPIQ具有ACE抑制活性,其IC50为7.8 μmol/L;同样GÓMEZ-RUIZ等[24]用蛋白酶水解绵羊乳酪蛋白得到κ-酪蛋白肽YIPIQY也显示了抗高血压的功能,ACEI的IC50为10.0 μmol/L。新鉴定的7肽KYIPIQY来源于目前的酪蛋白水解物,包含具有ACEI活性的片段,即KYIPIQ和YIPIQY。因此,7肽-KYIPIQY极有可能具有ACE抑制活性,为了验证此肽段是否具有ACEI活性,试验选择KYIPIQY进行人工合成肽。图3为其二级结构。
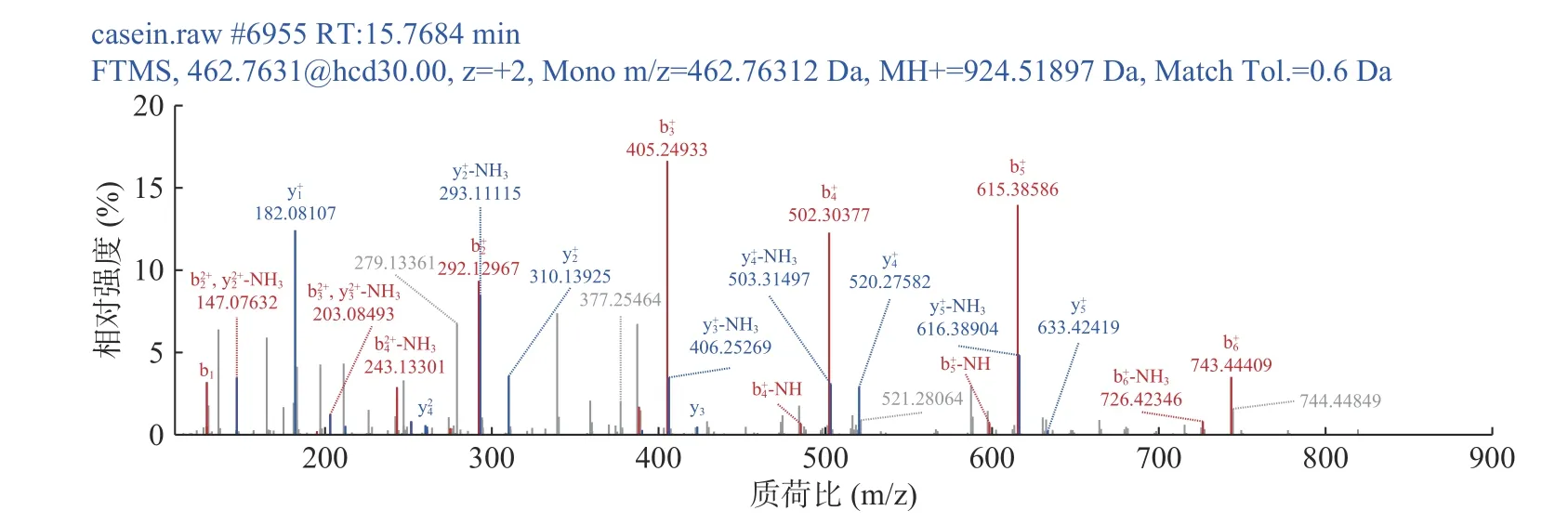
图3 KYIPIQY的二级质谱图Fig.3 Secondary mass spectra of KYIPIQY
2.4 ACE抑制肽活性的IC50值测定
采用高效液相色谱法测定了7-KYIPIQY的ACEI活性和IC50值。不同浓度肽的ACEI活性如图4所示。IC50值由回归方程确定:Y =(-0.08811)X2+4.04501X+29.69037(R2=0.999)。结 果 表 明,KYIPIQY是一种新颖高效的ACE抑制肽,其IC50值为5.73 μmol/L,活性明显高于从酪蛋白中鉴 定 的ACEI肽LLYQEPVLGPVR(IC50=274.0±5.0 μmol/L)[25]和MVPYPQR(IC50=30 μmol/L)[26]。
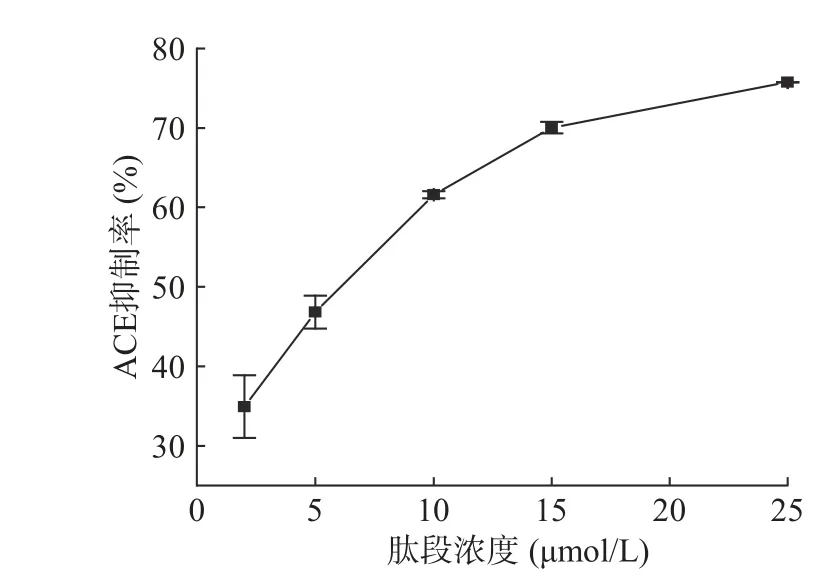
图4 KYIPIQY的ACE抑制活性Fig.4 ACE inhibitory activity of KYIPIQY
2.5 肽段KYIPIQY的抑制类型
通过Linewaver-Burk图分析7肽KYIPIQY对血管紧张素转换酶的抑制模式。如表2所示,Vmax值随着肽浓度的增加而降低,说明ACEI肽可能阻断了底物与ACE活性位点的结合。随着ACEI浓度的增加,Km值升高,这表明更高浓度肽段有利于ACE催化反应。图5显示ACEI肽表现出混合类型的酶抑制模式,表明7-KYIPIQY可以与血管紧张素转换酶的活性和非活性位点的位置结合,降低了血管紧张素转换酶的催化活性,达到降血压的作用。类似的,从南瓜子中分离鉴定的肽段RFPLL也为混合抑制模式[27]。

图5 KYIPIQY对ACE的Lineweaver-Burk图Fig.5 Lineweaver-Burk plot of ACE inhibition by the peptide LFRQFY

表2 KYIPIQY在不同浓度下的Vmax和KmTable 2 2Vmax and Km of KYIPIQY at different concentrations
2.6 KYIPIQY与ACE的分子对接分析
分子对接是通过计算相互作用能和分子间作用力来预测配体与受体活性位点的低能结合模式的有效方法[28]。为了进一步解释KYIPIQY的ACEI机制,通过DiscoveryStudio2019 软件对抑制肽和ACE进行了分子对接,形成的ACE-KYIPIQY复合体的三维结构、局部图、2D图如图6所示。分子对接结果中-CDOCKER_Energy表示肽和ACE之间紧密结合强度,表3所示,KYIPIQY的-CDOCKER_Energy大于KYIPIQ和YIPIQ,显示出更高的亲和力,这表明KYIPIQY可能比其他两肽发挥更高的ACE抑制作用,它们的ACE抑制的IC50值证明了推测。ACE的三个主要的活性位点口袋,分别是S1(Ala354、Glu384和Tyr523残基)、S2 (Gln281、His353、Lys511、His513和Tyr520残基)和S1’(Glu162)[29]。此外,Zn2+也是ACE活性位点,与ACE残基His383、His387和Glu411形成四面配位体,在ACE和抑制剂之间的结合亲和力中起重要作用[30]。在表4中,KYIPIQY与ACE残基共形成10个氢键,10个疏水作用力和两个静电力,研究表明氢键是维持 ACE 与抑制肽结合的主要作用力,疏水作用力和静电力也有助于ACE-结合肽的稳定[31],KYIPIQY与ACE的S1和S2活性口袋中的Ala354和His353形成2个氢键和3个疏水作用力,表明KYIPIQY能与 S1和S2口袋形成紧密的结合,与 ACE 残基His383、His387 和 Glu411之间形成3个氢键和一个疏水作用力可能会导致四面体配位的 Zn2+的扭曲,造成 ACE 催化活性的失活[32]而发挥高效的ACE抑制活性。
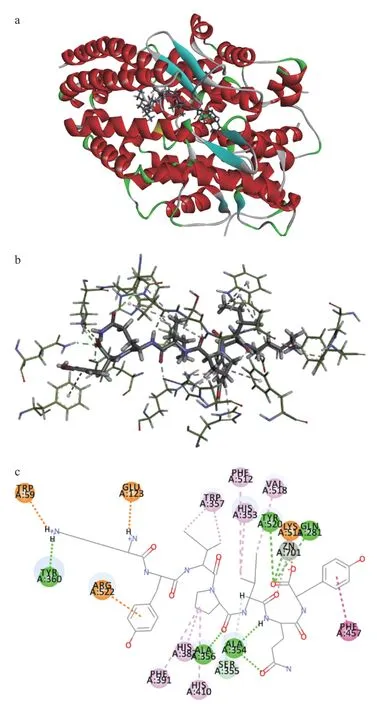
图6 KYIPIQY与ACE的分子对接结果Fig.6 Molecular docking results of KYIPIQY and ACE

表3 KYIPIQY、KYIPIQ和YIPIQY与ACE分子对接评分Table 3 “-CDOCKER ENERGY” of KYIPIQY、KYIPIQ and YIPIQ

表4 ACE-KYIPIQY复合物在最佳构象中观察到的氢键以及静电和疏水相互作用Table 4 Hydrogen bonds and electrostatic and hydrophobic interactions observed in the best peptide poses based on the ACE-KYIPIQY complex
3 结论
试验通过碱性蛋白酶水解绵羊乳酪蛋白得到的水解液的ACE抑制率为94.3%±0.86%,在体外展现出极高的ACE抑制活性。然后通过LTQ Orbitrap Velos质谱仪从酪蛋白水解液中鉴定出一种新的ACEI肽,KYIPIQY(源自κ-酪蛋白)显示出强有力的ACEI活性,IC50值为5.73 μmol/L,并对ACE具有混合型抑制作用。此外,分子对接模拟表明KYIPIQY与ACE的S1、S2的活性口袋氨基酸残基形成强结合力,并与Zn2+的四面配位体ACE残基形成3个氢键导致四面体配位的 Zn2+的扭曲,进而造成 ACE 催化活性的失活,而展现出显著的体外降血压活性。本研究表明绵羊乳酪蛋白是制备食源性降血压肽的极佳原料,可为绵羊乳新型功能食品的开发和抗高血压保健品提供理论依据和指导。
