沙利度胺对人宫颈癌Hela细胞周期的影响探讨
2022-01-19刘恒
刘 恒
(沈阳市第九人民医院,辽宁 沈阳 110020)
宫颈癌是现代女性群体发生率较高的一种恶性肿瘤,人乳头状瘤(HPV)感染是诱发宫颈癌的主要原因,宫颈癌具有恶性程度高、临床预后差等特征[1-3]。Hela细胞是由人宫颈癌组织分离出的细胞株,Hela细胞增殖、凋亡与肿瘤预后密切相关,且已有研究表明[4],宫颈癌的高侵袭性和Hela细胞高度表达有关侵袭因子存在相关性。THD是一种非巴比妥类药物,其作用机制是抑制血管生成及抗凋亡、抑制单核细胞产生TNF-α等,当下本品药物在黑色素瘤、结肠癌等领域中均有应用,在抗肿瘤生成过程中发挥良好效能[5]。本次研究使用不同程度的THD对人宫颈癌进行干预,探究其对Hela细胞周期形成的影响,具体如下。
1 材料与方法
1.1 使用的材料 本试验内人宫颈癌细胞株Hela细胞均从中国科学院细胞库提取,选择Gibco公司生产的RPMI-1640培养基,THD由Selleck公司购进,CCK-8试剂的提供单位是Sigma公司,p53与p-p53由Cell Signaling Technology公司提供,试剂盒购自杭州联科生物公司[6]。
1.2 方法
1.2.1 细胞培养 将Hela细胞置入RPMI-1640培养液内(含有10%胎牛血清、1%青链霉素),在恒定(37 ℃,5% CO2)培养箱内培养。提取双数生长期Hela细胞,经胰酶消化处理后放到含有血清培养基上终止消化进程。然后进行离心处理(3500 r/min的速率离心5 min),去除上清液,加入适量新鲜培养液重悬细胞沉淀以进行传代培养[7]。
1.2.2 试验分组 采用DMSO将深度为20 mg/mL的沙利度胺溶液进行溶解。使用培养基将THD分别稀释到50 μg/mL、100 μg/mL与200 μg/mL,处理Hela细胞时分为空白组(0 μg/mL THD)、低浓度组(50 μg/mL THD)、中浓度组(100 μg/mL THD)、高浓度组(200 μg/mL THD)。
1.2.3 细胞活力 采用CCK-8法检测,具体是把双数生长期的Hela细胞匀称的接种至96孔板中,将细胞密度设为5×105/孔,同时创设6个重复孔。继而把细胞放置在37 ℃,5%CO2培养箱内培养。待观察到细胞贴壁以后,使用不同浓度THD持续处理Hela细胞24 h,继而将5 μL CCK-试剂置入每个空洞中,置入培养箱内继续培养,当波长达到450 nm时应用酶标仪检测细胞吸光度值。实施MTT试验:每孔加入20 μL MTT溶液(5 mg/mL,即0.5% MTT),继续培养4 h后终止培养,吸去孔内培养液,在酶联免疫检测仪OD 490 nm处测量各孔的吸光值,每组重复4次,求其平均值,对两组测定值。
1.2.4 细胞周期分布 采用流式细胞术检测,具体操作过程中把双数生长期的Hela细胞匀称接种至6孔板内,设定细胞对应的密度为3×105/孔。待观察到细胞贴壁后,把THD加入至Hela细胞内。历经24 h后,采集2×105~1×106个细胞,采用1 000×g离心处理5 min。去除上清液后将预冷的无水乙醇(约3 mL)缓缓加入,混匀。离心去除乙醇后加入PBS溶液(2 mL),在室温条件静置15 min使细胞水化,经离心后除去上清液,加入的DNA staining solution 1 mL后再充分混匀,避光孵育30 min后,采用流式细胞仪进行检测[8]。
1.2.5 蛋白表达水平的检测 采用Western blot法检测蛋白表达水平,操作方法为:先在6 cm培养皿内把双数生长期的细胞均匀的进行接种,设细胞接种对应的密度为1×106。待观察到细胞贴壁后,加入适量THD溶液作用24 h。继而采用细胞裂解液提取细胞蛋白,利用BCA蛋白定量试剂盒测算每组蛋白对应的浓度。待胶和浓缩胶配制结束后对其行分离措施,进行凝胶电泳,继而利用湿转法转膜(250 mA,120 min)。采用含5%脱脂牛奶封闭PVDF膜。封闭完成,在恒温条4 ℃摇床上用抗稀释液(p-p53/p53)处理,1∶1 000过夜孵育PVDF膜,用TBST连续对PVDF膜进行3次洗涤,每次持续10 min,最后采用成像仪对PVDF膜进行显影,并分析灰度值[9]。
1.3 统计学方法 本组试验内所有信息资料均使用SPSS26.0软件对数据进行处理,用(%)表示计数等资料,χ2或Fisher确切概率法计算。检验水准为α=0.05,以()表示细胞增殖程度等计量资料,t检验;当P<0.05,表示数据内差异有统计学意义。
2 结果
2.1 THD对人宫颈癌Hela细胞增殖形成抑制作用 CCK-8检测结果表明,采用50 μg/mL、100 μg/mL与200 μg/mL的THD处理人宫颈癌Hela细胞24 h,能够剂量依赖性的降低Hela细胞活力(P<0.05),这提示THD对人宫颈癌Hela细胞增殖过程有明显的抑制作用。见图1。
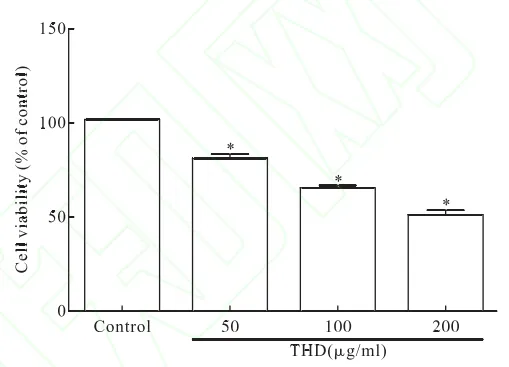
图1 不同浓度THD对Hela细胞活力形成的影响
2.2 MTT法测定小鼠胚胎成骨细胞增殖程度结果比较 MTT法测定人宫颈癌Hela细胞增殖程度显示,490 nm处空白组(0 μg/mL THD)吸光值为(0.679±0.098),低浓度组(50 μg/mL THD)吸光值为(0.575±0.089)、中浓度组(100 μg/mL THD)吸光值为(0.418±0.242)、高浓度组(200μg/mL THD)吸光值为(0.242±0.089)。低浓度组、中浓度组、高浓度组人宫颈癌Hela细胞增殖程度均显著高于空白组,差异有统计学意义(t=4.426,P<0.05;t=5.891,P<0.05;t=6.023,P<0.05)。中浓度组、高浓度组人宫颈癌Hela细胞增殖程度均显著高于低浓度组,差异有统计学意义(t=3.456,P<0.05;t=4.091,P<0.05)。高浓度组人宫颈癌Hela细胞增殖程度均显著高于中浓度组,差异有统计学意义(t=3.456,P<0.05)。见表1。
表1 MTT法测定人宫颈癌Hela细胞增殖程度()
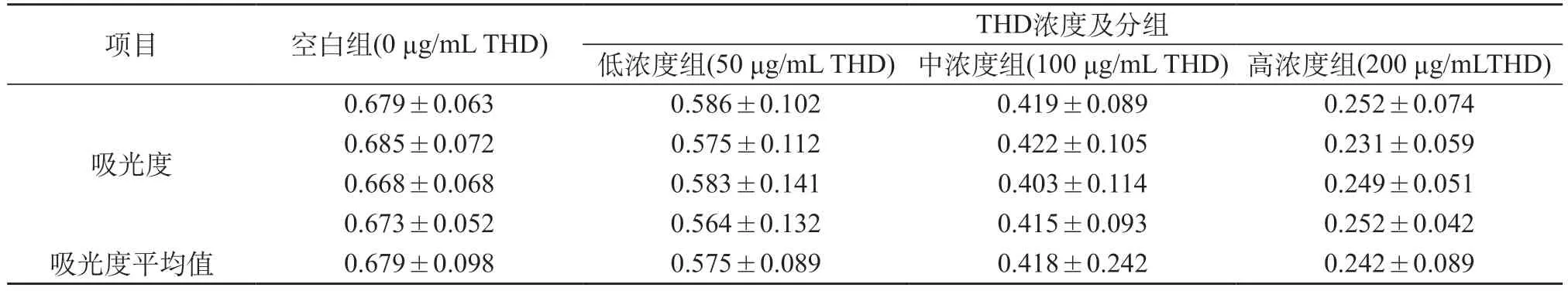
表1 MTT法测定人宫颈癌Hela细胞增殖程度()
2.3 THD能抑制人宫颈癌Hela细胞周期G1/S转换 在肿瘤发生发展过程中,细胞周期异常扮演着重要角色。在本次研究中,流式细胞术检测结果表明,50 μg/mL THD、100 μg/mL THD和200 μg/mL THD均有抑制细胞作用,抑制增殖程度与THD呈正相关,(P<0.05),且S期细胞显著减少(P<0.05)。这表明THD对Hela细胞细胞周期G1/S转换过程能形成较明显的阻滞作用,见图2。
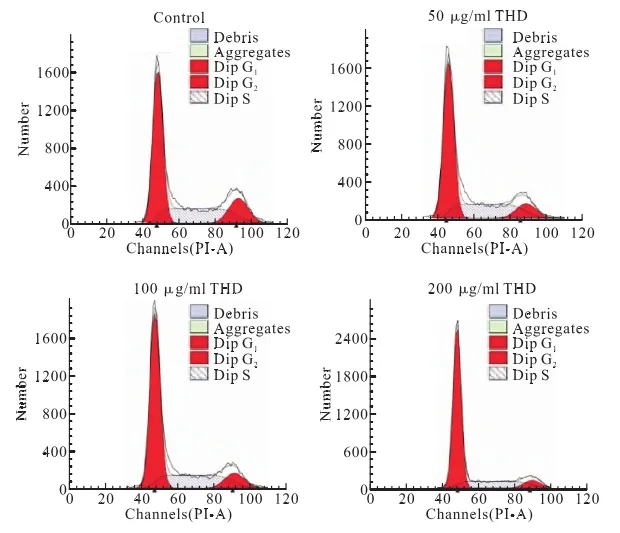
图2 不同浓度THD对Hela细胞周期分布形成的影响
2.4 THD对Hela细胞其中p53蛋白的活化具有抑制作用 p53为一种抑制肿瘤的蛋白,能诱导细胞周期阻滞。我们在长期的试验研究中认为,THD对人宫颈癌Hela细胞周期的抑制作用可能和其对p53活化能形成较明显的调控作用相关。结果提示,采用50 μg/mL、100 μg/mL与200 μg/mL的THD连续处理Hela细胞24 h后,p-p53/p53比值明显上升(P<0.05),这提示THD可能是通过促进p53活化过程,实现抑制人宫颈癌细胞周期。
3 讨论
宫颈癌是妇科中发病率较高的一种恶性肿瘤,发病率、病死率较高是本病的主要特征,且最近几年中,本病患病群体有年轻化趋势,对广大女性的健康与生命安全构成严重威胁[10]。宫颈癌的发生发展和HPV感染、血管增生、MMP有关通路激活均存在明显的相关性。最近几年中,国内外许多试验研究表明[11-12],对于宫颈癌患者均伴有HPV感染,HPV感染以其转录产物为媒介,介导VEGF、EGFR等的表达。有学者研究表明,肿瘤的MMPs信号通路活化水平与宫颈癌患者预后有关。
从宫颈癌组织内分离出一种细胞株就是Hela细胞,Hela细胞的行为状态能体现出宫颈癌恶化程度,而恶性肿瘤的生物学行为以细胞无限制性增殖与浸润为主[13]。Hela细胞增殖、浸润及凋亡行为,均有益于拓展临床医师对生物学行为理解的深度性。THD作用较为广泛,其最早被应用在骨髓瘤治疗领域中。既往有学者指出[14-16],THD抗肿瘤的抑制机制可能是抑制肿瘤血管形成和产生免疫抑制,其还可以用于其他癌症的领域当中,如肝癌、结肠癌等。还有研究表明,THD对G1期阻滞过程能形成明显的抑制作用,阻断DNA合成并抑制肿瘤细胞增殖过程。以上均提示THD的抗肿瘤作用可能和其抑制肿瘤细胞增殖过程存在相关。在本次研究中,50 μg/mL THD、100 μg/mL THD和200 μg/mL THD进行24 h持续处理,对Hela细胞活力能产生明显降低(P<0.05),说明THD能抑制Hela细胞增殖过程。采用MTT法测定人宫颈癌Hela细胞增殖程度变化也显示,THD可有效降低人宫颈癌Hela细胞增殖程度,490 nm处空白组(0 μg/mL THD)吸光值为(0.679±0.098),而低浓度组(50 μg/mL THD)吸光值为(0.575±0.089)、中浓度组(100 μg/mL THD)吸光值为(0.418±0.242)、高浓度组(200μg/mLTHD)吸光值为(0.242±0.089);低浓度组、中浓度组、高浓度组人宫颈癌Hela细胞增殖程度均显著高于空白组(P<0.05),且中浓度组、高浓度组人宫颈癌Hela细胞增殖程度均显著高于低浓度组(P<0.05),而高浓度组人宫颈癌Hela细胞增殖程度均显著高于中浓度组(P<0.05),可知低、中、高浓度THD均可抑制人宫颈癌Hela细胞增殖程度,随THD浓度升高,人宫颈癌Hela细胞增殖程度逐渐降低,高浓度THD抑制增殖效果更佳,提示THD抑制增殖效果呈剂量依赖性,50 μg/mL THD、100 μg/mL THD和200 μg/mL THD均有抑制作用,可为宫颈癌的临床治疗提供一定参考依据。
细胞周期异常和肿瘤发生发展过程中存在密切相关,现代医学研究中最新突破表明:靶向细胞信号传输渠道为载体调节细胞周期。在生物学中,可以将细胞周期细化为5个阶段[17]:G0(静息期)、G1(DNA合成前期)、S(DNA合成期)、G2(DNA合成后期)与M(有丝分裂期),其中G1/S与G2/M是监测细胞组分完整性与DNA合成真实度的重要检查位点。在本次研究结果提示,采用50 μg/mL、100 μg/mL与200 μg/mL的THD连续处理Hela细胞24 h后,p-p53/p53比值明显上升(P<0.05),这提示THD可能是通过促进p53活化过程,实现抑制人宫颈癌细胞周期;50 μg/mL、100 μg/mL与200 μg/mL THD持续处理Hela细胞24 h后,Hela细胞G0/G1期细胞数目增加显著,S期细胞显著减少(P<0.05)。这表明THD可以抑制Hela细胞细胞周期G1朝向S转换过程,提示THD对人宫颈癌Hela细胞周期的抑制作用可能和其对p53活化能形成较明显的调控作用相关。
p53可以被视为基因组的“监护人”,在多种刺激因素作用下能调控细胞增殖过程,如DNA损伤与超声致癌信号均能激活p53肿瘤抑制渠道,从而调控上百个基因的转录反应[18-20]。因为p53蛋白活化在细胞周期中发挥重要调控作用,故而本次研究中分析了THD对Hela细胞p53活化形成的影响。结果表明,THD能明显提升p53表达水平,实现对宫颈癌细胞周期的间接性抑制。
综上所述,可见THD通过提升p53蛋白活性去实现对人宫颈癌Hela细胞周期的有效抑制,50 μg/mL THD、100 μg/mL THD和200 μg/mL THD均有抑制细胞作用,抑制增殖程度与THD呈正相关性,药理作用确切,这能为宫颈癌临床治疗提供较可靠的试验依据,促进患者病情恢复进程。
