关于叶绿素中配位键的教学思考
2022-01-19湖北邢泰宇许剑平
湖北 邢泰宇 许剑平
2009年版人教版化学选修3第43页将卟啉配合物叶绿素的结构表示为图1。图中上、下方的N原子与Mg原子以虚线相连,左、右方的N原子与Mg原子以实线相连。课本编写者想表示这4个N原子原子与Mg原子原子间的成键情况不尽相同,用虚线和实线以示区别。那虚线和实线到底哪个表示配位键,亦或是表示一般共价键?

图1 叶绿素结构1
一、叶绿素中镁、氮原子的成键情况分析
1.虚线和实线表示配位键和一般共价键
该问题在中学化学界的争论由来已久,2005年有文献中阐述 ,虚线和实线分别表示两个配位键、两个共价键。有的老师认为,从中心离子Mg2+来看,一是镁的电负性为1.2,金属性较强,氮的电负性为3.0,非金属性较强,二者电负性差异较大,一般不易通过共用电子对形成共价键;二则Mg2+带有2个单位正电荷,电荷较高,利于形成较高配位数的配位单元,故此虚线和实线都表示配位键。还有的老师从氮原子成键情况分析:以虚线与Mg原子相连的N原子已经与C原子形成三个共价键,N原子上的三个成单电子均配对,形成八电子稳定结构,还有一对孤电子对可与Mg形成配位键;而以实线与Mg原子相连的N原子与C原子形成两个共价键,N原子上的三个单电子配对两个,还有一个单电子要与Mg原子配对,形成一般共价键。争论的焦点主要为N原子与Mg原子以实线相连的键是配位键还是一般共价键。
2.虚线和实线均表示配位键

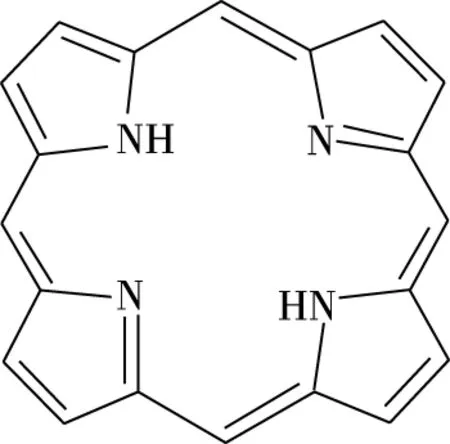
图2 卟吩结构
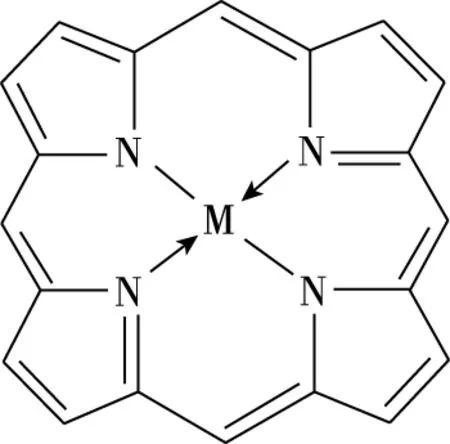
图3 金属卟啉骨架结构


图4 叶绿素结构2
故此,图1所示的2009年版人教版化学选修3第43页卟啉配合物叶绿素的结构中,N原子与Mg原子以虚线相连表示配位键,N原子与Mg原子以实线相连也表示配位键,该配位键同时也满足电价,整个分子构成中性分子内配盐。课本编写者的意思应该是两者成键情况不尽相同,用虚线和实线以示区别,与图4中用箭头和没有箭头的短实线表示并没有本质区别。当然,图4中N原子与Mg原子之间成键情况表达得更加规范和普遍。
2019年版化学选择性必修2物质结构与性质,已将叶绿素的结构示意图换成了图5,教材的编写者可能是基于上述原因,为避免虚线和实线带来的争论,N原子与Mg原子间统一用实线相连,既兼顾了学生的认知水平,又与大学化学主流教材表达保持基本一致,更利于学生后续的学习和深造。
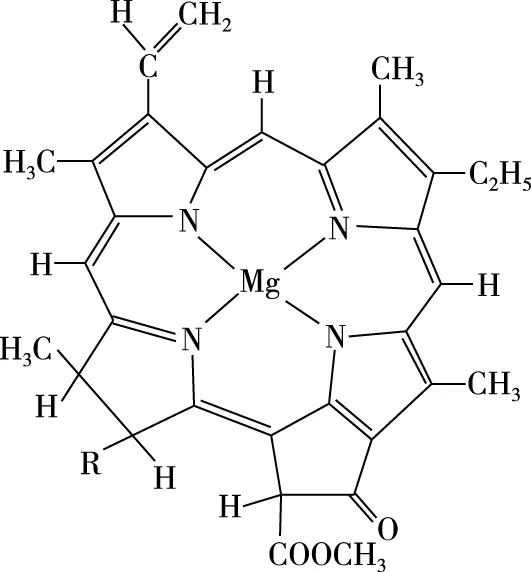
图5 叶绿素结构3
二、教学思考与启示
1.重视配合物、配位键教学
自1798年法国化学家塔萨厄尔合成第一个配合物以来,目前已合成成千上万种配合物,配合物在化工生产、生物、医药等领域发挥着日益重要的作用。因此,让学生了解配合物的相关知识能让学生深刻认识到化学对创造物质财富、满足人民日益增长的美好生活需求做出的重大贡献。《普通高中化学课程标准(2017年版2020年修订)》(以下简称《课程标准》)中关于配合物、配位键的要求如表1。

表1 《课程标准》关于配合物、配位键的要求
与《普通高中化学课程标准(实验)》相比,《课程标准》适度强化了配合物的概念,还增设了学生必做实验“简单配合物的制备”。基于《课程标准》命题的高考试题中关于配位键的考查如表2所示。

表2 2019年—2021年高考卷中关于配位键的考查
由表1、2的内容可见,配位键与离子键、共价键、金属键等都是化学键的典型模型,是从微观上认识构成物质的微粒间相互作用的典型视角,高考试题中关于配合物、配位键的考查形式主要是:配位键名称、配位(键)数、配位原子、配合物的稳定性等。因此,教学中适当重视配合物、配位键的教学是很有必要的。
2.多角度认识配位键
在教学中教师应该教会学生从多角度认识配位键,指导学生分析配位键时,可分析中心离(原)子的电负性、电荷及半径,配原子的电负性及成键情况,还应分析配体的结构,如带电情况、空间结构等等。
例如(2021·湖北模拟·12节选)在碱性溶液中,Cu2+可以与缩二脲形成紫色配离子,其结构如图6所示。下列说法错误的是

图6 Cu2+的配离子
( )
B.该配离子中铜离子的配位数是4

3.审慎命制含配位键的试题

