善用守恒思想 巧写“信息型”氧化还原方程式
——以2020—2021年高考真题为例
2022-01-19云南严仕军
云南 严仕军
一、“信息型”氧化还原反应方程式的书写方法综述
第一步:根据题目信息,如文字描述、工艺流程图、装置图等,找出部分反应物和部分生成物,主要是元素化合价发生变化的物质或离子,化合价未发生变化的物质或离子可暂时不写出;
第二步:根据物质元素化合价的升降判断电子得失,先利用氧化还原反应中“电子得失守恒”配平上述物质或离子的系数;
第三步:根据反应体系的酸碱性,再利用“电荷守恒”进行配平,配平时适当补充H+、OH-和H2O等物质;
第四步:最后利用“质量守恒”配平化学方程式。
二、“信息型”氧化还原反应方程式书写方法的应用
【例1】(2020·全国卷Ⅲ·27节选)某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如图1所示工艺流程回收其中的镍制备硫酸镍晶体(NiSO4·7H2O):
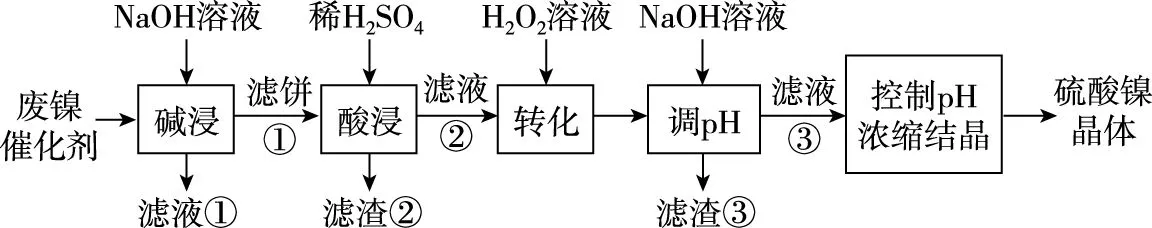
图1
回答下列问题:
(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式:____________________。

【解析】第一步:根据流程图和题干信息及所学知识,书写“主干物质”,即找出化合价发生变化的物质或离子确定参与反应物质或离子的化学式:

第二步:标出化合价发生变化的元素的化合价,利用氧化还原反应中电子得失守恒(双线桥法)配平主要的反应物和生成物。
Ni元素:由反应前的+2价升高至反应后的+3价,1个Ni原子共失去1个电子;
Cl元素:由反应前的+1价降低至反应后的-1价,1个Cl原子得到2个电子。根据氧化还原反应中得失电子守恒可知:1与2的最小公倍数为2,因此Ni2+和NiOOH的系数为2,ClO-和Cl-的系数为1,即可得到:

第三步:利用电荷守恒配平左右两边的电荷。


第四步:利用质量守恒补充完整方程式。


【例2】(2020·全国卷Ⅰ·26节选)钒具有广泛用途。黏土钒矿中,钒以+3、+4、+5价的化合物存在,还包括钾、镁的铝硅酸盐,以及SiO2、Fe3O4。采用以图2所示艺流程可由黏土钒矿制备NH4VO3。
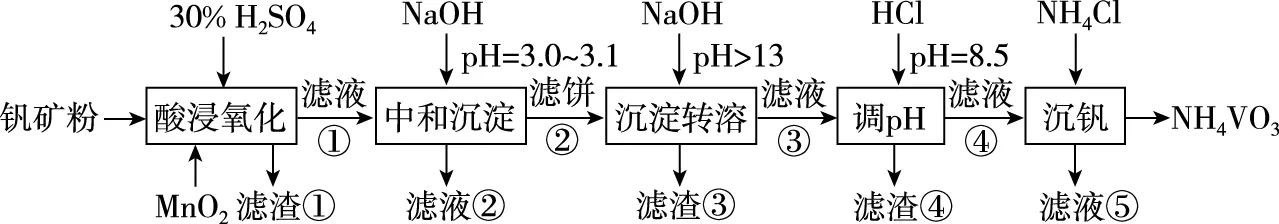
图2
请回答下列问题:



第一步:结合氧化还原反应知识和反应体系呈酸性,MnO2被还原为Mn2+,即可得到:
第二步:利用“电子得失守恒”配平主要的反应物及生成物:
第三步:利用“电荷守恒”配平:
第四步:利用“质量守恒”配平:
【例3】(2020·全国卷Ⅱ·26节选)化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(3)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为____________________。


(4)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的 “二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1 mol ClO2消耗NaClO2的量为________mol。
【答案】1.25

【例4】(2021·全国甲卷·26节选)碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。回答下列问题:
(1)I2的一种制备方法如图3所示:

图3
①加入Fe粉进行转化反应的离子方程式为____________________;生成的沉淀与硝酸反应,生成________后可循环使用。

(2)以NaIO3为原料制备I2的方法是:先向NaIO3溶液中加入计量的NaHSO3,生成碘化物;再向混合溶液中加入NaIO3溶液,反应得到I2,上述制备I2的总反应的离子方程式为____________________。
(3)KI溶液和CuSO4溶液混合可生成CuI沉淀和I2,若生成1 mol I2,消耗的KI至少________mol。


(3)4


(2)根据题意可将制备方法简化为图4流程:

图4
充分利用守恒思想,可得出:
将反应Ⅰ×5和反应Ⅱ的离子方程式相加再÷3,即可得制备I2的总反应的离子方程式:

三、方法迁移——将守恒思想用于电化学电极反应式的书写
【例5】(2020·全国卷Ⅱ·28改编)(3)CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图5所示:
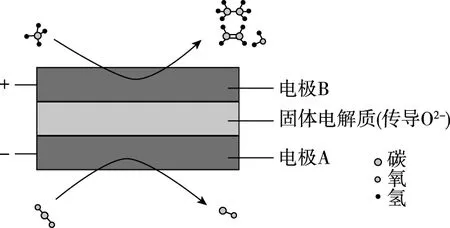
图5
(1)若生成的乙烯和乙烷的体积比为2∶1,则阳极上的电极反应式为____________________。

【解析】结合装置图和电化学基础知识,阳极为化合价升高、失电子的一极,守恒思想应用分析如下:
第一步:结合装置图和已知条件即可得到:

第二步:利用“电子得失守恒”配平主要反应物及生成物:
CH4中C元素为-4价,C2H4中C元素为-2价,C2H6中C元素为-3价,结合系数分析可知,共失去10个电子,即得:

第三步:利用“电荷守恒”,补充O2-配平电荷可得:

第四步:利用“质量守恒”配平得出答案:


