Hsf1通过HSP70-TLR4-MyD88信号通路调控肾脏AA淀粉变
2022-01-19夏顺杰李钊希王琨璐张彩妮董爱彤王宇彬钱金泽
夏顺杰,李钊希,王琨璐,张彩妮,董爱彤,王宇彬,刘 巍,钱金泽
淀粉样变是一组由遗传变性和感染等不同因素引起的,因蛋白质分子错误折叠/异常聚集所致的淀粉样物质沉积的综合征[1]。AA淀粉样变的形成主要与长期炎症刺激所致的持续性高浓度的淀粉样前体蛋白,即血清淀粉样蛋白A(serum amyloid A, SAA)有关。大量的SAA可以通过酶解作用分解,或以错误折叠的方式形成具有β折叠(β-pleated sheets)的淀粉样纤维。临床上AA淀粉样变的肾脏累及率高达75%~90%,预后较差,患者多死于肾功能衰竭,其发病及防治机制尚未完全清楚。
具有分子伴侣功能的热休克蛋白(heat shock proteins, HSPs)通过诱发热休克反应激活热休克转录因子1(heat shock factor 1, Hsf1),参与蛋白质的正确折叠、聚合、转运和信号传递等生理过程[2]。在急性肾损伤模型中,肾脏上皮细胞的Toll-like受体(toll-like receptor, TLR),特别是TLR2和TLR4表达量明显增加,而这两种受体的激活是依赖于HSP70来完成的,并且在整个免疫过程中对细胞因子的介导和吞噬细胞的活化也发挥了关键作用[3]。TLR4是一种模式识别受体,与相应的配体结合后,TLR4被活化。其活化后可诱导多种促炎细胞因子的产生和释放,发挥抗炎、自身免疫等效应。
前期的基因芯片筛选结果显示,HSP70诱导促炎因子的产生与TLR4信号通路有关,而目前对于该通路在AA淀粉样变中的作用机制尚未见详细报道。本实验采用Hsf1基因敲除小鼠构建肾脏AA淀粉样变模型,探讨HSP70-TLR4-MyD88通路相关因子在肾脏AA淀粉样变中的作用机制以及Hsf1基因对其通路的调节,有助于该病在临床上的预防与治疗策略的合理选择。
1 材料与方法
1.1 实验动物分组本实验选用ICR背景的Hsf1基因敲除鼠,由日本山口大学大学院医学系研究科医化学系中井彰教授赠予。所用小鼠均为2个月龄雄鼠,实验分5组:Hsf1+/+生理盐水组、Hsf1+/+淀粉样变诱导组、Hsf1-/-生理盐水组、Hsf1-/-淀粉样变诱导组、Hsf1-/-淀粉样变诱导同时给予替普瑞酮(GGA)治疗组(Hsf1-/-淀粉样变诱导+GCA组),每组各6只。
1.2 模型制备根据Pras法,从AA淀粉样变诱导的野生型小鼠肾脏组织中提取出AA淀粉样纤维种子,各淀粉样变诱导组采用尾静脉注射AA淀粉样纤维(1 μg/100 μL),并给予皮下注射0.5 mL 1%AgNO3的方法制备AA淀粉样变模型,然后每隔1天皮下注射0.5 mL 1%AgNO3持续诱导炎症刺激。此外,GGA治疗组每日灌胃(500 mg/kg GGA,GGA溶于4.0 mL 0.9%NaCl溶液中使用[4-5])。诱导实验进行1周后完成造模。实验中每天同一时间点对各组小鼠进行尾静脉取血,并低速离心收集血清以测量SAA。
1.3 组织取材淀粉样变诱导1周后进行取材,再使用乙醚麻醉后处死小鼠,取小鼠肾脏部分置入液氮,部分置于10%中性福尔马林与4%多聚甲醛配置成的固定液中,室温固定进行形态学实验。其余部分直接冷冻于-80 ℃进行分子生物学实验。
1.4 分子生物学实验(1)应用RT-PCR法检测各组中HSP70、TLR4、MyD88、Tnf-α及IL-6 mRNA检测:从肾脏组织提取RNA合成cDNA,使用Taq DNA Polymerase进行扩增。采用SYBR Premix Ex Taq Ⅱ进行实时定量检测,操作系统选择Mx 3005 RT-PCR SYSTEM。(2)应用Western blot法检测各组小鼠肾脏中HSP70以及血清中SAA蛋白表达:使用SDS-PAGE电泳分离,转膜后检测蛋白表达,所用抗体HSP70和小鼠淀粉样蛋白A(mouse amyloid A, mAA)稀释比均为1 ∶3 000。
1.5 HE及免疫组化用10%中性福尔马林固定取材的肾脏组织,再将其进行包埋封蜡至成型,对肾脏组织进行石蜡切片,4 ℃保存。对切片进行刚果红染色,偏光镜下观察染色情况,确定淀粉样物质的沉积程度;同时对相同部位连续切片进行免疫组化SP法染色,mAA抗体稀释比为1 ∶3 000,在显微镜下观察切片并判断mAA沉积情况。
1.6 统计学分析所有数据使用Stat View software package(Abacus Concepts, Berkeley, CA, USA)进行统计学分析,并应用Mann-WhitneyU进行数据的组间比较,以P<0.05为差异具有统计学意义。
2 结果
2.1 AA淀粉样变中Hsf1对HSP70与TLR4的影响RT-PCR检测各组肾脏中mRNA的结果显示:淀粉样变诱导试验后,Hsf1+/+小鼠肾脏HSP70 mRNA表达量显著升高,而Hsf1-/-小鼠肾脏组织HSP70 mRNA表达量无明显改变(图1A),提示Hsf1表达缺失不能有效激活HSP70。此外,Hsf1-/-淀粉样变诱导组小鼠肾脏组织中TLR4及其下游因子MyD88的mRNA表达量显著高于Hsf1+/+淀粉样变诱导组小鼠,并且前者的细胞因子Tnf-α和IL-6的mRNA表达量同样显著高于后者(图1B~E)。结果提示,Hsf1表达缺失对HSP70-TLR4通路有直接调控作用,并影响AA淀粉样变。
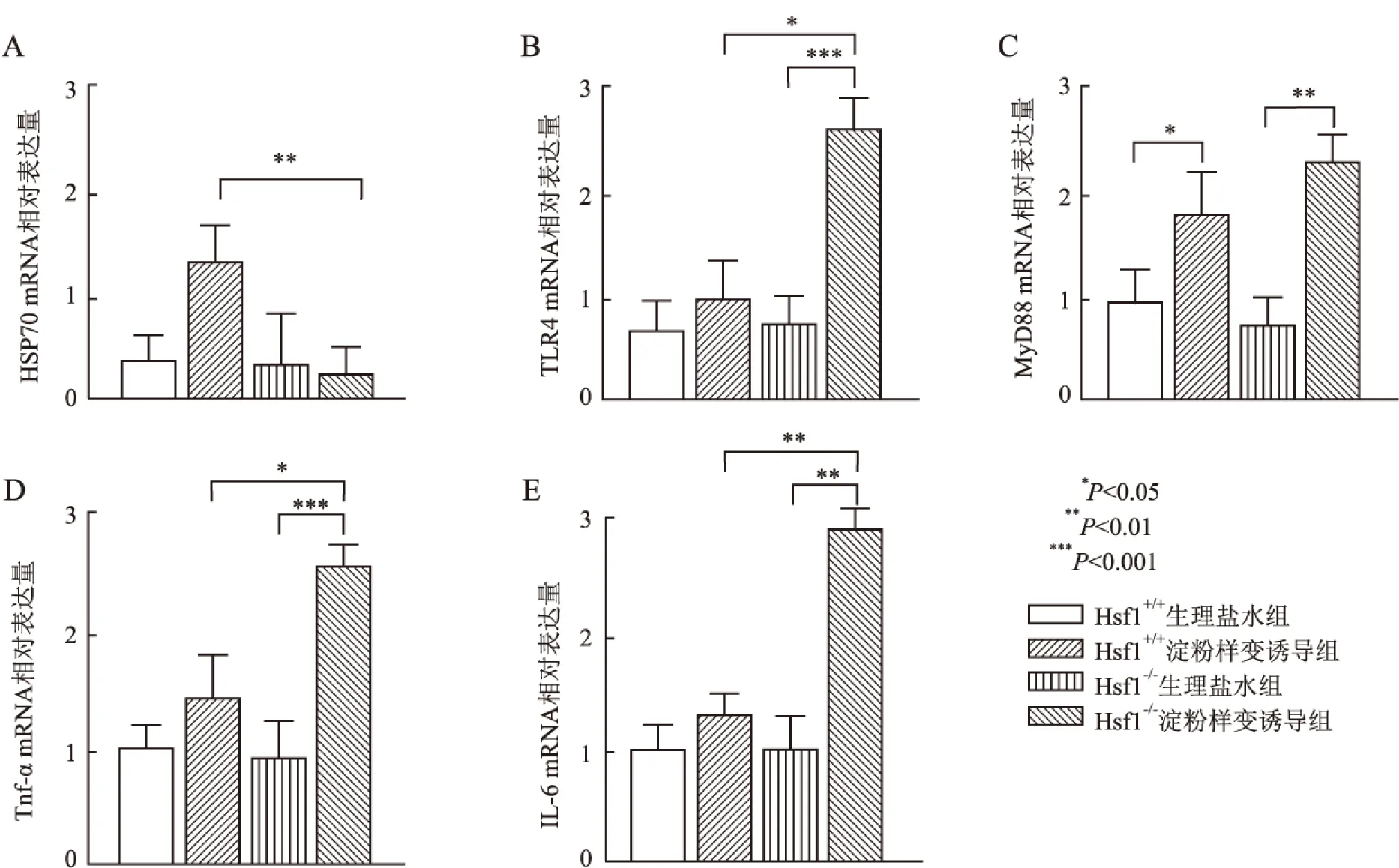
图1 各组小鼠肾脏组织中HSP70(A)、TLR4(B)、MyD88(C)、Tnf-α(D)和IL-6(E) mRNA的表达情况
2.2 Hsf1表达缺失对炎症刺激后SAA表达的影响通过Western blot法对各实验组小鼠血清中SAA蛋白的表达进行检测发现,未进行炎症刺激时,无论是Hsf1+/+型小鼠还是Hsf1-/-型小鼠,均未检测到血清中SAA表达;而进行炎症刺激后,Hsf1+/+型小鼠和Hsf1-/-型小鼠血清中SAA表达均急剧升高,Hsf1-/-型小鼠血清中SAA表达量显著高于Hsf1+/+型小鼠(P<0.05),且在炎症刺激后第一天达到峰值后迅速下降(图2)。由此可见,Hsf1的缺失显著增强了炎症刺激后SAA的表达,为AA淀粉样物质的形成提供了必要条件。

图2 各实验组小鼠每天同一时间点血清中SAA蛋白表达情况:Hsf1-/-淀粉样变诱导组与Hsf1+/+淀粉样变诱导组相比,*P<0.05
2.3 Hsf1敲除对AA淀粉样物质沉积程度的影响对各组小鼠肾脏切片进行刚果红染色结果显示:Hsf1-/-淀粉样变诱导组淀粉样物质沉积显著多于Hsf1+/+淀粉样变诱导组,且淀粉样物质沉积部位主要集中在集合管的间质组织中,再对相同部位连续切片进行mAA免疫组化染色,可见在荧光位置出现等量的淀粉样沉积,证明刚果红染色所见淀粉样物质即为AA淀粉样纤维(图3)。同时利用淀粉样蛋白沉积指数评估将淀粉样变沉积程度进行量化比较,结果提示:Hsf1的敲除显著增强了肾脏组织中AA淀粉样变的沉积程度(图4)。

ABCDEFGHHsf1+/+生理盐水组Hsf1+/+淀粉样变诱导组Hsf1-/-生理盐水组Hsf1-/-淀粉样变诱导组

图4 小鼠肾脏组织中淀粉样蛋白沉积指数评估:N.D.未检出
2.4 GGA通过TLR4通路有效改善了肾脏组织中AA淀粉样物质沉积Hsf1-/-淀粉样变诱导组同时给予GGA处理后,结果显示在Hsf1缺失情况下,GGA可有效的诱导肾脏组织中HSP70的mRNA和蛋白表达(图5A、B),同时削弱TLR4-MyD88的活化和促炎因子的表达(图5C~F);并且在一定程度上抑制了肾脏组织中淀粉样物质沉积(图6)。

图5 GGA处理后肾脏组织中各分子mRNA和蛋白表达情况:A、B.实验组小鼠肾脏组织中HSP70 mRNA(A)及蛋白(B)表达水平;C~F.分别为各实验组小鼠肾脏组织中TLR4(C)、Myd-88(D)及促炎因子Tnf-α(E)和IL-6(F)的mRNA表达水平

图6 GGA处理后肾脏组织中淀粉样变沉积程度评估:N.D.未检出
3 讨论
AA淀粉样变又称继发性系统性淀粉样变或反应性淀粉样变,是常见的系统性淀粉样变性之一,由SAA形成的淀粉样纤维(amyloid fibrils)沉积于机体组织器官内,从而引起的系统性淀粉样变。目前,已有30余种不同的蛋白质及其前体可以引起机体的淀粉样变疾病,如朊病毒疾病、阿尔茨海默病、Ⅱ型糖尿病、反应性淀粉样变性疾病(reactive amyloidosis)等。简言之,淀粉样变是一种淀粉样蛋白在组织或器官内沉积而引发的一组疾病,可累及全身各组织或器官,肾脏是淀粉样蛋白常累及的器官之一,是诱发肾脏纤维化和功能异常的主要因素之一[6]。根据流行病学调查结果显示,淀粉样变性每年发病率约为0.7/10万人,其中肾脏淀粉样变的年发病率高达(0.21~0.33)/10万人,占继发性肾脏疾病的3.6%,以中老年患者为主。目前普遍认为,血清中SAA的含量和炎症反应均与AA淀粉样变的形成密切相关,特别是IL-6抑制剂可使患者血清中SAA水平正常化,达到治疗AA淀粉样变的效果[7]。
未折叠蛋白质反应(unfolded protein response, UPR)以及热休克反应(heat shock response, HSR),这两种通路被认为与蛋白质折叠的动态平衡或蛋白质稳态有一定的相关性。HSR是当细胞或组织暴露在高温、毒物、自由基、感染、淀粉样纤维蛋白的异常沉积等应激原作用下,导致蛋白质构象改变、聚合等一系列防御适应性反应。Hsf1作为HSPs的主要转录因子,随着年龄的增长其表达逐渐下降。而各种具有分子伴侣功能的HSPs通过诱发HSR激活Hsf1而被诱发出来,作为分子伴侣参与蛋白质的正确折叠、聚合、转运等生理过程。大量体内、外实验发现,HSP70等HSPs的高表达不仅可以有效地抑制亨廷顿病和多聚谷氨酰胺病,还可以有效抑制由α-Synuclein引起的帕金森病[8-10]。在阿尔茨海默病的研究中发现,HSP70不仅可以抑制细胞内Aβ42的异常聚集,还与细胞外淀粉样物质的沉积密切相关[11]。此外,研究发现HSP无论在天然免疫还是获得性免疫反应中都发挥了至关重要的作用。其中,HSP70具有免疫保护功能,可与NF-κB、MMPs、ROS等促炎因子相互作用,发挥抗炎作用。在巨噬细胞中,HSP70的上调有效地阻止了脂多糖(lipopolysaccharide, LPS)所致的炎症细胞因子如Tnf-α、IL-1β、IL-6的表达增加;在脑出血模型中,HSP70的上调降低了Tnf-α的表达,减弱了血脑屏障的破坏、水肿的形成和神经功能障碍。TLR4作为一种模式识别受体,其不仅可通过识别LPS等病原相关分子模式(pathogene-associated molecular patterns, PAMP)而被活化,还可通过高迁移率族蛋白B1(high mobility group protein B1, HMGB1)、HSPs等损伤相关分子模式(damageassociated molecular patterns, DAMP)而被活化,从而诱导IL-1β、Tnf-α、IL-6等促炎细胞因子的产生和释放,发挥抗炎、自身免疫等效应。根据动物和临床研究发现,TLR4的下调显著削弱了1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetrahydrophridine, MPTP)诱导的帕金森小鼠脑部的神经炎症,减少促炎因子Tnf-α和IL-1β的表达[12]。通过药理学阻断TLR4受体信号转导,可以显著削弱阿尔茨海默病中神经元胞质中的Ca2+浓度,防止细胞凋亡[13]。此外,细胞外HSP70通过TLR4与巨噬细胞、小胶质细胞、树突状细胞相互作用参与先天免疫应答[14]。因此,HSP70不仅参与了肾脏正常生理活动,而且在急性肾损伤、肾缺血再灌注损伤、慢性肾损伤等过程中发挥重要的保护作用。
本实验通过采用Hsf1-/-型小鼠构建肾脏AA淀粉样变模型,证实Hsf1的缺失不能有效诱导肾脏HSP70的表达,加剧了TLR4相关的炎症反应,促进了促炎因子的释放;另一方面,Hsf1的缺失导致了急性炎症后血清中SAA高表达,从而为AA淀粉样变沉积程度的加剧增加了可能性。作为HSP70诱导剂使用的GGA,可以有效的增加肾脏HSP70的表达来削弱TLR4介导的促炎反应,达到了一定的治疗效果。
综上所述,本实验揭示了Hsf1通过HSP70-TLR4-MyD88信号通路调控肾脏AA淀粉变的机制,为探讨肾脏AA淀粉样变的形成机制提供了新的科学依据,并为临床预防和治疗提供了新思路。
