通过TCT检测恶性胸腔积液非小细胞肺癌血管拟态现象
2022-01-19丁春晓刘小虎杜明伟李建华方长清
丁春晓,王 健,刘小虎,杜明伟,李建华,方长清
全球肺癌的发病率和病死率增长较快,对人类的生命健康造成巨大威胁。近年,我国肺癌的发病率增长最快,位居男性恶性肿瘤的第1位,位居女性恶性肿瘤的第2位,而在美国等其他国家,肺癌甚至是因癌症致死的首要因素[1-4]。非小细胞肺癌(non-small cell lung cancer, NSCLC)约占肺肿瘤的85%,约56%患者在确诊时已发生转移[5-6]。在肿瘤的发生、发展、侵袭及转移过程中,新生血管的生成至关重要[7],其作用是为肿瘤组织提供营养物质及氧气。然而,在实际治疗过程中,抗肿瘤血管生成的临床疗效远达不上预期。这提示肿瘤血管生成可能不是肿瘤唯一的微循环机制,或许还存在血管拟态(vascufogenicmimicry, VM)现象。Maniotis等[8]于1999年首次在部分高度侵袭性葡萄膜黑色素瘤组织中证实VM现象的存在。目前关于NSCLC的转移性恶性胸腔积液(malignant pleural effusion, MPE)肿瘤细胞中存在血管新生和VM现象的文献,鲜有报道。因此,本文着重从细胞学角度出发,在NSCLC转移性MPE脱落细胞中,探讨VM现象。
1 材料与方法
1.1 材料收集中国医科大学附属第一医院病理科2018年1月~2020年12月接收的胸水标本1 425例,对液基细胞薄层检测(thinprep cytology test, TCT)诊断阳性及可疑阳性标本进行离心沉渣包埋,行HE及免疫组化染色以筛选NSCLC,并通过回顾性查找病史,汇总临床资料。
1.2 主要试剂TTF-1、SPA、SPB、CK7、CK5/6、CD105、CD34、CD31、FⅧRAg、D2-40、LYVE-1、CD31、VEGF、FGF和GAPDH等抗体以及免疫组化、免疫荧光检测所需试剂盒均购自福州迈新公司。
1.3 TCT检测收集新鲜胸水20 mL左右,室温下800 r/min离心5 min,弃上清,取沉淀于底部的细胞,加入清洗液后再次离心,取沉淀与保存液混合后机器自动制片,中性树胶封固。
1.4 胸水沉渣包埋[9]胸水标本室温下自然沉淀4 h,弃上清,取剩余自然沉淀液20 mL倒入离心管,室温下2 000 r/min离心10 min,再次弃上清,用剪刀剪断离心管最底部,其内即为沉淀物,一起放入包埋盒,经10%中性福尔马林固定、脱水、包埋。
结果判读:NSCLC患者胸腔积液中的脱落肿瘤细胞经沉渣包埋制片后,镜下观察细胞可呈管腔样排列,且形式多样,其中可见单个肿瘤细胞形成的脉管样管型结构,也可见多个肿瘤细胞围成的脉管样管型结构,有些管腔样结构可呈共壁联环型,有时可见多个肿瘤细胞共壁于基膜。通读HE染色,镜下观察VM现象,每张切片随机选取5个高倍视野(200×),计数具有以上任一形式的VM现象中具有完整管腔的数量,结果用中位数四分位间距表示。
1.5 免疫荧光切片脱蜡、抗原修复、血清封闭、滴加一抗孵育过液,PBS冲洗,滴加荧光素标记的二抗、避光室温孵育,PBS冲洗、封固,荧光显微镜下观察并拍照。
结果判读:对CD31、D2-40,CD105、LYVE-1,CD34、LYVE-1,FⅧRAg、D2-40进行荧光双染,阳性为胞质阳性。
1.6 免疫组化采用免疫组化SP法染色,PBS稀释一抗,生物素标记二抗,滴加链霉亲和素-过氧化物酶孵育,DAB显色,苏木精复染,常规脱水透明,中性树胶封固。
结果判读:由两名病理诊断医师独立检查5个代表性高倍视野(200×),识别阳性染色的肿瘤细胞,合计检测100个连续细胞,通过阳性染色细胞数/检测肿瘤细胞的总数计算阳性百分比:阳性细胞数<5%为阴性,≥5%为阳性。
1.7 统计学分析采用SPSS 17.0软件进行统计学分析,数据不符合正态分布采用秩和检验,结果用中位数和四分位数间距表示,P<0.05为差异有统计学意义。
2 结果
2.1 NSCLC患者的筛选在1 425例胸水标本中,对既往TCT诊断结果为恶性细胞、可疑恶性细胞或见核异质细胞等结果的标本,进行进一步沉渣包埋,HE染色结合免疫组化最终确定323例为NSCLC胸水标本。其中女性189例,中位年龄67岁;男性134例,中位年龄70岁。同时,通过HE和免疫组化染色对NSCLC进行组织学分型:其中肺腺癌(TTF-1、Napsin-A、CK7等阳性)174例,肺鳞状细胞癌(CK5/6、p40、p63、CK34βE12等阳性)108例,腺鳞癌24例,大细胞癌17例。
2.2 HE染色观察VM现象沉渣包埋HE染色切片显示肿瘤细胞呈脉管样管型结构排列(图1),VM形成数量:腺癌为10(10,20)个、鳞状细胞癌为12.5(10,20)个、腺鳞癌为12.5(5,17.5)个、大细胞癌为10(5,20)个,各组间差异无统计学意义(Z=0.102,P>0.05)。

图1 沉渣包埋切片肿瘤细胞呈脉管样管型结构排列
2.3 VM现象中脉管样管型结构NSCLC标志物的表达为进一步判断脉管样管型结构是否由NSCLC成分细胞分化形成,实验进行了NSCLC细胞特异性标志物免疫细胞化学染色。结果发现特异性标志物阳性率分别是:TTF-1为92.88%(300/323)(图2A)、CK7为93.81%(303/323)(图2B)、CK5/6为8.98%(29/323)、CD133为89.78%(290/323)、SPA为68.11%(220/323)、SPB为55.73%(180/323)。
2.4 VM现象中脉管样管型结构内皮细胞标志物的表达鉴于在VM现象中有脉管样管型形成,为鉴定新分化形成的类脉管结构是否具有真正的脉管系统功能,本实验对其进行了血管内皮及淋巴管内皮细胞的免疫标志物染色,结果发现各标志物均呈不同程度的表达。其中血管内皮细胞标志物的阳性率分别是:CD105为65.33%(211/323)、CD34为69.04%(223/323)(图2C)、CD31为75.54%(244/323)、FⅧRAg 为55.42%(179/323),淋巴管内皮细胞标志物阳性率分别为:D2-40为76.78%(248/323)(图2D)、LYVE-1为72.76%(235/323),同时,FGF和VEGF的阳性率分别为75.54%(244/323)和77.71%(251/323)。
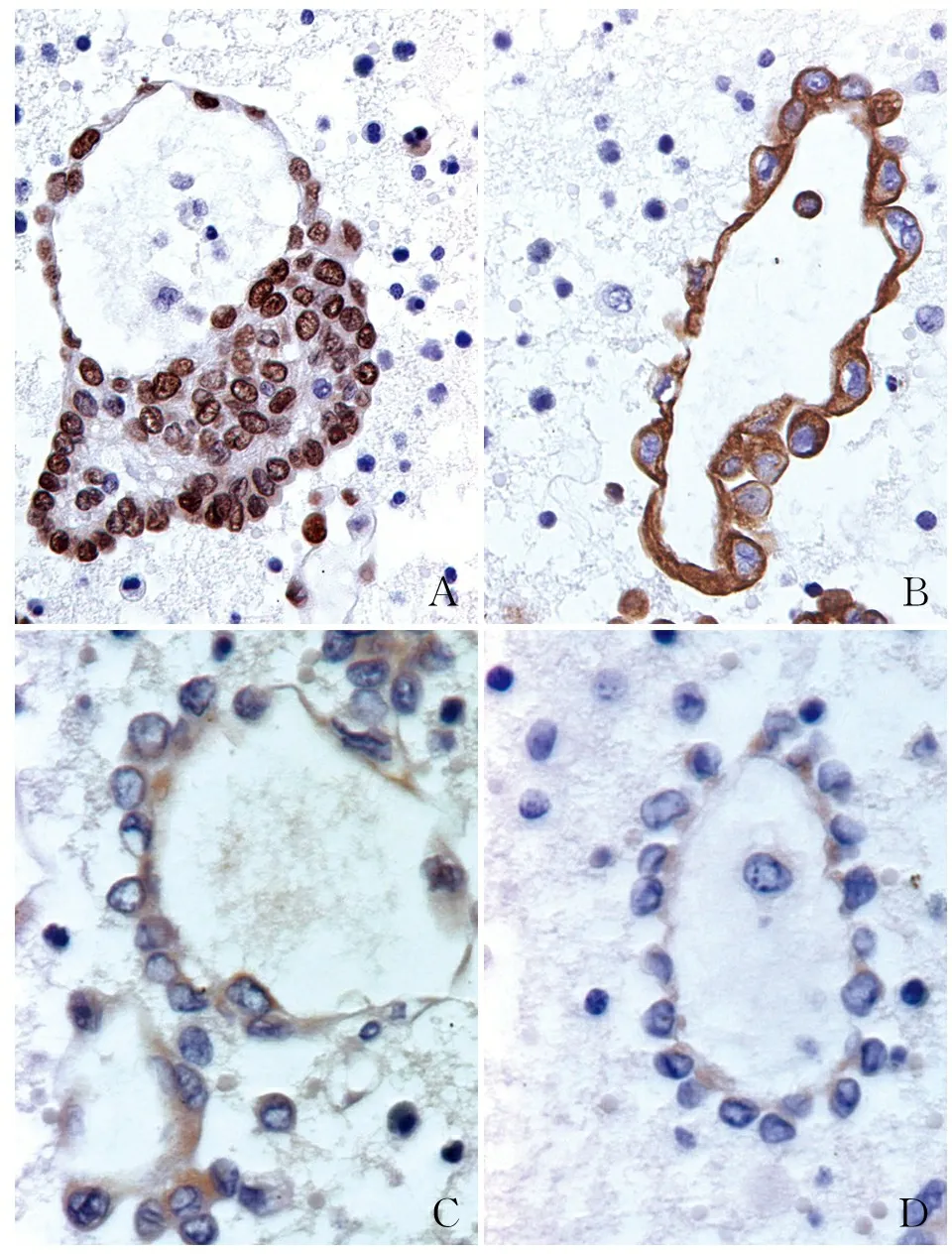
ABCD
2.5 免疫荧光染色结果MPE中NSCLC脱落细胞分化形成的脉管样管型结构经免疫荧光染色发现,脉管内皮细胞标志物CD105、D2-40、LYVE-1、CD31、CD34、FⅧRAg均阳性(图3)。
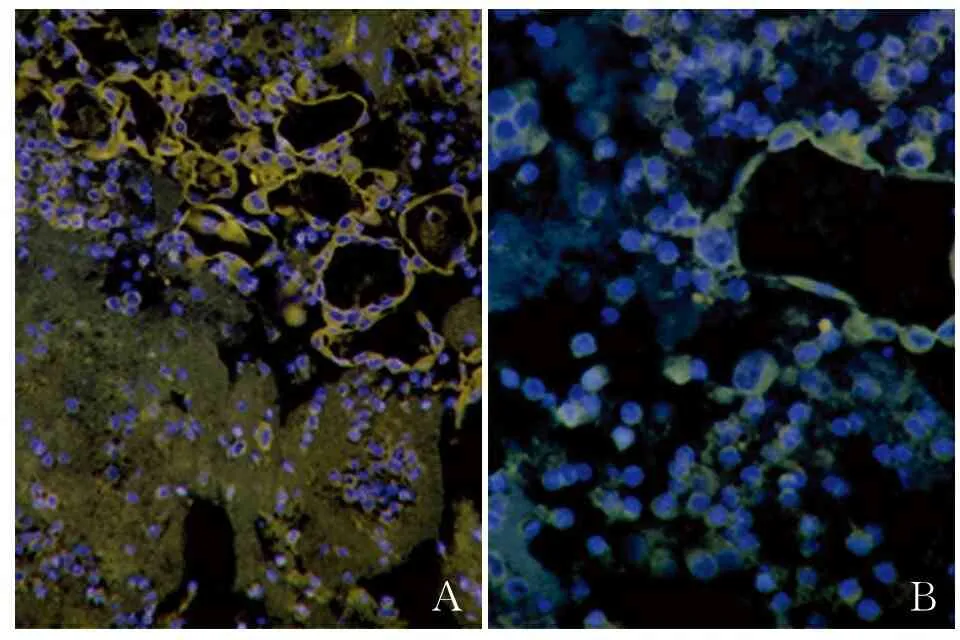
AB
3 讨论
近年来NSCLC的发病率逐年增加,且越发年轻化,尤其在新冠疫情常态化管理的当下,肺CT检查率增加,这使得一些早期症状不明显的肺患者被发现。然而,绝大部分患者发现即为晚期,已发生转移。恶性肿瘤区别于良性肿瘤,就是因为其具有侵袭和转移的能力,对机体危害大,甚至常因其而致命。肿瘤侵袭和转移过程是呈动态变化且极其复杂的,主要包括基因水平的失衡、营养新生血管的生成、细胞间基质的变化及微环境的变化等[10]。其中血管生成是一关键环节。20世纪70年代初,Folkman[11]提出“肿瘤细胞的生长、浸润和转移均依赖于肿瘤组织内新生血管生成”的理论,成为肿瘤研究领域的重要里程碑。然而,临床治疗过程中抗肿瘤血管生成的临床疗效并不理想,学者们便设想VM现象的存在。VM现象是一种由非内皮细胞组成的微血管通道,其是由恶性肿瘤细胞和一种PAS染色阳性的细胞外基质组成的,其形成主要包括恶性肿瘤细胞的自身变形、细胞外基质的重塑以及由此产生的与现有血管相连的脉管样结构,进而为肿瘤生长提供了充足的血液供应[12-15]。在VM现象中,由非内皮细胞排列的脉管样管腔结构是由多能干细胞、高侵袭性的肿瘤细胞和细胞外基质构成,其模拟了血管的功能,使红细胞可以通过血管流动,并具有替代功能,当依赖于内皮细胞的血管生长跟不上肿瘤组织的生长时,一些肿瘤细胞就会改变原有的功能,模仿内皮细胞的功能,这些机制都表明VM现象在恶性肿瘤的血液供应中起着重要作用[12,16-17]。在近年来,通过激光扫描共聚焦血管造影、电子显微镜、三维细胞培养等先进技术,先后在乳腺癌、肝癌、胶质瘤、卵巢癌、黑色素瘤、前列腺癌等恶性肿瘤中证实了VM的存在。
鉴于此,我们设想,肿瘤组织学中常见的血管新生和VM现象在NSCLC患者MPE肿瘤细胞中是否也存在呢?NSCLC患者MPE中脱落的肿瘤细胞具备恶性程度高、分化程度低和可塑性强的特点,在失去血液供应低氧条件下,在胸水中为了适应这种缺氧微环境是否会进行自我调整,进而分化形成新生血管和具有VM的形态结构和功能。本实验对 1 425 例胸水标本采用TCT技术进行制片诊断,最终确认323例NSCLC,发现在TCT细胞学制片下肿瘤细胞或呈紧密排列的彩球状,或呈鳞片状,或是灯泡状排列的结构。沉渣包埋HE染色中发现上述形态结构的肿瘤细胞分化形成不同形态的脉管样管型结构。通过免疫组化证实,排列成脉管样结构的肿瘤细胞表达TTF-1、SPA、SPB、CK7、CK5/6等肿瘤标志物,验证了构成脉管样结构的这些细胞为肿瘤细胞。同时,本实验又对其进行脉管上皮相关抗体标记,发现CD105、CD34、CD31、FⅧRAg、D2-40、LYVE-1等标志物均阳性。对于肿瘤细胞中与血管内皮相关抗体的表达,有学者认为,可以通过肿瘤干细胞的可塑性来解释。有研究在神经母细胞肿瘤中发现,肿瘤干细胞具有向内细胞分化的能力[18-21]。本研究结合上述结果得出,NSCLC胸腔积液中的脱落肿瘤细胞能够形成脉管样管型结构,其中一部分的形成机制为VM或血管新生,另一部分来自于肿瘤细胞分化形成的脉管样结构,具有内皮细胞功能,但机制不清。因此,作者大胆提出了肿瘤细胞-脉管样管型假说,即在细胞学中,NSCLC患者胸腔积液中的脱落肿瘤细胞(上皮细胞)为了克服低氧微环境可以向血管内皮和(或)淋巴管内皮细胞分化并形成脉管样管型结构。肿瘤细胞这种脉管样管型的形成有利于肿瘤细胞间的物质交换和代谢,充当了“制氧机”的作用,加快了肿瘤细胞进一步侵袭和转移。CD133为肿瘤干细胞标志物,在本研究中其染色为阳性,作者推测肿瘤细胞具有干细胞的功能,在外界环境需要的情况下分化为不同功能的细胞,对自身生存提供有利的环境。肿瘤细胞脉管样结构在分化过程中可能与新生的正常血管内皮细胞或淋巴管内皮细胞连接,最终嫁接到正常的某一段血管或淋巴管,进入血液淋巴循环通道,形成新的转移灶。
NSCLC常规治疗往往对进展NSCLC的疗效有限,总的5年生存率仅为15%[22]。因此,抑制肿瘤血管生成就成为肿瘤治疗的核心策略之一,研究NSCLC的血管新生和血管生成机制将为探索肿瘤血管生成抑制剂治疗肺癌提供坚实的理论基础。本实验为深入理解肿瘤血管形成的原理和分子机制以及探索临床上抗肿瘤血管生成药物治疗的新靶标提供了前期基础。
